IBDV感染雏鸡外周血液淋巴细胞chMDA5信号通路因子表达的动态变化
2015-03-22王成成刘超男栾亚男李广兴张瑞莉
王成成,葛 铭,刘超男,栾亚男,李广兴,张瑞莉
(东北农业大学动物医学学院,哈尔滨 150030)
IBDV感染雏鸡外周血液淋巴细胞chMDA5信号通路因子表达的动态变化
王成成,葛 铭,刘超男,栾亚男,李广兴,张瑞莉*
(东北农业大学动物医学学院,哈尔滨 150030)
为研究鸡MDA5(chMDA5)及其信号通路因子在传染性法氏囊病病毒(IBDV)感染雏鸡体内的表达情况,将40只14日龄SPF雏鸡随机分为感染组和对照组,感染组雏鸡经点眼、滴鼻方式给予IBDV液,对照组雏鸡于相同日龄、相同途径给予相同剂量PBS,于感染后第1、4、7及21天采取雏鸡外周血液并分离淋巴细胞,采用实时荧光定量PCR方法检测雏鸡外周血液淋巴细胞chMDA5信号通路因子mRNA转录及IBDV载量的动态变化。结果表明,IBDV感染雏鸡后第4天病毒载量较感染后第1天明显升高,之后逐渐下降;雏鸡淋巴细胞chMDA5及其信号通路因子表达量在感染后第4天均有明显的上升(P<0.01或P<0.05),感染后第7—21天又出现下调。IBDV能够激活雏鸡体内chMDA5信号通路,并且IBDV复制与chMDA5信号通路因子的表达有着密切关系。
IBDV;chMDA5;雏鸡;外周血液淋巴细胞
机体的天然免疫系统在抵抗病毒感染方面发挥着重要作用。病毒感染宿主细胞后,宿主细胞可以通过模式识别受体(pattern recognition receptors,PRR)识别病原相关分子模式( pathogen associated molecule patterns,PAMP),从而区别病原生物与机体自身[1]。RIG-I样受体(RIG-I like receptors,RLRs)是一类新发现的能够特异性识别细胞质中病毒dsRNA的模式识别受体。RLRs家族成员主要包括三个:视黄酸诱导基因-I(retinoic acia-induced gene I,RIG-I)、黑色素瘤分化相关基因5(melanoma differentiation associated gene 5,MDA5)和LGP2(laboratory of genetics and physiology 2),能够识别细胞质中的病毒 RNA,诱导干扰素和促炎症细胞因子的产生,在抗病毒天然免疫的建立方面起着至关重要的作用。其中,MDA5 在体内的表达十分广泛,主要依赖位于线粒体外膜的衔接蛋白分子即IFN-β启动子激活因子1(IFN-β-promoter stimulator 1,IPS-1)启动特异性的信号通路,介导抗病毒效应。MDA5激活的信号转导途径对机体启动抗病毒天然免疫发挥着重要作用[2]。鸭拥有完整的RIG-I受体,在A型流感病毒感染的时候被激活从而上调IFN-β表达,相比之下,鸡缺乏这种RNA解旋酶。鸡的胚胎成纤维细胞系DF-1细胞对RIG-I配体无免疫反应,但将鸭RIG-I基因转染到DF-1细胞后则可以检测这种RNA解旋酶,并诱导IFN-β启动子表达。也就是说,鸡细胞内可能缺乏RIG-I受体[3]。那么,鸡细胞内是否存在MDA5受体呢?研究发现,在RIG-I缺乏的鸡细胞内(包括DF-1成纤维细胞和HD-11巨噬细胞样细胞),MDA5活化介导IFN-β的合成分泌而发挥抗禽流感病毒作用[4-5]。
鸡传染性法氏囊病(infection bursal disease,IBD)是由双链RNA病毒科禽双链RNA病毒属法氏囊炎病毒(infection bursal disease virus,IBDV)引起的一种鸡的急性高度接触性免疫抑制传染病[6]。已证实,相对较长的dsRNA(>1 kb)可被MDA5选择性识别,而短的dsRNA(<1 kb)则依赖于RIG-I的识别[7]。IBDV基因序列全长A段为3.2~3.4 kb,B段为2.4 kb[8],那么,MDA5信号转导通路是否参与IBDV感染过程?C.C.Lee等最新体外研究发现,DF-1细胞内MDA5能够识别IBDV[9],但是,在复杂的鸡体内,IBDV感染是否激活MDA5信号转导通路,至今未见有报道。因此,本项研究拟从能够特异性识别dsRNA 病毒的模式识别受体MDA5及其信号转导入手,以雏鸡为研究对象,研究雏鸡感染IBDV后,其外周血液淋巴细胞chMDA5信号转导通路中衔接蛋白分子(chIPS-1)、转录因子(chIRF3)及其诱导产物(chIFN-β)表达变化,从雏鸡体内抗病毒模式识别及信号转导的角度在分子水平阐明IBDV致雏鸡发病机制,为防制雏鸡IBD提供新的科学思路。
1 材料与方法
1.1 病毒及实验动物
IBDV JIC7株,TCID50为105.5·0.1 mL-1,购自中国兽医药品监察所。
SPF雏鸡40只,购自中国农业科学院哈尔滨兽医研究所SPF实验动物中心。
1.2 主要试剂和仪器
SYBR Green Realtime PCR Master Mix购自TOYOBO公司;Trizol Reagent购自Invitrogen公司;M-MLV反转录酶、RNA酶抑制剂均购自大连宝生物工程有限公司;鸡淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司;ABI 7500荧光定量PCR仪,Life Technologies产品。
1.3 实验动物分组及处理
将40只SPF雏鸡随机分为感染组和对照组,每组20只。其中,感染组雏鸡于14日龄经点眼、滴鼻方式给予IBDV液,每只0.6 mL,对照组雏鸡于相同日龄、相同途径给予相同剂量PBS。两组雏鸡分别严格隔离饲养。在感染IBDV后第1、4、7、21天,每组随机抽取5只雏鸡,心脏采血,经抗凝处理后按照淋巴细胞分层液说明书分离淋巴细胞。
1.4 雏鸡外周血淋巴细胞总RNA的提取与反转录
参照Trizol试剂盒说明书进行雏鸡外周血淋巴细胞总RNA的提取。之后参照反转录试剂盒说明书,将提取的总RNA反转录成cDNA,置于-20 ℃备用。
1.5 引物的设计与合成
根据GenBank上公布的chMDA5受体及其信号通路因子序列,在基因保守区内设计特异性的引物,用于实时荧光定量PCR反应检测chMDA5受体及其信号通路因子mRNA的转录情况。同时,根据GenBank上公布的chβ-actin基因序列设计特异性引物,作为参考基因,引物由博仕生物有限公司合成。引物序列见表1。
表1 chMDA5受体及其信号通路因子和参考基因目的片段扩增用引物
Table 1 The primers used to amplify the gene fragment of chMDA5 and its signaling pathway factors

基因Nameofprimers引物序列(5'-3')Sequences(5'-3')大小/bpFragmentssizeschMDA5GGAAGGCCTAGACATCAAAGAGTGCATCTTCACGTTCAACAGCTCCTG135chIPS-1TGCAGGGAGGCCATACACCAGTGTCCACCTCCCAAGGTGACCCGTG124chIRF3CTCTCTGACTCTTTCAACCTCTTCGTGCTGCCTGCTCCTGTGG260chIFN-βGCCCACACACTCCAAAACACTGTTGATGCTGAGGTGAGCGTTG151chβ-actinATTGCTGCGCTCGTTGTTCTTTTGCTCTGGGCTTCA173
1.6 雏鸡外周血液淋巴细胞chMDA5及其信号通路因子(chIPS-1、chIRF3、chIFN-β)mRNA的检测
实时荧光定量反应采用ABI Prism 7500实时荧光定量PCR仪进行检测,PCR反应程序:95 ℃预变性1 min,95 ℃变性15 s,60 ℃退火40 s,共40个循环,退火延伸时检测荧光信号。PCR反应体系:Mix 10 μL、PCR Forward Primer(10 μmol·L-1)0.6 μL、PCR Reverse Primer(10 μmol·L-1)0.6 μL、cDNA 2 μL、ROX 0.04 μL、H2O补全20 μL。对PCR结果采用2-ΔΔCt法进行分析,试验中由PCR仪设定统一的荧光阈值,PCR扩增信号达到阈值后,仪器将计算出此反应所需的循环数为Ct值。以chβ-actin为参考基因,各试验处理组中相对于对照组的ΔΔCt值根据以下公式计算:ΔΔCt值=感染组(目的基因Ct值-参考基因Ct值)-对照组(目的基因Ct值-参考基因Ct值)。利用公式计算出mRNA相对转录量为2-ΔΔCt。
1.7 雏鸡外周血液淋巴细胞IBDV载量的检测
1.7.1 IBDV-VP2实时荧光定量PCR标准曲线的绘制 将重组质粒T-IBDV-VP2(本实验室制备并保存)进行10倍倍比稀释:10-1、10-2、10-3、10-4、10-5、10-6、10-7,作为标准品模板,使用前测定原始质粒浓度并换算成质粒的拷贝数。用IBDV实时荧光定量PCR引物(上游引物为CAAACCTGCAAGATCAAACC,下游引物为AAGCCAGGGAAAAAGACAA,预期扩增片段长度为184 bp)进行荧光定量PCR扩增,并绘制标准曲线。PCR程序及体系同1.6。以不同浓度标准品的对数值为横坐标,以PCR反应中荧光信号达到阈值所用的Ct值为纵坐标绘制T-IBDV-VP2标准曲线。
1.7.2 IBDV载量动态变化检测 以1.5制备的雏鸡外周血液淋巴细胞cDNA为模板,以IBDV 实时荧光定量PCR扩增引物进行实时荧光定量PCR反应,反应条件与反应体系同1.6。反应结束后,记录各试验样品的Ct值,将其代入T-IBDV-VP2标准质粒绘制的标准曲线建立的回归方程,可以得出相应试验组病毒的拷贝数。
1.8 数据统计与分析
采用Graph PadPrism软件进行数据处理,经方差法分析组间差异性。
2 结 果
2.1 雏鸡外周血液淋巴细胞IBDV载量的动态变化
以不同浓度标准品的对数值为横坐标,以PCR反应中荧光信号达到阈值所用的Ct值为纵坐标绘制T-IBDV-VP2标准曲线,标准品的对数值与Ct值之间成线性关系,反应的相关系数R2=0.999 286,T-IBDV-VP2质粒扩增效率为90.1%,获得回归方程:Y=-3.585 967X+30.30。将各感染组测得的Ct值代入方程,可以得出相应感染组病毒拷贝数,根据各拷贝数,绘制病毒含量的动态变化图,如图1所示,雏鸡感染IBDV后第4天,其外周血液淋巴细胞IBDV载量与感染后第1天相比迅速升高并且达到峰值,之后逐渐下降,感染后第21天IBDV载量与感染后第1天基本持平。
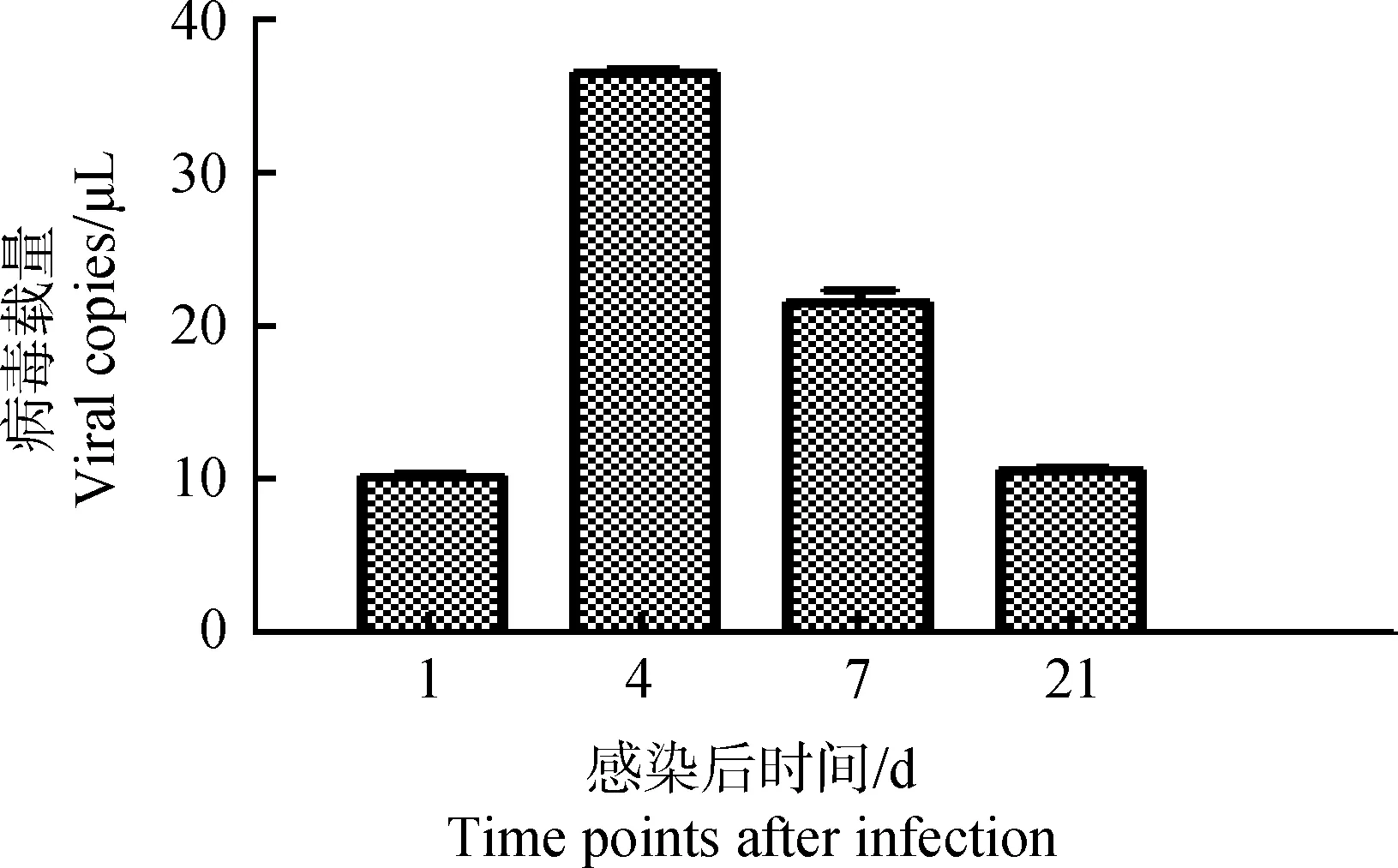
图1 雏鸡外周血液淋巴细胞IBDV载量动态变化Fig.1 Dynamics changes of the viral load in chick peripheral blood lymphocytes
2.2 雏鸡外周血液淋巴细胞chMDA5、chIPS-1、chIRF3、chIFN-βmRNA表达的动态变化
雏鸡感染IBDV后,其外周血液淋巴细胞chMDA5 mRNA的表达量在感染后第1天略低于对照组,但到感染后第4天,chMDA5 mRNA表达量极显著升高且达到峰值(P<0.01),之后显著降低,在感染后第7天其表达明显低于对照雏鸡(P<0.05),但在感染后第21天chMDA5 mRNA表达量又升高(P<0.05),如图2。
**表示感染组细胞mRNA相对表达量与相应时间点对照细胞比较差异极显著(P<0.01);*表示感染组细胞mRNA相对表达量与相应时间点对照细胞比较差异显著(P<0.05),无标记表示差异不显著(P>0.05)。以下各图同The letter “**” shows the relative expression of mRNA significantly different at 0.01 level compared with control group,the letter “*” shows the relative expression of mRNA significantly different at 0.05 level compared with control group and differ quietly(with unlabeled,P>0.05).The following is same as here图2 雏鸡外周血液淋巴细胞chMDA5 mRNA转录表达的动态变化Fig.2 Dynamic changes of the chMDA5 mRNA in chick peripheral blood lymphocytes
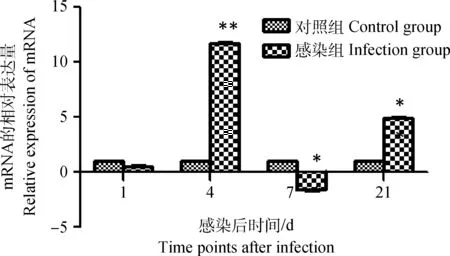
雏鸡感染IBDV后第 1天,其外周血液淋巴细胞chIPS-1 mRNA表达量明显低于对照细胞(P<0.05),之后表达量呈上升趋势,至感染后第4天达到峰值(P<0.01),在第7天表达量明显下调并且低于对照组(P<0.05),但在感染后第21天,chIPS-1 mRNA表达量又出现小幅上升(P<0.05),如图3。

图3 雏鸡外周血液淋巴细胞chIPS-1 mRNA表达的动态变化Fig.3 Dynamic changes of the chIPS-1 mRNA in chick peripheral blood lymphocytes
雏鸡感染IBDV后第1天,其外周血液淋巴细胞chIRF3表达量明显下调(P<0.01),但在感染后第4天又出现明显的上升趋势并且表达量达到峰值(P<0.01),之后下调,但在感染后第21天表达量再一次升高,并且与感染后第4天chIRF3表达量持平(P<0.01),如图4。
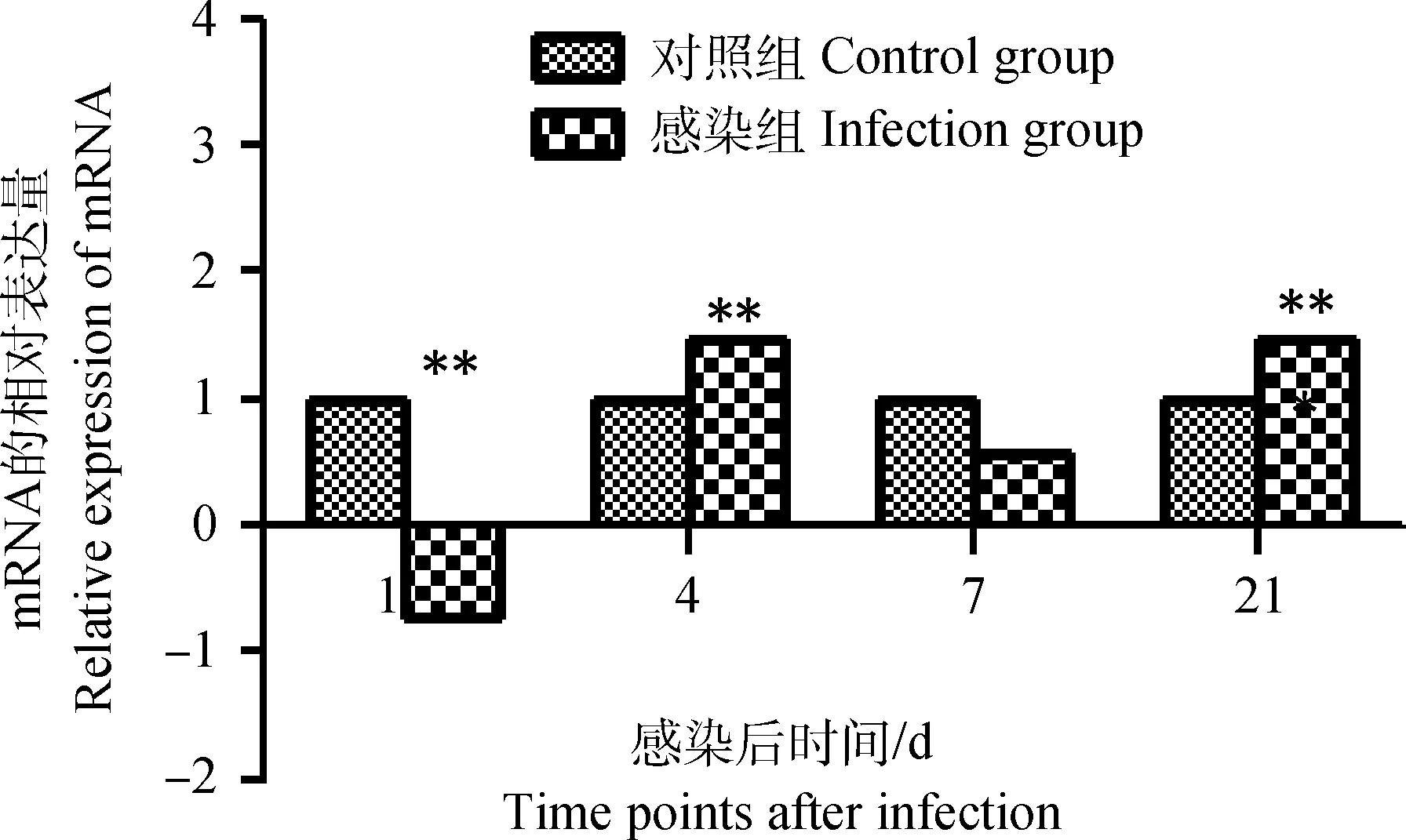
图4 雏鸡外周血液淋巴细胞chIRF3 mRNA表达的动态变化Fig.4 Dynamic changes of the chIRF3 mRNA in chick peripheral blood lymphocytes
雏鸡感染IBDV后第1天,其外周血液淋巴细胞chIFN-β mRNA表达量与对照组相比小幅升高(P<0.05),至感染后第4天达到峰值(P<0.01),在感染后第7天又显著下调出现负值(P<0.05),在第21天其表达量又升高且明显高于对照组(P<0.01),如图5。
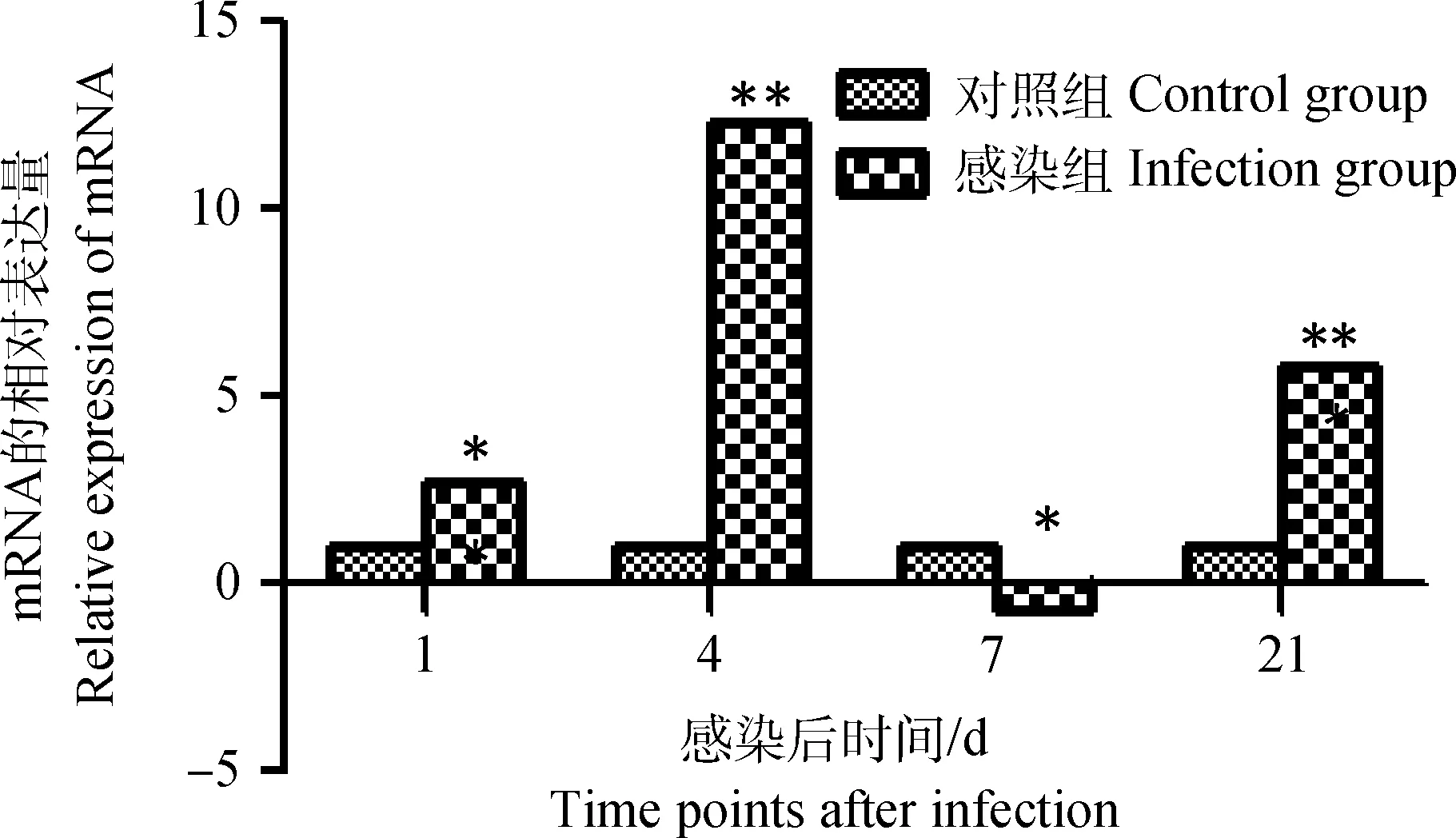
图5 雏鸡外周血液淋巴细胞chIFN-β mRNA表达的动态变化Fig.5 Dynamic changes of the chIFN-β mRNA in chick peripheral blood lymphocytes
3 讨 论
IBDV被动物机体固有免疫受体识别后,激活机体抗病毒免疫,主要是Ⅰ型干扰素及炎性细胞因子的活化。当dsRNA病毒感染机体后,MDA5识别病毒核酸,并通过蛋白-蛋白接触的方式与其下游衔接蛋白分子IPS-1结合,进而活化IκB及IκB激酶,这两类激酶活化转录因子NF-κB及IFR(IFN regulatory factor)并形成转录复合体,结合到IFN-β的启动子区域,促进IFN-β基因转录[10]。
本试验从mRNA水平检测雏鸡感染IBDV后,其外周血液淋巴细胞chMDA5及其信号转导通路中衔接蛋白分子(chIPS-1)、转录因子(chIRF3)及诱导产物(chIFN-β)转录的动态变化。结果发现,雏鸡感染IBDV后,其外周血液淋巴细胞chMDA5和chIFN-β转录量呈现先小幅下降然后显著上升,之后两者的表达量在感染后第7天又出现迅速下调。同时,本研究还发现,chMDA5 mRNA转录量的变化趋势与IBDV载量变化趋势相同,即IBDV病毒粒子拷贝数增加的同时chMDA5的转录量也相应增加,待chMDA5转录量有所下降时,IBDV的复制也受到抑制,表明IBDV在雏鸡外周血液淋巴细胞内的复制、增殖与chMDA5的表达存在着一定的关系。研究发现,MDA5的过量表达可增强IFN-β启动子活性[11],而流行性腮腺炎病毒和仙台病毒等副黏病毒的Ⅴ蛋白可通过其高度保守的C末端与MDA5结合,抑制MDA5介导的IFN-β启动子的转录活化,进而对整个信号通路产生抑制作用[12]。我们怀疑IBDV某部分结构蛋白也有此作用。
chMDA5信号通路因子chIPS-1和chIRF3基因转录量变化趋势与chMDA5相似,在感染IBDV后第1天两者转录量均低于对照组,其中chIRF3表达量显著低于对照组,感染后第4天chIPS-1和chIRF3转录量均达到峰值,之后迅速下降,在第21天又出现小幅上调。原因在于MDA5通过CARD-CARD相互作用募集位于线粒体的配体蛋白IFN-β启动子刺激子(IPS-1)产生相应干扰素的同时与Fas相关的死亡域蛋白(FADD)作用[13],活化IRF3,进而促进各种细胞因子表达。IPS-1缺陷型小鼠暴露于RNA病毒,不能激活IRF3[14]。因此,我们了解到IPS-1是MDA5信号途径中心配体蛋白,IPS-1与MDA5下游多个信号分子相互作用对IRF3的激活和起始抗病毒反应起着核心作用。
近年来,对MDA5等非依赖型固有免疫受体的关注度日益提高,本试验通过实时荧光定量PCR的方法检测IBDV感染雏鸡MDA5信号通路因子的动态变化,发现chMDA5及其信号通路因子在雏鸡感染IBDV后的不同天数其基因转录量变化惊人的相似,这与MDA5信号通路相符。然而,IBDV感染鸡体第1天,MDA5信号通路中IRF3表达量的下降趋势比IPS-1更低,究其原因需要更深入的研究。了解IBDV感染对MDA5及其下游细胞因子的影响可为鸡传染性法氏囊病的预防和治疗奠定基础。
4 结 论
IBDV能够激活雏鸡体内chMDA5信号通路,并且IBDV复制与chMDA5信号通路因子的表达密切相关。
[1] AKIRA S,UEMATSU S,TAKEUCHI O.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783-801.
[2] KATO H,TAKEUCHI O,SATO S,et al.Differential roles of MDA5 and RIG-I helicases in the recognition of RNA viruses[J].Nature,2006,441(7089):101-105.
[3] BARBER M R W,ALDRIDGE J R,WEBSTER R G,et al.Association of RIG-I with innate immunity of ducks to influenza[J].ProcNatlAcadSciUSA,2010,107(13):5913-5918.
[4] KARPALA A J,STEWART C,MCKAY J, et al.Characterization of chicken MDA5 activity:regulation of IFN-β in the absence of RIG-I functionality[J].JImmunol,2011,86(9):5397-5405.
[5] LINIGER M,SUMMERFIELD A,ZIMMER G,et al.Chicken cells sense influenza A virus infection through MDA5 and CARDIF signaling involving LGP2[J].JVirol,2012,86(2):705-717.
[6] CALNEK B W.禽病学[M].高 福,刘文军,译.北京:北京农业大学出社,1991:554-556. CALNEK B W.Poultry science[M].GAO F,LIU W J,translation.Beijing:Beijing Agricultural University Press,1991:554-556.(in Chinese)
[7] KATO H,TAKEUCHI O,MIKAMO-SATOH E,et al.Length-dependent recognition of double-stranded ribonucleic acids by retinoic acid-inducible gene-I and melanoma differentiation-associated gene 5[J].JExpMed,2008,205(7):1601-1610.
[8] PETKOV D,LINNEMANN E,KAPCZYNSKI D R,et al.Full-length sequence analysis of four IBDV strains with different pathogenicities[J].VirusGenes,2007,34(3):315-326.
[9] LEE C C,WU C C,LIN T L.Chicken melanoma differentiation-associated gene 5(MDA5) recognizes infectious bursal disease virus infection and triggers MDA5-related innate immunity[J].ArchVirol,2014,159(7):1671-1686.
[10] HEMMI H,TAKEUCHI O,SATO S,et al.The roles of two IκB kinase-related kinases in lipopolysaccharide and double stranded RNA signaling and viral infection[J].JExpMed,2004,199(12):1641-1650.
[11] ANDREJEVA J,CHILDS K S,YOUNG D F,et al.The V proteins of paramyxoviruses bind the IFN-inducible RNA helicase,mda-5,and inhibit its activation of the IFN-β prompter[J].ProcNatlAcadSciUSA,2004,101(49):17264-17269.
[12] RAMACHANDRAN A,HORVATH C M.Dissociation of paramyxovirus interferon evasion activities:universal and virus-specific requirements for conserved V protein amino acids in MDA5 interference[J].JVirol,2010,84(21):11152-11163.
[13] 谢广成,段招军.抗病毒感染固有免疫应答的信号转导[J].病毒学报,2012,28(3):303-310. XIE G C,DUAN Z J.Signal transduction of innate immunity to virus infection[J].ChineseJournalofVirology,2012,28(3):303-310.(in Chinese)
[14] SUN Q,SUN L,LIU H H,et al.The specific and essential role of MAVS in antiviral innate immune responses[J].Immunity,2006,24(5):633-642.
(编辑 白永平)
Dynamic Changing in the Expression of chMDA5 Signal Pathway Factors in Peripheral Blood Lymphocytes of Chicken Infected with IBDV
WANG Cheng-cheng,GE Ming,LIU Chao-nan,LUAN Ya-nan,LI Guang-xing,ZHANG Rui-li*
(CollegeofVeterinaryMedicine,NortheastAgriculturalUniversity,Harbin150030,China)
The present study investigated the expression of chick melanoma differentiation associated gene 5(chMDA5) and its signaling pathway factors in chickens infected with infectious bursal disease virus(IBDV).Fourty 14-day-old specific pathogen free(SPF) chickens were randomly allocated into 2 groups which were infected and control groups.The infected group of chickens was inoculated with IBDV by intraocularly and intranasally.Meanwhile,the control group chickens were administered with PBS by intraocularly and intranasally.Peripheral blood lymphocytes were isolated at the 1st,4th,7th and 21st day after infection.Real-time fluorescence quantitative PCR method was used to detect the mRNA expression levels of chMDA5 signal pathway factors and the IBDV loads in peripheral blood lymphocytes of chickens.The results showed that the viral loads of IBDV-infected chickens in peripheral blood lymphocytes on the 4th day were significantly higher than that in the 1st day,and then gradually declined.The expression of chMDA5 and its downstream targets genes were significantly increased(P<0.01orP<0.05) at the 4th day after infection,then reduced at 7-21 day than that in the control group.The results indicated that IBDV could activate the chMDA5 signaling pathways in chickens.In addition,the replication of IBDV had closely relationship with the expression of chMDA5 signaling pathways factors.
IBDV;chMDA5;chickens;peripheral blood lymphocyte
10.11843/j.issn.0366-6964.2015.05.020
2014-09-12
国家自然科学基金资助项目(31272533)
王成成(1988-),女,辽宁辽阳人,硕士生,主要从事预防兽医学研究
*通信作者:张瑞莉,E-mail:zhangruil@neau.edu.cn
S852.659.4
A
0366-6964(2015)05-0830-06
