细胞适应性猪流行性腹泻病毒部分基因序列分析及其致病力研究
2015-03-22冯晓声王悦芸周如月安欣宇王贵平贾爱卿
冯晓声,刘 琪,王悦芸,周如月,安欣宇,王贵平,贾爱卿
(广东海大畜牧兽医研究院,广州 511400)
细胞适应性猪流行性腹泻病毒部分基因序列分析及其致病力研究
冯晓声,刘 琪,王悦芸,周如月,安欣宇,王贵平,贾爱卿*
(广东海大畜牧兽医研究院,广州 511400)
对已经适应Vero细胞生长的猪流行性腹泻病毒CHYJ130330亲本代、第38代、第60代、第80代和第100代病毒的S、M、N基因分别进行测序及序列比对分析,结果显示M和N基因具有高度的保守性,多次传代后未发生氨基酸的改变;S基因在第38代时未发生任何突变,第100代时发生了17个核苷酸的点突变,导致15个氨基酸发生改变。动物试验显示,第60代病毒仍能引起仔猪呕吐、腹泻等症状,而第100代的病毒毒力已经减弱。S基因的突变是否与病毒的毒力减弱有关还需进一步试验验证。
猪流行性腹泻病毒;突变;S基因;毒力减弱
猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)是尼多目(Nidovirales)、冠状病毒科(Coronaviridae)、冠状病毒属(Coronavirus)1群的成员,是有囊膜的单股正链RNA病毒,基因组大小约为28 kb[1]。猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒引起的猪的一种急性高度接触性肠道传染病。以严重的肠炎、呕吐和水样腹泻为主要特征,各年龄的猪均易感,尤以2~7日龄仔猪最易感,表现为高发病率和高致死率[2-3],给养猪业造成了巨大的经济损失[4-5]。
PEDV的S蛋白为纤突糖蛋白,介导病毒与细胞的吸附和融合,能够诱导机体产生中和抗体[6]。M蛋白是病毒含量最高的蛋白质,属于跨膜蛋白质,在病毒装配及出芽过程中发挥重要的作用,该蛋白质也是PEDV刺激机体产生抗体保护的重要结构蛋白之一[1]。N蛋白是冠状病毒的主要结构蛋白之一,为碱性氨基酸富集的磷酸化蛋白质[7-8],不仅与病毒的转录和复制有关[9-10],而且还是具有免疫原性的蛋白质[11-12],也是免疫识别相关靶点,并且在刺激机体的体液免疫和细胞免疫中起重要作用[13]。
目前使用的商品疫苗毒株CV777是经过传代驯化,适应Vero细胞生长的一个病毒株。有文献报道冠状病毒经体外多次传代培养后会出现体外适应细胞生长,体内毒力减弱的现象[14]。为了探讨PEDV在体外生长的适应性和体内毒力衰减的机制,我们对PEDV CHYJ130330株[15]的亲本代、第38代、第60代、第80代和第100代的S、M、N基因进行了测序和序列分析比对,并对其致病力进行了研究,以期找到它们之间的关系。
1 材料与方法
1.1 材料
1.1.1 病毒和细胞 PEDV不同代次病毒为本实验室在Vero细胞上连续传代获得,选取亲本强毒株CHYJ130330和第38、60、80和100代共5个代次的病毒株进行测序分析;DH5α由本实验室保存;pMD-18T克隆载体、限制性内切酶HindⅢ和BamHⅠ、LATaq及dNTPs等试剂均购自大连宝生物有限公司;凝胶回收试剂盒、Viral RNA Kit 购自OMEGA公司。One-step quickcolor Mycoplasma test kit购自广州雅怡生物有限公司。
1.1.2 引物 根据本实验室测定的亲本株序列设计5对引物,分别对S、M、N基因特异性扩增,由英潍捷基(上海)贸易有限公司合成(表1)。
表1 基因扩增引物序列
Table 1 Primer pairs for PCR amplification of the PEDVS,MandNgenes

引物名称Primername引物序列Primersequence位置Nucleotides片段大小/bpSize退火温度/℃TmS1-1S1-25'-ATCATTTGGTCAACGTAAACAA-3'5'-GAGAACACTTGTTGGCTAA-3'20634—2064921783—21804117055S2-1S2-25'-ACAATTAATTTCACTGGTC-3'5'-AATGCCGCTGCAGAGAAGT-3'21649—2166823030—23049140055S3-1S3-25'-ATAAAGTGGTTACTAATGGCC-3'5'-TATTGAAAAAGTCAAGAAACA-3'22933—2295424779—24794186155M1M25'-ACTTGTCACCGGTTGTGTAA-3'5'-CCAATTTGCTGGTCCTTATT-3'25687—2570326352—2636768152N1N25'-CGGTCAAAACACGGCGACTA-3'5'-CTACCCTGGAACATAGCCA-3'26379—2639627688—27704132656
1.2 病毒的纯化与传代
将分离所得的亲本强毒株CHYJ130330接种于长满单层Vero细胞的6孔板内,进行蚀斑纯化试验。当孔内出现蚀斑时,挑选较小的蚀斑接种1 mL DMEM中,并进行3次反复冻融。将冻融后的液体离心后取上清重复上述蚀斑纯化试验,总共重复3~4轮,直至所有蚀斑的大小和形态基本一致。然后将蚀斑纯化所得的病毒接种于Vero细胞中进行连续传代,每传至20~30代时,重新进行蚀斑纯化试验。
取亲本强毒株CHYJ130330、第38、60、80和100代病毒进行后续试验时,均分别检测细菌、霉菌、支原体以及外源病毒污染。细菌、霉菌和外源病毒检验均按照《中国兽药典》(2010版)进行;支原体检测按照One step quickcolour Mycoplamsa test kit说明书进行。
1.3 病毒核酸的提取
将PEDV CHYJ130330亲本代、第38、60、80和100代病毒液用Viral RNA Kit 按照说明书分别提取病毒核酸,-20 ℃保存备用。
1.4 PEDVS、M、N基因的扩增和克隆
分别取5 μL不同代次的上述病毒RNA反转录成cDNA,然后取1 μL作为模板,分别采用S1/S3、M1/M2和N1/N2进行PCR扩增,因S基因过长,所以分3段扩增测序后再进行拼接。50 μL扩增体系:10×LATaqBuffer 5.0 μL、2.5 mmol·L-1dNTPs 4.0 μL、10 pmol·μL-1引物各1.0 μL、反转录成cDNA 2.0 μL、5 U·μL-1LATaq酶0.5 μL,然后加ddH2O调整终体积至50 μL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,退火50 s(退火温度见表1),72 ℃ 30 s,共30个循环;72 ℃延伸10 min。扩增产物于1%琼脂糖凝胶中电泳回收,按照凝胶回收试剂盒说明书进行,回收产物分别将其连接在pMD-18T克隆载体中,转化DH5α感受态细胞,经质粒提取,限制性内切酶HindⅢ、BamHⅠ酶切鉴定初步筛选阳性克隆。
1.5 PEDVS、M、N基因的序列测定和分析
经鉴定的阳性克隆送英潍捷基(上海)贸易有限公司进行序列测定。测定结果分别利用MEGA4.1 Clustalx和DNAStar软件进行比对及遗传进化分析。
1.6 动物试验
将PEDV 的亲本代、第38、80和100代的病毒液经口服给予5日龄的PEDV阴性仔猪,105.0TCID50病毒液1 mL·头-1,每天人工哺乳,观察记录仔猪呕吐、腹泻情况,连续观察7 d。并收集仔猪粪便拭子,RT-PCR检测粪便中的PEDV情况。
2 结 果
2.1 PEDVS、M、N基因的扩增及克隆
分别以CHYJ130330亲本代、第38、60、80和100代的病毒cDNA为模板进行PCR扩增,S、M、N基因扩增产物与目的片段预期大小相符(图1、2)。
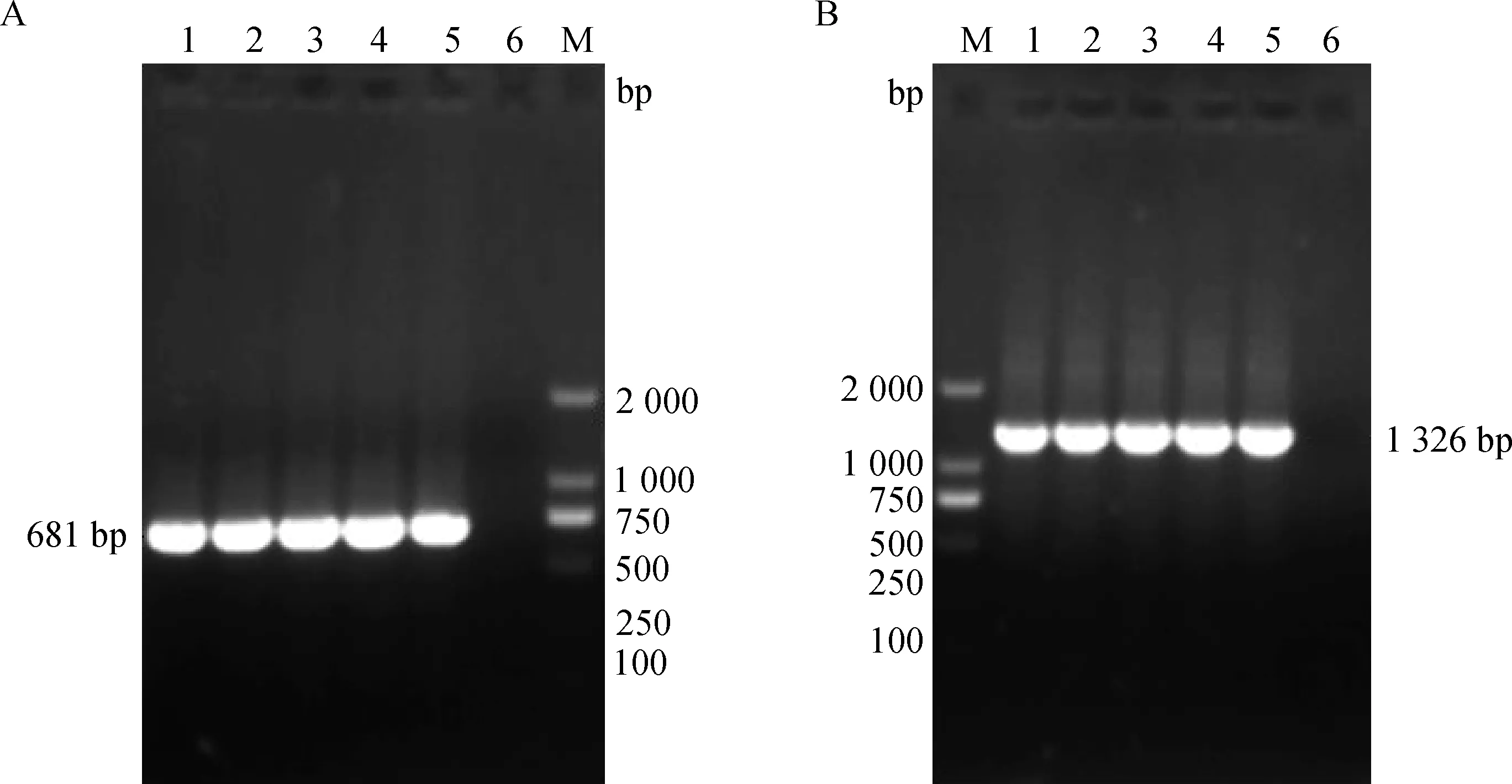
M.DL2000 DNA相对分子质量标准;1~5.CHYJ130330亲本代及第38、60、80和100代病毒;6.阴性对照M.DNA molecular weight marker DL2000;1-5.The parent,38th-passaged,60th-passaged,80th-passaged and 100th-passaged CHYJ130330 strain,respectively;6.Negative图1 M(A)、N(B)基因RT-PCR结果Fig.1 RT-PCR products of M (A),N(B) gene
2.2 序列测定及分析
对测序结果用MEGA4.1 Clustalx和DNAStar软件进行比对分析。
2.2.1M基因序列比对结果 不同代次病毒M基因测序发现,M基因共包含681个核苷酸,编码226个氨基酸。序列比对结果显示,第38代和第100代病毒的M基因第96位核苷酸G 突变为A,第38、60、80和100代病毒的第150位核苷酸A突变为T,但均未发生氨基酸的改变。
2.2.2N基因序列比对结果 测序结果发现N基因包含1 326个核苷酸,共编码441个氨基酸。序列比对结果显示,N基因的第21位、534位和1 020位核苷酸分别由G 突变为 A、C突变为T、C 突变为T,且均发生在第38、60、80和100代病毒中,为同义突变,未发生氨基酸的改变。
2.2.3S基因序列比对结果S基因分3段扩增(S1、S2、S3),测序完成后再进行拼接,拼接结果显示其包含4 161个核苷酸,共编码1 387个氨基酸(表2)。序列比对结果发现,病毒在第38代未发生序列改变,第60代和80代分别发生了12个核苷酸突变,其中10个位点的突变导致了氨基酸改变,分别是249位(F→C)、267位(T→N)、805位(S→I)、887位(S→R)、888位(G→R)、1 010位(I→T)、1 050位(N→T)、1 244位(D→G)、1 362位(C→G)和1 379位(V→A)(表2、图3)。病毒在100代的时候出现了17个核苷酸改变,导致15个氨基酸发生改变,除了与上述60代和80代病毒发生同样的改变外,分别在142位(A→D)、968位(S→P)、1 028位(L→V)、1 071位(Y→H)和1 354位(C→P)也发生了氨基酸的改变(表2、图3)。17个突变位点中3个位于S1区域内,其他12个都在S2区域内(图4)。
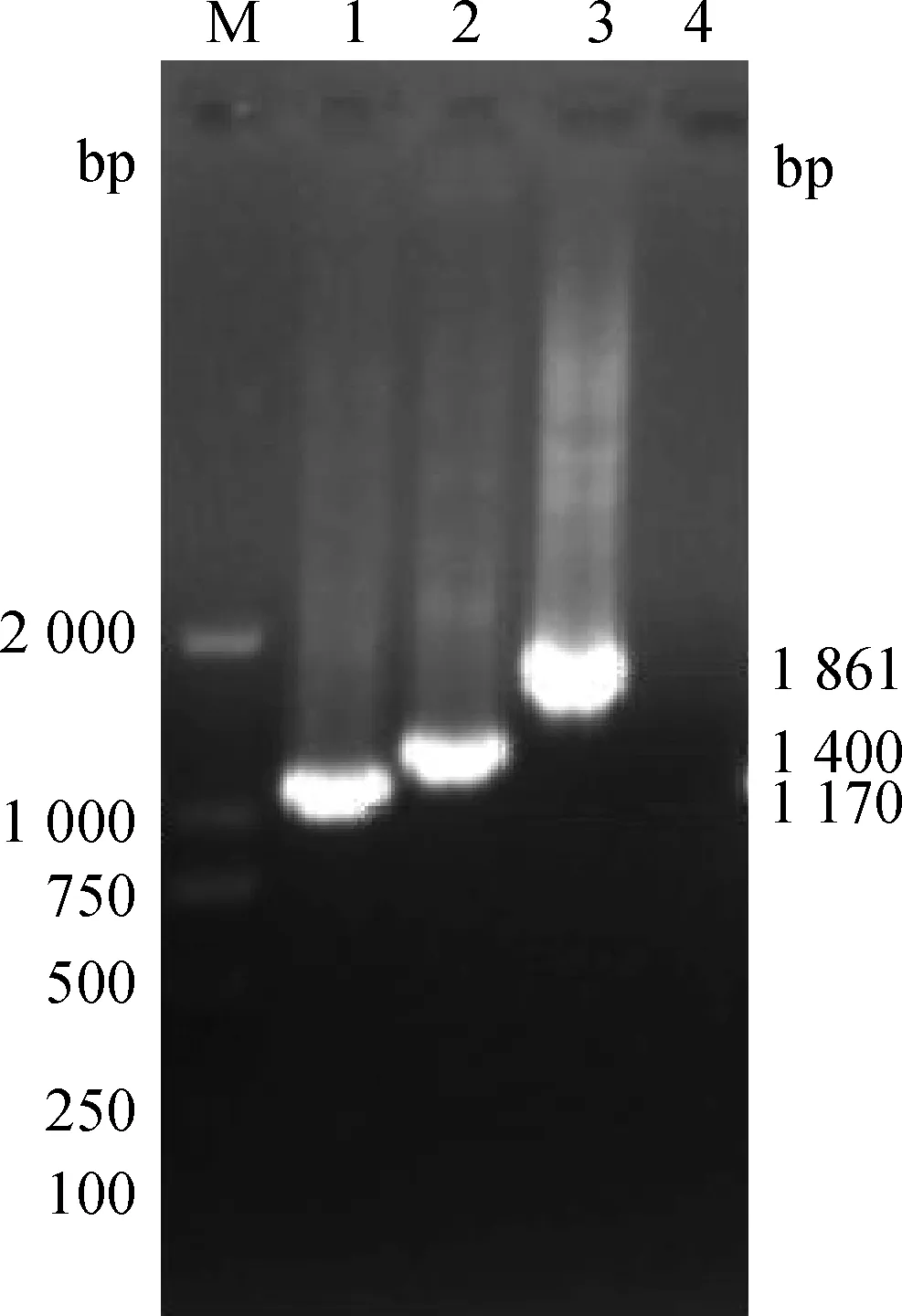
M.DL2000 DNA相对分子质量标准;1.S1;2.S2;3.S3;4.阴性对照M.DNA molecular weight marker DL2000;1.S1;2.S2;3.S3;4.Negative图2 S基因RT-PCR结果Fig.2 RT-PCR products of S gene
表2S基因发生突变的核苷酸和氨基酸数
Table 2 Lengths and mutations in nucleotides and amino acids of theSgene of CHYJ130330 strain

项目Item亲本代病毒Parentvirus不同传代次数病毒Differentpassagesofvirus386080100核苷酸数Nucleotide41614161416141614161氨基酸数Aminoacids13871387138713871387核苷酸突变数Nucleotidemutations--121217氨基酸替换Aminoacidsubstitutions--101015非同义替换Nonsynonymoussubstitutions--101015
2.3 PEDV致病性分析
仔猪试验结果发现,亲本代和第38代的病毒在仔猪灌服病毒液48 h内引起了仔猪呕吐、腹泻等症状,粪便拭子RT-PCR可检测到PEDV,持续至7 d。第80代病毒在仔猪灌服5 d后表现出轻微的腹泻症状,可在粪便中检测到PEDV。灌服第100代病毒的仔猪一直未出现腹泻现象,粪便拭子中也未检测到PEDV(表3)。
3 讨 论
猪流行性腹泻病毒N蛋白在其结构蛋白中是唯一包被于病毒包膜内的磷酸化蛋白,不仅与病毒的转录和复制有关[9-10],而且还是具有免疫原性的蛋白质[11-12],也是免疫识别相关靶点,并且在刺激机体的体液免疫和细胞免疫中起重要作用[13]。本研究中不同代次PEDVN基因的测序结果发现,核苷酸序列发生了三个位点的点突变,但并未引起任何氨基酸的改变,证实病毒的细胞传代培养不会导致N蛋白氨基酸的改变。M基因测序结果发现在第96位和150位发生了两个点突变,均为同义替换,未引起氨基酸发生改变,证实M基因较为保守,这与文献报道的M基因[13,16]具有高度的保守性一致。
PEDV的S蛋白主要介导机体产生中和抗体,根据冠状病毒其他成员S蛋白保守基序,可将其划分为S1(22—789 aa)和S2(790—1 333 aa)两个亚基[17],S1结构域介导受体结合,通过S2结构域介导膜融合[18]。CHYJ130330第100代病毒的S蛋白共出现了15处氨基酸替换,其中3处位于S1结构域中,12处出现在S2结构域中,S2介导膜融合功能,是否这些点突变引起了细胞病变的加快及其在Vero细胞上生长的适应性还需进一步的试验验证。有文献报道PEDV的S蛋白与体外的生长相适应,可使体内的毒力减弱[19-20]。本研究中对初生仔猪的攻毒试验显示,亲本代和第38代的病毒在仔猪灌服病毒液后48 h内均能引起仔猪较为严重的呕吐、腹泻等症状,粪便拭子RT-PCR检测为阳性,且持续至7 d。第80代病毒分别在仔猪灌服3和5 d后表现出轻微的腹泻症状,可在粪便中检测到PEDV。第100代病毒使仔猪偶尔可见腹泻现象,粪便拭子中检测不到PEDV,试验证实该病毒经传代后对仔猪的致病力减弱。是否是S蛋白的改变导致了PEDV对仔猪致病力的改变,亦或是M、N与S蛋白的突变协同作用所致,我们将进行进一步的试验验证。

点代表与CHYJ130330亲本相同的氨基酸Dots represent amino acids that are identical to those in the parent CHYJ130330图3 各代次病毒S基因编码蛋白质序列比对结果Fig.3 Alignment of the deduced amino acid sequences of the S protein of the parent and passaged PEDV CHYJ130330 strains with that of the parent
表3 仔猪发病情况
Table 3 Positive pigs with diarrhea and viral RNA in fecal swab samples
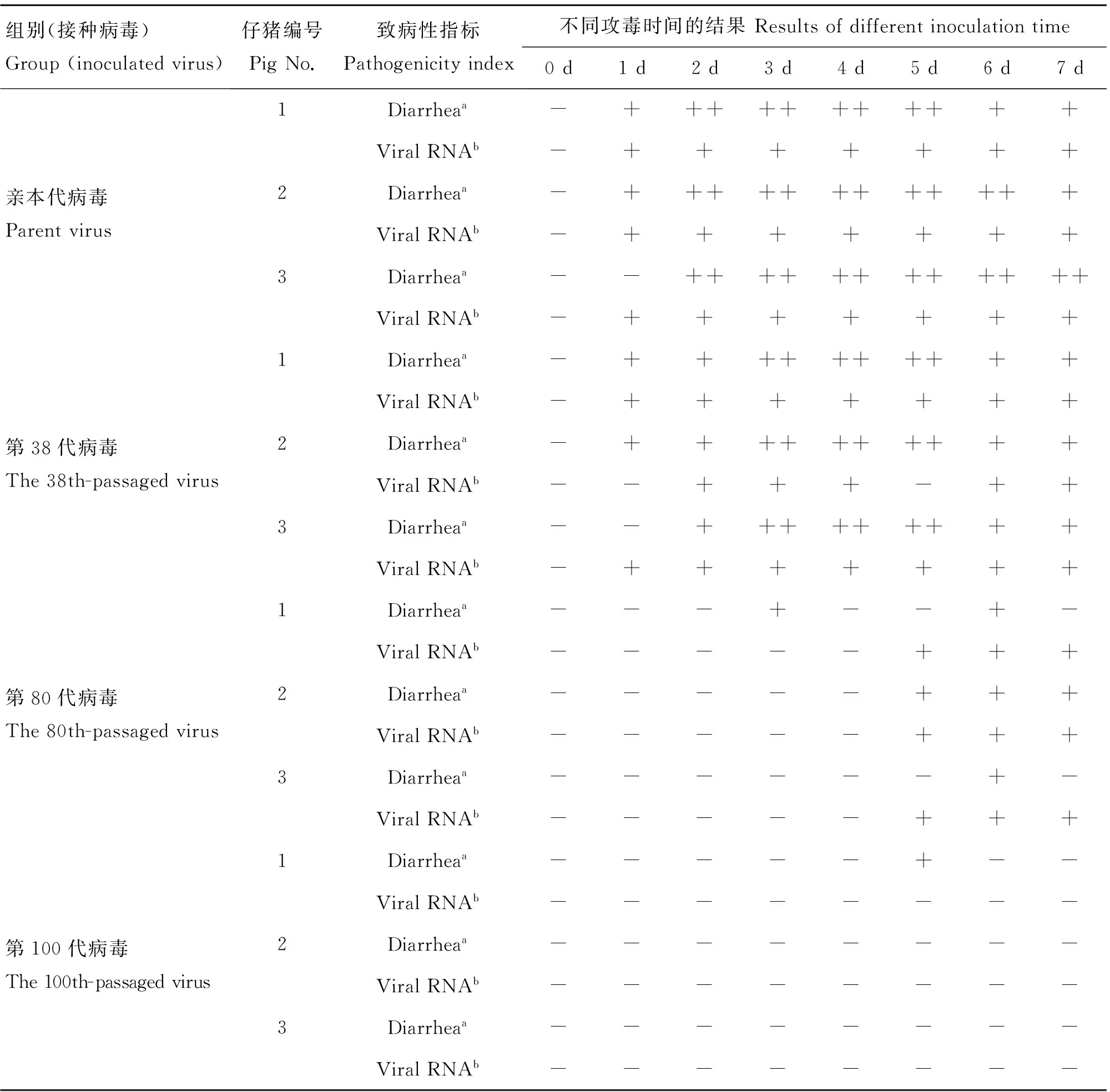
组别(接种病毒)Group(inoculatedvirus)仔猪编号PigNo.致病性指标Pathogenicityindex不同攻毒时间的结果Resultsofdifferentinoculationtime0d1d2d3d4d5d6d7d亲本代病毒Parentvirus1Diarrheaa-+++++++++++ViralRNAb-+++++++2Diarrheaa-++++++++++++ViralRNAb-+++++++3Diarrheaa--++++++++++++ViralRNAb-+++++++第38代病毒The38th-passagedvirus1Diarrheaa-++++++++++ViralRNAb-+++++++2Diarrheaa-++++++++++ViralRNAb--+++-++3Diarrheaa--+++++++++ViralRNAb-+++++++第80代病毒The80th-passagedvirus1Diarrheaa---+--+-ViralRNAb-----+++2Diarrheaa-----+++ViralRNAb-----+++3Diarrheaa------+-ViralRNAb-----+++第100代病毒The100th-passagedvirus1Diarrheaa-----+--ViralRNAb--------2Diarrheaa--------ViralRNAb--------3Diarrheaa--------ViralRNAb--------
a.正常粪便(-),轻微腹泻(+),腹泻(++);b.猪流行性腹泻病毒RT-PCR检测结果阳性(+)或阴性(-)
a.Normal stool (-),loose stool (+),diarrhea (++);b.Positive (+) or negative (-) results for RT-PCR of PEDV

图4 S基因各突变位点在S蛋白中的位置Fig.4 Schematic representation of mutations in the S protein of the parent,38th-,60th-,80th-,and 100th-passaged CHYJ130330
[1] STRAW B F,D’AALLAIRE S,MENGELING W L,et al.Disease of Swine[C].8th edition.Ames,IOWA USA:The Iowa University Press,1999.
[2] DEBOUCK P,PENSAERT M.Experimental infection of pigs with a new porcine enteric coronavirus,CV777[J].AmJVetRes,1980,41(2):219-223.
[3] DUCATELLE R,BURTONBOY G,COUSSEMENT W,et al.Concurrent parvovirus and distemper virus infections in a dog[J].VetRec,1981,108(14):310-311.
[4] 吕茂杰,陈建飞,时洪艳,等.猪流行性腹泻病毒核衣壳蛋白与感染细胞核磷蛋白的共定位分析[J].微生物学报,2011,51(5):643-647. LÜ M J,CHEN J F,SHI H Y,et al.Co-localization analysis between porcine epidemic diarrhea virus nucleocapsid protein and nucleolar phosphoprotein B23.1[J].ActaMicrobiologicaSinica,2011,51(5):643-647.(in Chinese)
[5] PURANAVEJA S,POOLPERM P,LERTWATCHARASARAKUL P,et al.Chinese-like strain of porcine epidemic diarrhea virus,Thailand[J].EmergInfectDis,2009,15(7):1112-1115.
[6] DE HAAN C A,KUO L,MASTERS P S,et al.Coronavirus particle assembly:primary structure requirements of the membrane protein[J].JVirol,1998,72(8):6838-6850.
[7] 朱卫霞,袁万哲,李丽敏,等.截短猪流行性腹泻病毒N蛋白的可溶性表达及其抗原活性[J].畜牧兽医学报,2014,45(9):1561-1566. ZHU W X,YUAN W Z,LI L M,et al.Prokaryotic soluble expression of trunked N protein of porcine epidemic diarrhea virus and its antigenic activity[J].ActaVeterinariaetZootechnicaSinica,2014,45(9):1561-1566.(in Chinese)
[8] 陈建飞.猪流行性腹泻病毒全基因组序列分析及感染性cDNA克隆的构建[D].哈尔滨:中国农业科学院哈尔滨兽医研究所,2012. CHEN J F.Analysis of complete genome sequences and construction of an infectious cDNA clone of porcine epidemic diarrhea virus[D].Harbin:Harbin Veterinary Research Institute of Chinese Academy of Agricultural Sciences,2012.(in Chinese)
[9] VAN DER MEER Y,SNIJDER E J,DOBBE J C,et al.Localization of mouse hepatitis virus nonstructural proteins and RNA synthesis indicates a role for late endosomes in viral replication[J].JVirol,1999,73(9):7641-7657.
[10] DENISON M R,SPAAN W J,VAN DER MEER Y,et al.The putative helicase of the coronavirus mouse hepatitis virus is processed from the replicase gene polyprotein and localizes in complexes that are active in viral RNA synthesis[J].JVirol,1999,73(8):6862-6871.
[11] NDIFUNA A,WATERS A K,ZHOU M,et al.Recombinant nucleocapsid protein is potentially an inexpensive,effective serodiagnostic reagent for infectious bronchitis virus[J].JVirolMethods,1998,70(1):37-44.
[12] SEAH J N,YU L,KWANG J.Localization of linear B-cell epitopes on infectious bronchitis virus nucleocapsid protein[J].VetMicrobiol,2000,75(1):11-16.
[13] 王靓靓.猪流行性腹泻病毒特性研究及其种毒制备[D].哈尔滨:东北农业大学,2013. WANG J J.Development of porcine epidemic diarrhea virus vaccine strain and characteristic[D].Harbin:Northeast Agricultural University,2013.(in Chinese)
[14] SATO T,TAKEYAMA N,KATSUMATA A,et al.Mutations in the spike gene of porcine epidemic diarrhea virus associated with growth adaptationinvitroand attenuation of virulenceinvivo[J].VirusGenes,2011,43(1):72-78.
[15] JIA A,FENG X,LIU Q,et al.Complete genome sequence of CHYJ130330,a highly virulent strain of porcine epidemic diahhea virus in south China[J].GenomeAnnounc,2014,2(2):e00165-14.
[16] SAIF L J.Coronavirus immunogens[J].VetMicrobiol,1993,37(3-4):285-297.
[17] 孙东波,冯 力,时洪艳,等.猪流行性腹泻病毒S蛋白中和表位区单克隆抗体的制备与鉴定[J].中国预防兽医学报,2007,29(11):887-890. SUN D B,FENG L,SHI H Y,et al.Preparation and characterization of the monoclonal antibodies against neutralizing epitope region of PEDV S protein[J].ChineseJournalofPreventiveVeterinaryMedicine,2007,29(11):887-890.(in Chinese)
[18] MADU I G,ROTH S L,BELOUZARD S,et al.Characterization of a highly conserved domain within the severe acute respiratory syndrome coronavirus spike protein S2 domain with characteristics of a viral fusion peptide[J].JVirol,2009,83(15):7411-7421.
[19] KWEON C H,KWON B J,LEE J G,et al.Derivation of attenuated porcine epidemic diarrhea virus(PEDV) as vaccine candidate[J].Vaccine,1999,17(20-21):2546-2553.
[20] SONG D S,YANG J S,OH J S,et al.Differentiation of a Vero cell adapted porcine epidemic diarrhea virus from Korean field strains by restriction fragment length polymorphism analysis of ORF 3[J].Vaccine,2003,21(17-18):1833-1842.
(编辑 白永平)
Mutations in Partial Genes of Porcine Epidemic Diarrhea Virus Associated with Growth Adaptationinvitroand Attenuation of Virulenceinvivo
FENG Xiao-sheng,LIU Qi,WANG Yue-yun,ZHOU Ru-yue,AN Xin-yu,WANG Gui-ping,JIA Ai-qing*
(GuangdongHaidInstituteofAnimalHusbandry&Veterinary,Guangzhou511400,China)
In this study,we further maintained the porcine epidemic diarrhea virus CHYJ130330 in Vero cells up to the 100th passage and analyzed changes in the spike(S),membrane(M),and nucleocapsid(N) gene sequences and pathogenicity of the virus at the 38th,60th,80th,and 100th passage levels.Sequence analyses revealed a strong selection for theSgene of CHYJ130330 in Vero cells,and all mutations occurring at the 60th,80th,and 100th-passage virus.In contrast,the viralMandNgenes showed a strong conservation during the serial passage.Pigs that experimentally infected with the 60th and 80th-passage virus,but not the 100th-passaged virus,exhibited vomiting and diarrhea,indicating an attenuation of the CHYJ130330 at the 100th passage.Further studies will be required to define whether the mutations in theSgene of CHYJ130330 that had been selected and accumulated during the serial passages are indeed the causalities of the growth adaptationinvitroand the attenuation of virulenceinvivo.
porcine epidemic diarrhea virus;mutation;spike gene;virus attenuation
10.11843/j.issn.0366-6964.2015.05.015
2014-08-25
广州市南沙区技术开发项目(2014KF01);广州市产学研协同创新重大专项(156100070)
冯晓声(1982-),男,内蒙古人,助理研究员,主要从事预防兽医学工作,E-mail:fengxsh@haid.com.cn
*通信作者:贾爱卿,高级兽医师,E-mail:jiaaq@haid.com.cn
S852.659.6
A
0366-6964(2015)05-0792-08
