2,4,6-三硝基苯磺酸诱导雏鸡溃疡性结肠炎模型的建立
2015-03-22于志强郑世民
于志强,周 英,郑世民
(东北农业大学动物医学学院,哈尔滨 150030)
2,4,6-三硝基苯磺酸诱导雏鸡溃疡性结肠炎模型的建立
于志强,周英,郑世民*
(东北农业大学动物医学学院,哈尔滨 150030)
为探索动物溃疡性肠炎的发生发展机制及其对机体的影响,以10日龄SPF雏鸡为研究对象,以2,4,6-三硝基苯磺酸(TNBS)为诱导剂,分别根据体重应用50、100、150 mg·kg-1的TNBS(50%乙醇稀释)通过灌肠途经建立TNBS诱导的雏鸡溃疡性结肠炎动物模型,进而分析TNBS对雏鸡溃疡性结肠炎发生的剂量效应。并对TNBS所致的溃疡性结肠炎雏鸡的临诊症状、眼观和病理组织以及体重等变化进行较全面系统的观察或检测,结果发现,100 mg·kg-1TNBS为制备雏鸡溃疡性结肠炎动物模型的理想给药剂量,其能够得到理想的实验动物临诊症状和病理变化,同时对雏鸡的损伤在可控范围内,不会造成模型动物的大批死亡。本研究成功建立雏鸡溃疡性结肠炎病理模型,为进一步研究溃疡性结肠炎的发生发展奠定了基础。
2,4,6-三硝基苯磺酸;雏鸡;溃疡性结肠炎
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病的一种,是一种慢性非特异性结肠炎症,病变主要位于结肠的黏膜层,且以溃疡为主,多累及直肠和远端结肠,同时可向近端扩展,以至遍及整个结肠[1-2]。溃疡性结肠炎的发病因素包括饮食因素、环境因素、免疫因素和遗传因素,在人类还包括心理与精神状态[3-9]。综合国内外对该项的已有研究资料,虽然对其发生机制和可能引发原因等进行了大量研究,但对其具体发病原因及其机制至今仍然不十分清楚[10-11]。现阶段,对于应用2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)作为诱导剂制备溃疡性结肠炎模型的研究主要集中于对该病致病机制和治疗药物的研究[12-15],并且相关研究主要集中于哺乳动物。而应用TNBS对禽类所致的溃疡性结肠炎的研究迄今未见报道。合理选择理想的动物模型,对研究溃疡性结肠炎的发生发展具有重要意义。探索禽类溃疡性结肠炎的发病机制,可为比较医学研究人类溃疡性结肠炎的发生和其防治提供重要的参考依据。
综合目前对该领域的已有研究报道,溃疡性结肠炎动物模型的制作方法归纳如下:(1)自发性动物模型;(2)化学药物诱导的动物模型;(3)基因型动物模型;(4)细胞移植型动物模型;(5)化学药物与免疫复合物联合诱导动物模型。化学药物诱导的动物模型被认为是更加符合免疫作用导致的炎症性肠病。其中应用TNBS诱导的溃疡性结肠炎已成为最常用的溃疡性结肠炎动物模型的制作方法[16]。对本项研究以10日龄SPF雏鸡为研究对象,以TNBS为刺激剂,在成功建立禽溃疡性结肠炎动物模型的基础上,并对溃疡性结肠炎雏鸡的临诊症状、主要器官组织的眼观和病理组织及其体重等变化进行了较全面系统的研究。为进一步研究溃疡性结肠炎的分子发病机制奠定基础。
1 材料与方法
1.1实验动物
10日龄CSIRO-MVS品种SPF雏鸡,购自中国农业科学院哈尔滨兽医研究所SPF雏鸡实验动物中心,并提供饲养。
1.2主要试剂和仪器
2,4,6-三硝基苯磺酸(TNBS),德国Sigma公司产品;苏木色精,上海试一化学试剂有限公司产品;曙红B,新中化学厂股份有限公司产品;H600L显微成像系统,日本NiKon公司产品;HM340E切片机,德国Thermo公司产品。
1.3实验动物分组及处理
将84只SPF雏鸡随机分为4 组,即对照组(简称C)、50 mg·kg-1的 TNBS组(简称M1),100 mg·kg-1的 TNBS组(简称M2)和150 mg·kg-1的 TNBS组(简称M3),每组21只雏鸡。其中,C组雏鸡以50%乙醇溶液灌肠1次;M1、M2和M3三组雏鸡分别通过泄殖腔给予经50%乙醇稀释的50、100、150 mg·kg-1的TNBS溶液。
1.4雏鸡溃疡性结肠炎模型制备
取上述10日龄SPF雏鸡,灌肠前禁食24 h,饮水正常供给,将雏鸡由腿部和翅膀进行保定,然后倒立,即雏鸡肛门朝上,用微量吸管将1.0 mL TNBS乙醇稀释液由雏鸡肛门灌入,待药液完全注入雏鸡肠腔后,轻轻抽出吸管,并继续保持雏鸡倒立姿势1~2 min,让药液在肠道中有充分的停留时间。药物灌肠后根据雏鸡临诊症状、粪便(性状、潜血)以及体重等变化初步判断雏鸡是否造模成功。
1.5被检材料采取及其处理
四组雏鸡分别于50%乙醇或TNBS乙醇稀释液灌肠后的当天开始观察并记录雏鸡体重变化及其临诊症状,并于药液灌肠后1、3、4、6、8、10和14 d,每组分别随机抽取3只雏鸡经心脏采血处死或发病死亡前剖杀,采集雏鸡结肠组织经适当处理后备用。
1.6检测指标及方法
1.6.1溃疡性结肠炎雏鸡临诊主要症状观察常规法,项目包括:雏鸡精神状态、饮食和饮水、背羽变化、粪便(性状、潜血)以及体重变化等。
1.6.2溃疡性结肠炎雏鸡肠道病理损伤评分雏鸡结肠组织进行眼观病理变化观察,根据肠粘连、溃疡形成及炎症程度进行评分(表1),然后取远端结肠一段置于预先装有4%多聚甲醛液的磨口瓶中固定,室温至少固定24 h,并编号。
1.6.3眼观病理变化观察雏鸡心脏采血处死或自然死亡后,剖开雏鸡腹腔观察结肠粘连情况后,取出结肠,剖开结肠观察其黏膜的病理变化(包括充血、溃疡灶及肠壁厚薄等)。
1.6.4病理组织变化检查取出于4%甲醛溶液固定的组织块,常规石蜡包埋,HE染色,光学显微镜下进行病理组织学观察。
2 结 果
2.1TNBS溃疡性结肠雏鸡的临诊主要症状
TNBS乙醇稀释液给雏鸡灌肠后1 h,所有试验组雏鸡均呈现喜卧、少动,精神沉郁。1 d后进食和饮水量明显减少,背羽凌乱、无光泽,体重下降等现象,呈现里急后重症状。4 d时雏鸡症状最为严重。其中M3组雏鸡可见泄殖腔口周边羽毛被粪便污染,并伴有便血等,同时出现死亡。药物灌肠后6 d,M1组和M2组雏鸡症状有所好转,而M3组雏鸡虽然症状相对也有所减轻,但其减轻程度仍然没有M1和M2组雏鸡明显。
表1溃疡性结肠炎雏鸡肠道眼观病理损伤评分标准
Table 1The standard of eye view pathological damage of chicks of ulcerative colitis

主要病变Mainlesions病理损伤具体判断标准Criteriaofpathologicallesion记分Score粘连Adhesion无轻度(结肠与其他组织易剥离)重度(结肠与其他组织不易剥离)012溃疡形成及炎症Ulcerandinflammation无局部组织充血,但无溃疡肠壁增厚,并有1处溃疡肠壁增厚,局部组织炎症反应带明显并有1处溃疡局部组织炎症反应带明显并有2及以上溃疡溃疡和/或炎症2cm,病变范围每增加1cm,积分加101234
2.2TNBS乙醇稀释液灌肠对雏鸡体重的影响
TNBS乙醇稀释液给雏鸡灌肠后3~14 d,无论是高剂量还是低剂量模型雏鸡体重均分别不同程度低于相应对照雏鸡(P<0.05或P<0.01)。其余未见统计学差异(P>0.05)(图1)。
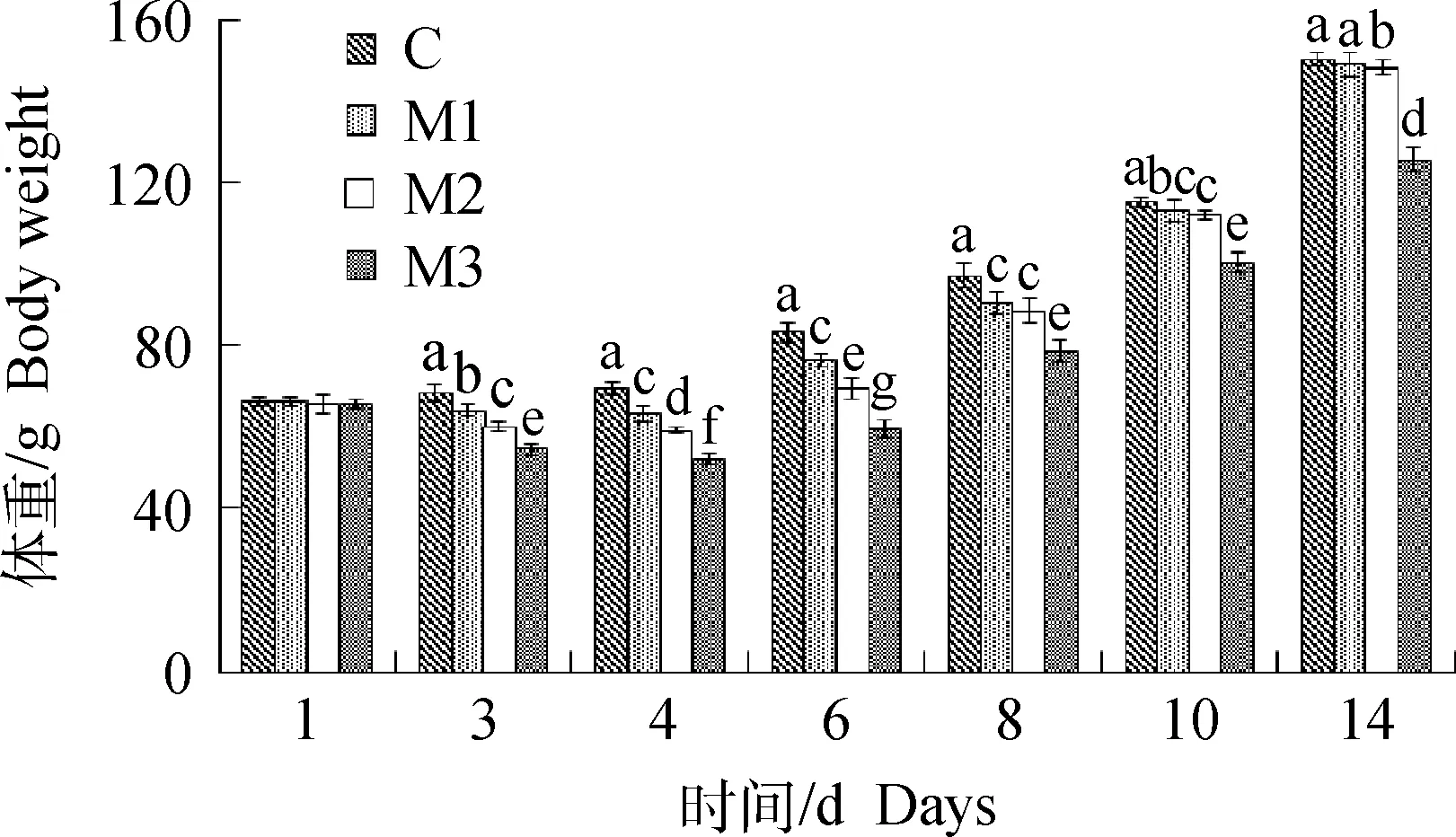
图1 TNBS对雏鸡体重的影响Fig.1 The effect of weight of chicks by TNBS
2.3TNBS乙醇稀释液灌肠雏鸡肠道病理损伤评分
用TNBS乙醇稀释液给雏鸡灌肠后1 d,所有试验雏鸡的结肠黏膜均出现充血,但未见溃疡灶;3 d,M2和M3组雏鸡的结肠黏膜均发现1处溃疡灶,同时伴有肠壁增厚,肠腔增大等症状,可见局部组织的不同程度粘连;而M1组雏鸡尽管结肠黏膜也出现1处溃疡,但未见组织粘连现象;4 d,M2和M3组雏鸡的结肠黏膜不但溃疡灶数量增加而且其炎症症状也明显加重,且M3组雏鸡肠黏膜的粘连程度也更加显著;6 d,各试验组雏鸡的临诊症状均出现程度不同的好转,其中M3组雏鸡结肠黏膜的上述症状减轻尤为明显,M2组雏鸡结肠黏膜仅剩1处溃疡灶、炎症和黏膜粘连现象均开始逐渐消失,M1组雏鸡结肠黏膜溃疡灶消失,仅见局部充血;8 d,各试验组雏鸡的所有上述表现均继续好转,症状进一步减轻,至14 d所有试验组雏鸡均基本痊愈。对照雏鸡除于乙醇灌肠后1~4 d,其结肠黏膜仅出现一过性局部充血,并于6 d转归并痊愈外,其余未见异常。
表2TNBS雏鸡肠道病理变化评分
Table 2The score of the pathological changes in intestinal tract of chicks by clystering with TNBS
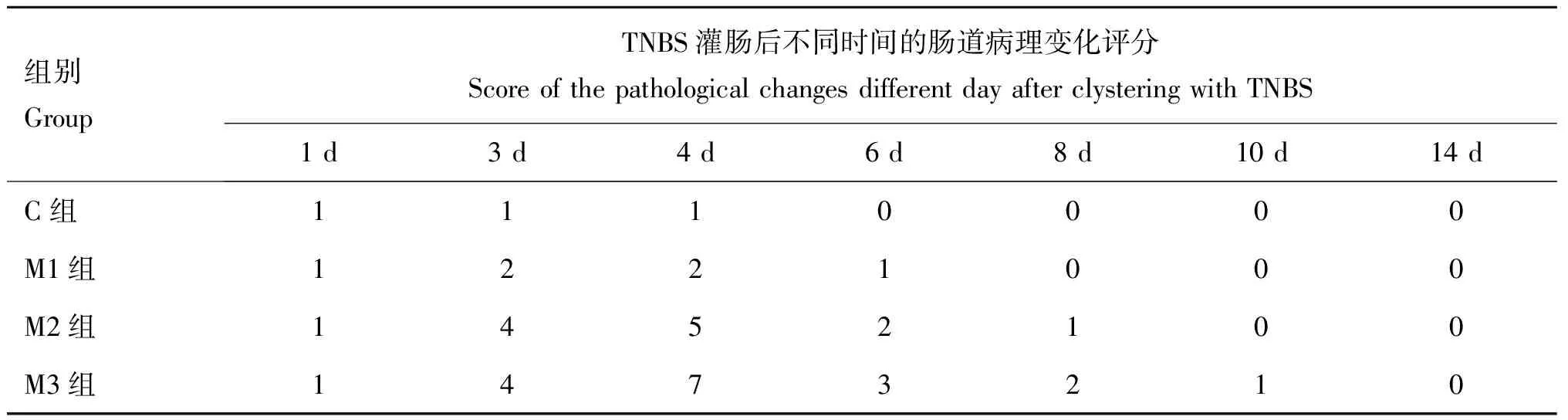
组别GroupTNBS灌肠后不同时间的肠道病理变化评分ScoreofthepathologicalchangesdifferentdayafterclysteringwithTNBS1d3d4d6d8d10d14dC组1110000M1组1221000M2组1452100M3组1473210
2.4TNBS灌肠雏鸡结肠眼观病理变化
用TNBS乙醇稀释液给雏鸡灌肠后,M1组雏鸡在3 d时,其结肠黏膜可见1处溃疡灶;而M2和M3组雏鸡肠道除均可见局部充血、肠壁增厚、肠腔增大、且伴有溃疡外,并呈现不同程度的粘连;M3组雏鸡上述症状较M1组和M2组雏鸡更加严重。以上病理变化一直持续至灌肠后10 d,14 d时症状开始减轻或消失。对照雏鸡除乙醇灌肠后的早期可见肠黏膜局部呈现一过性充血外,其余未见异常(图2)。
2.5TNBS灌肠雏鸡结肠的病理组织变化
用TNBS乙醇稀释液给雏鸡灌肠后,各试验组雏鸡的结肠病理组织光学显微镜检查发现:M2和M3组雏鸡结肠组织均普遍增厚,腺管扭曲、排列不整齐,肠上皮隐窝破坏并可见脓肿,杯状细胞显著减少,肠黏膜固有层增厚,大量中性粒细胞、淋巴细胞浸润,黏膜下层水肿。M1组雏鸡上述病理变化较M2和M3组雏鸡轻微。而对照雏鸡的结肠组织结构较清晰,上皮完整,杯状细胞丰富,腺管结构未见异常(图3)。
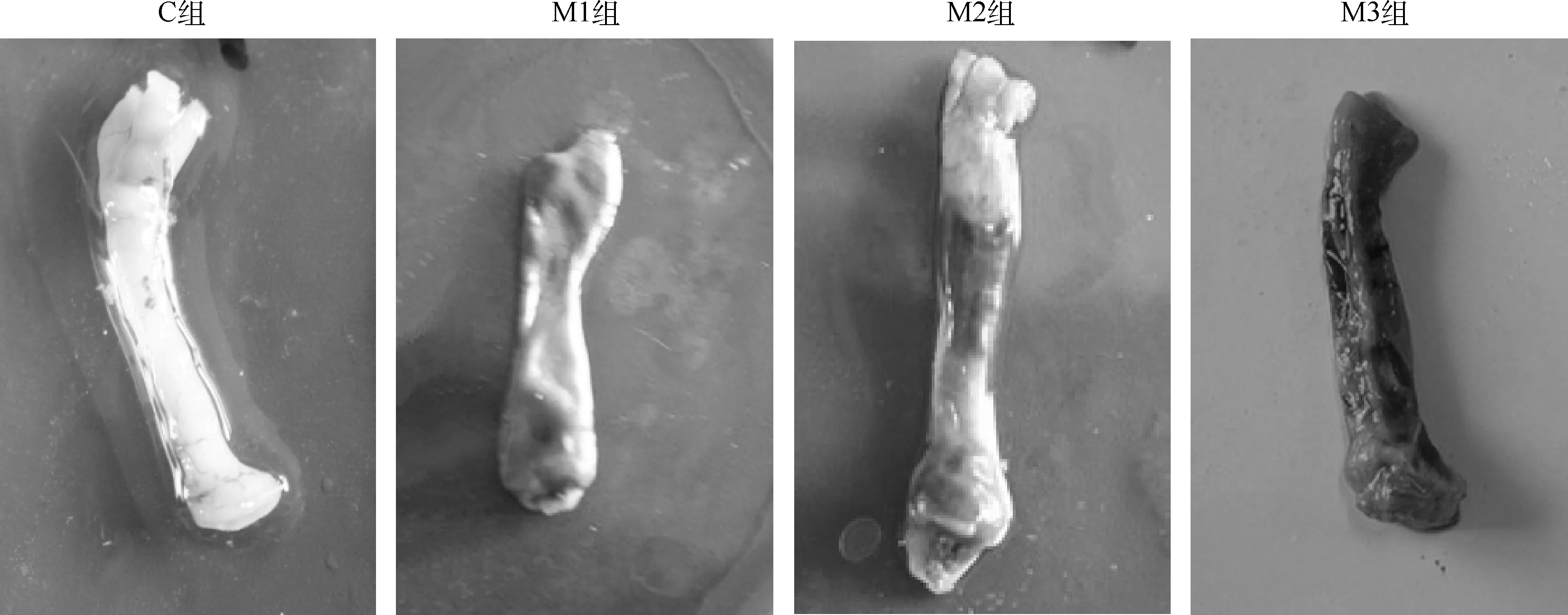
图2 TNBS灌肠后雏鸡结肠眼观病理变化Fig.2 The changes of eye view pathology in colon of chicks by clystering with TNBS

图3 TNBS灌肠后雏鸡结肠的病理组织变化(10×40)Fig.3 The changes of histopathology in colon of chicks by clystering with TNBS(10×40)
3 讨 论
本研究发现,用不同剂量的TNBS乙醇稀释液经由雏鸡泄殖腔灌肠后,各试验组雏鸡均表现出了不同程度的临诊症状,其中,剂量在100 mg·kg-1体重及其以上时,M2和M3组雏鸡均出现进食和饮水量减少,体重下降,背羽凌乱、无光泽以及腹泻等主要临诊症状。且较大剂量的M3组雏鸡甚至出现大量便血,部分雏鸡最终因衰竭而导致死亡。而剂量为50 mg·kg-1的M1组雏鸡,其临诊症状相对较轻,病程更短,对机体的损伤较小,恢复也较快,个别雏鸡甚至不表现明显的临诊症状。
眼观病理变化观察发现,TNBS乙醇稀释液给雏鸡灌肠后1 d,其所有试验组雏鸡的结肠黏膜均出现局部充血等炎症症状。3 d,可见M2和M3组雏鸡肠道黏膜不同程度粘连,局部充血,肠壁增厚,肠腔增大,并且伴有溃疡,M1组雏鸡结肠黏膜变化较轻微,除仅出现1处溃疡外,未见肠粘连。4 d,M2和M3组雏鸡病理变化进一步加重。6 d,各试验组雏鸡开始逐渐好转,结肠黏膜炎症变化较之前减轻。14 d,各试验组雏鸡均基本痊愈。产生以上变化的原因可能是,由于M2和M3组雏鸡应用TNBS乙醇稀释液剂量较大,在乙醇对雏鸡肠黏膜作用后,作为半抗原的TNBS能够充分与损伤的肠道上皮细胞中的赖氨酸共价结合,进而转变成完全抗原,促进致炎因子的表达和释放,进而促进炎症的发生,加重肠黏膜的损伤。M1组雏鸡由于应用TNBS的剂量较小,对肠黏膜损伤程度低,TNBS与损伤的肠道上皮细胞接触不充分,不能转变成完全抗原,结果不足以引发机体产生过敏反应而诱发炎症性损伤。陈佳奇等[17]以小鼠为研究对象,依然以TNBS为诱导剂,复制小鼠溃疡性结肠炎动物模型,结果发现,TNBS所诱导的小鼠溃疡性结肠炎病程较长,呈慢性型。而本试验以SPF雏鸡为研究动物,所复制的TNBS雏鸡溃疡性结肠炎模型为急性型,这一研究结果,不仅表明雏鸡较小鼠对TNBS更敏感,同时也提示TNBS所致的溃疡性结肠炎可能存在一定的动物种属差异,其具体情况有待进一步探讨。
病理组织变化检查发现,M2和M3组雏鸡的结肠组织均增厚、腺管扭曲、排列不整齐,杯状细胞显著减少,黏膜固有层增厚、大量中性粒细胞,淋巴细胞浸润,黏膜下层水肿,黏膜上皮隐窝被破坏、脓肿形成。10 d后上述病理组织变化逐渐减轻甚至消失,产生此病理改变,可能与TNBS作为抗原物质引发机体免疫反应密切相关。应用TNBS乙醇混合液灌肠后,其中的乙醇能够刺激并损伤肠黏膜,使雏鸡肠黏膜的屏障功能受到不同程度的损伤,结果导致TNBS可以直接作用于肠道上皮细胞,作为异种抗原引发机体发生过敏反应,降低机体肠道局部黏膜的免疫功能,使肠道内致病菌更容易在肠道内定植,并产生毒素能够促进炎症细胞在肠黏膜上聚集,激活T淋巴细胞,使TNF-α mRNA表达增加,TNF-α能够活化核转录因子-κB(NF-κB),后者的活化又能启动TNF-α基因转录,使TNF-α分泌进一步增多,形成级联反应[18-19],同时诱导多种促炎因子,如IL-6、IL-1和IL-8等过表达,从而放大炎症效应,诱发或加重炎症损伤[20-22]。丁伟群等[23]研究表明,溃疡性结肠炎所致的组织损伤引起的急性炎症在很大程度上是由TNF-α和IL-1b造成的。而从M1组雏鸡结肠的病理组织变化可以看出肠道上皮仅出现轻微的组织增厚和中性粒细胞、淋巴细胞浸润,于6 d后病理变化基本消失,造成上述变化的可能原因与灌肠时机械性作用和化学刺激密切相关。
4 结 论
100 mg·kg-1的2,4,6-三硝基苯磺酸为制备雏鸡溃疡性结肠炎的理想给药剂量,该剂量不仅能够观察到理想模型动物的主要临诊症状和病理变化,而且对雏鸡的损伤也在可控范围内,更重要的是不会导致模型动物的大批死亡。
[1]王铭慧,李玉华,曹晓焕,等.溃疡性结肠炎的研究进展[J].中国中医药现代远程教育,2011,9(24):170-175. WANG M H,LI Y H,CAO X H,et al.Advances in ulcerative colitis[J].ChineseMedicineModernDistanceEducationofChina,2011,9(24):170-175.(in Chinese)
[2]MAGRO F,PORTELA F.Management of inflammatory bowel disease with infliximab and other anti-tumor necrosis factor alpha therapies[J].BioDrugs,2010,24(Suppl 1):3-14.
[3]OHMAN L,SIMRÉN M.Pathogenesis of IBS:role of inflammation,immunity and neuroimmune interactions[J].NatRevGastroenterolHepatol,2010,7(3):163-173.
[4]SALIM S Y,SÖDERHOLM J D.Importance of disrupted intestinal barrier in inflammatory bowel diseases[J].InflammBowelDis,2011,17(1):362-381.
[5]龙惠,蒋芳,严莉,等.溃疡性结肠炎相关基因及细胞因子的研究进展[J].中国医药科学,2012,2(9):60-63. LONG H,JIANG F,YAN L,et al.Advances in ulcerative colitis-related gene and cytokine[J].ChinaMedicineAndPharmacy,2012,2(9):60-63.(in Chinese)
[6]FUSS I J.Is the Th1/Th2 paradigm of immune regulation applicabie to IBD?[J].InflammBowelDis,2008,14(Suppl 2):S110-S112.
[7]侯庆芬,王欣妮.溃疡性结肠炎病因与发病机制的研究[J].中外医疗,2009,28(20):168. HOU Q F,WANG X N.Etiology and pathogenesis research of ulcerative colitis[J].ChinaForeignMedicalTreatment,2009,28(20):168.(in Chinese)
[8]陈文华,黄国栋,方承康.溃疡性结肠炎现代医学研究进展[J].中国医药科学,2011,1(7):51-53. CHEN W H,HUANG G D,FANG C K.Modern medical research progress of ulcerative colitis[J].ChinaMedicineAndPharmacy,2011,1(7):51-53.(in Chinese)
[9]潘一滨,闫伟,陆金根.炎症性肠病的免疫机制研究进展[J].中国医师杂志,2011,13(1): 139-141. PAN Y B,YAN W,LU J G.Advances in the immune mechanism of ulcerative colitis[J].JournalofChinesePhysician,2011,13(1): 139-141.(in Chinese)
[10]KASER A,ZEISSIG S,BLUMBERG R S.Inflammatory bowel disease[J].AnnuRevImmunol,2010,28:573-621.
[11]WANG Y H,GE B,YANG X L,et al.Proanthocyanidins from grape seeds modulates the nuclear factor-kappa B signal transduction pathways in rats with TNBS-induced recurrent ulcerative colitis[J].IntImmunopharmacol,2011,11(10):1620-1627.
[12]DE ALMEIDA A B,SNCHEZ-HIDALGO M,MARTN A R,et al.Anti-inflammatory intestinal activity ofArctiumlappaL.(Asteraceae) in TNBS colitis model[J].JEthnopharmacol,2013,146(1):300-310.
[13]CURY D B,MIZSPUTEN S J,VERSOLATO C,et al.Serum calprotectin levels correlate with biochemical and histological markers of disease activity in TNBS colitis[J].CellImmunol,2013, 282(1):66-70.
[14]SOCCA E A,LUIZ-FERREIRA A,DE FARIA F M,et al.Inhibition of tumor necrosis factor-alpha and cyclooxigenase-2 by Isatin:a molecular mechanism of protection against TNBS-induced colitis in rats[J].ChemBiolInteract,2014,209:48-55.
[15]BRECCHIA G,RAPPA F,CAPPELLO F,et al.Prevention of TNBS-induced colitis by probiotic supplement in mice[J].JBiotechnol,2014,185(Supplement):S83-S84.
[16]KOPPIKAR S J, JAGTAP S D, DEVARSHI P P,et al.Triphala,an Ayurvedic formulation improves the antioxidant status on TNBS induced IBD in rats[J].EurJIntegrMed,2014,6(6):646-656.
[17]陈佳奇,陈村龙,王继德.2,4,6- 三硝基苯磺酸诱导小鼠炎症性肠病模型的建立[J].中国组织工程研究与临床康复,2007,11(21):4174-4177. CHEN J Q,CHEN C L,WANG J D,et al.Establishment of inflammatory bowel disease models induced by 2,4,6-trinitrobenzenesulfonic acid in mice[J].JournalofClinicalRehabilitativeTissueEngineeringResearch,2007,11(21):4174-4177.(in Chinese)
[18]SANCHEZ-MUNOZ F,DOMINGUEZ-LOPEZ A,YAMAMOTO-FURUSHO J K.Role of cytokines in inflammatory bowel disease[J].WorldJGastroenterol,2008,14(27):4280-4288.
[19]LEE T W,FEDORAK R N.Tumor necrosis factor-α monoclonal antibodies in the treatment of inflammatory bowel disease:clinical practice pharmacology[J].GastroenterolClinNorthAm,2010,39(3):543-557.
[20]ALEX P,ZACHOS N C,NGUYEN T,et al.Distinct cytokine patterns identified from multiplex profiles of murine DSS and TNBS-induced colitis[J].InflammBowelDis,2009,15(3):341-352.
[21]STROBER W,FUSS I J.Proinflammatory cytokines in the pathogenesis of inflammatory bowel diseases[J].Gastroenterology,2011,140(6):1756-1767.
[22]SCHINZARI F,ARMUZZI A,DE PASCALIS B,et al.Tumor necrosis factor-alpha antagonism improves endothelial dysfunction in patients with Crohn's disease[J].ClinPharmacolTher,2008,83(1):70-76.
[23]丁伟群,林庚金,徐三荣,等.溃疡性结肠炎发病中白介素水平的变化[J].复旦学报:医学科学版,2001,28(4):330-333. DING W Q,LIN G J,XU S R,et al.Changes of interleukin level in ulcerative colitis patients[J].FudanUniversityJournalofMedicalSciences,2001,28(4):330-333.(in Chinese)
(编辑白永平)
Development of Ulcerative Colitis Models Induced by 2,4,6-trinitrobenzene Sulfonic Acid in Chicks
YU Zhi-qiang,ZHOU Ying,ZHENG Shi-min*
(CollegeofVeterinaryMedicine,NortheastAgriculturalUniversity,Harbin150030,China)
In order to explore the mechanisms of ulcerative colitis in animals and its impact on body,10-day-old SPF chicks were used to build 2,4,6-trinitrobenzene sulfonic acid(TNBS) -induced model by clystering with TNBS in dose of 50,100,and 150 mg·kg-1,diluting with 50% ethanol,that can help us to analyzes the dose effect of TNBS-induced ulcerative colitis.Further observation and testing about the changes of the chicks’ clinical symptoms,pathology and body weight showed that the ideal medicine dose was 100 mg·kg-1of TNBS,which can induce ideal changes of clinical symptoms and pathology in experimental animals without uncontrolled injury and massive death.This study successfully established chicks’ pathological model of ulcerative colitis which laid a foundation for deep research of the development of ulcerative colitis.
2,4,6-trinitrobenzene sulfonic acid;SPF chicks;ulcerative colitis
10.11843/j.issn.0366-6964.2015.09.027
2014-12-22
国家自然科学基金项目(31472169)
于志强(1986-),男,黑龙江佳木斯人,博士生,主要从事畜禽免疫病理学研究,E-mail:yzqtd@163.com
*通信作者:郑世民,教授,E-mail:zhengshiminbl@sohu.com,Tel:0451-55190405
S852.3
A
0366-6964(2015)09-1686-06
