中国部分主要养蜂区侵染西方蜜蜂(Apismellifera)群微孢子虫种质分布调查
2015-03-22张建燕刁青云代平礼褚艳娜吴艳艳
张建燕,刁青云,代平礼,褚艳娜,吴艳艳,周 婷,王 强
(中国农业科学院蜜蜂研究所/农业部授粉昆虫生物学重点开放实验室,北京 100093)
中国部分主要养蜂区侵染西方蜜蜂(Apismellifera)群微孢子虫种质分布调查
张建燕,刁青云,代平礼,褚艳娜,吴艳艳,周 婷,王 强*
(中国农业科学院蜜蜂研究所/农业部授粉昆虫生物学重点开放实验室,北京 100093)
为了探明中国主要养蜂地区蜜蜂微孢子虫的种类及分布,采用多重PCR的方法对采自中国部分主要养蜂地区的68份蜜蜂样品中含有的微孢子虫进行种类鉴定。结果发现所有样本中仅采自山东寿光的样品中检测出蜜蜂微孢子虫(Nosemaapis),其他所有样品均只检测出东方蜜蜂微孢子虫(Nosemaceranae)的存在。初步推断在中国主要养蜂地区寄生危害西方蜜蜂的微孢子虫种类主要是东方蜜蜂微孢子虫,该结果为微孢子虫病在中国的流行规律及防治研究奠定了一定的基础。
西方蜜蜂;微孢子虫;多重PCR;种群分布
蜜蜂微孢子虫病是危害西方蜜蜂的主要病虫害[1],主要侵染成年蜜蜂的中肠细胞[2-3],可以造成蜜蜂个体生理及行为上的异常并导致蜜蜂个体寿命缩短[4-5]。目前已知能够侵染蜜蜂并造成危害的微孢子虫种类有蜜蜂微孢子虫(Nosemaapis)以及东方蜜蜂微孢子虫(Nosemaceranae)[6]。
自2006年起陆续有研究人员在欧洲、美洲及台湾等地区发现西方蜜蜂群(Apismellifera)被东方蜜蜂微孢子虫(N.ceranae)侵染的现象[7-9],尤其近些年的研究发现在许多国家或地区西方蜜蜂群(A.mellifera)中东方蜜蜂微孢子虫(N.ceranae)有逐渐取代蜜蜂孢子虫(N.apis)成为主要病原种的趋势[6,10-13]。由于东方蜜蜂微孢子虫对西方蜜蜂具有相对更强的侵染性和致病性[3],越来越多的研究人员倾向于认为东方蜜蜂微孢子虫(N.ceranae)是造成近些年欧美地区西方蜜蜂大面积死亡的一个重要原因[1,5,14-16]。鉴于此,调查不同地区蜜蜂群中微孢子虫的种群分布陆续成为各国的研究热点[17-22]。本试验试图参考国外成熟的微孢子虫种群鉴定技术,对采自中国主要养蜂地区发生的微孢子虫样本进行种质鉴定,初步明确目前中国发生与流行的蜜蜂微孢子虫种类,从而为蜜蜂微孢子虫在中国的流行规律研究及防治工作奠定一定的基础。
1 材料与方法
1.1 样品采集
2013年,项目组先期与全国主要西方蜜蜂养蜂机构联合建立病害监测点,一旦发现疫情即由当地调查取样,选取代表性蜂场从患病蜂群中采集有典型症状的病蜂样品,所有样品经显微镜检测是否含有微孢子虫。先后收集的含有微孢子虫病蜂样品地理覆盖范围包括了我国16个主要养蜂地区,具体采集地点及时间信息见表1。
1.2 DNA提取
参照M.M.Hamiduzzaman等[19]的HBRC法对蜜蜂及孢子虫的DNA进行提取并加以改进,从每份样品中取镜检感染有孢子虫的蜜蜂,将蜜蜂腹部分别液氮冻磨并匀浆,加入300 μL的提取液及4 μL蛋白酶K溶液(20 mg·mL-1),60 ℃水浴3 h,水浴后加入等体积(300 μL)的苯酚∶氯仿(1∶1)混合液,并轻轻混匀;13 000 r·min-1条件下离心15 min,将上清液移至另一个新管中,再次加入等体积(300 μL)的苯酚∶氯仿(1∶1)混合液,并轻轻混匀,同样条件下离心,取上清,向上清液中加入等体积(300 μL)的氯仿并轻轻混匀,13 000 r·min-1条件下离心5 min,将上清液(300 μL)移至新管中,加入预冷的2倍体积(600 μL)的95%乙醇和1/10体积(30 μL)的3 mol·L-1NaOAc,轻轻混匀,-20 ℃过夜沉淀,10 000 r·min-1离心15 min,移去上清,沉淀用1 mL的70%乙醇洗涤2次,烘干后加入20 μL的ddH2O,置于65 ℃的条件下水浴10 min,轻轻溶解,混匀每个管中的沉淀物,10 000 r·min-1条件下离心10 s,-20 ℃保存备用。
1.3 PCR扩增
引物、扩增反应体系及反应步骤均参照M.M.Hamiduzzaman等[19]所设计并经验证的蜜蜂微孢子虫鉴定方法。用所提取的DNA样品在同一个PCR反应体系中进行东方蜜蜂微孢子虫(N.ceranae)和蜜蜂微孢子虫(N.apis)的16S rRNA以及蜜蜂的β-actin基因的共扩增反应。
20 μL PCR反应体系:Mix(Promega公司)10 μL,10 μmol·L-1引物(3对,表2)4.8 μL,5 ng·μL-1DNA模板1.0 μL,ddH2O 4.2 μL。
反应的循环参数:94 ℃2.5 min;94 ℃15 s,61.8 ℃条件下30 s,72 ℃条件下45 s, 16个循环;94 ℃15 s,61.8 ℃30 s,72 ℃50 s,20个循环;72 ℃延伸7 min。
1.4 扩增产物的分离
扩增产物用50和100 bp的ladder以及2.5%的琼脂糖凝胶电泳进行分离,120 V电压下进行32 min,用凝胶成像系统对产物进行成像及分析。
1.5 扩增产物的测序
将检测结果中218 bp的N.ceranae条带和321 bp的N.apis条带进行测序(华大基因),利用NCBI中的BLAST软件将条带测序结果与GenBank中已发表的序列信息进行同源性比对。
2 结 果
2.1 所有样品种质鉴定
对所有采集的样品进行微孢子虫镜检,镜检含有微孢子虫的样品68份,对所有68份样品以蜜蜂基因组与微孢子虫基因组为模板,采用蜜蜂看家基因(β-actin)、东方蜜蜂微孢子虫(N.ceranae)和蜜蜂微孢子虫(N.Apis)16S rRNA特异序列所对应的引物进行多重PCR扩增,所有的68份样品均检测到了微孢子虫条带,检出率为100%。其中仅从采自山东寿光的样品中检测到了蜜蜂孢子虫(N.Apis),占所有样品的1.5%,其他所有样品均仅检测出东方蜜蜂微孢子虫(N.ceranae),占所有样品的98.5%,PCR扩增结果如图1、2所示。
2.1.1 东方蜜蜂微孢子虫(N.ceranae)检测结果 图1中泳道1~67代表了表1中所列出的1~67号样品的电泳检测结果,结果显示67个样品的扩增片段均只有大小为218 bp的东方蜜蜂微孢子虫(N.ceranae)条带和大小为166 bp的看家基因(β-actin)条带,说明所有上述样品均只感染有东方蜜蜂微孢子虫(N.ceranae)。
2.1.2 蜜蜂微孢子虫(N.apis)检测结果 图2泳道67与68分别代表了采自山东寿光同一蜂场不同蜂群样品的检测结果,67号样品检测出东方蜜蜂微孢子虫(N.ceranae)条带和看家基因(β-actin)条带。68号样品检测出蜜蜂微孢子虫(N.apis)条带看家基因(β-actin)条带,说明这2份样品分别感染东方蜜蜂微孢子虫(N.ceranae)和蜜蜂微孢子虫(N.apis)。
表1 样品信息
Table 1 The messages of the samples collected

省份Province采集地点Samplingsite采集时间Samplingtime编号No.黑龙江绥化市纯棱县4.121黑河市嫩江县5.92双鸭山市宝清县5.83海林市6.174吉林盘石市2.15白山市靖宁县5.126辽宁北票市蒙古营乡7.287丹东市宽甸11.138陕西商洛市商南县5.99咸阳市礼泉县7.310渭南市富平县12.711河北沧州市河间5.2112承德市5.2213保定市涞源县王安镇5.2614北京门头沟区4.215房山区4.816昌平区4.1817海淀区香山4.2118通州区4.2219海淀区香山4.2320房山区4.2621房山区4.2622密云县太师屯镇5.223海淀区香山5.824海淀区香山5.925门头沟区5.2626房山区5.2727海淀区香山8.2828门头沟区9.2929门头沟区-30山西晋城市沁水县苏云乡5.531临汾市汾西县5.2432江苏南通市如东县3.833徐州市丰县3.1534佛山市向荣市4.135南通市如皋市6.636扬州市仪征岳塘乡11.1837省份Province采集地点Samplingsite采集时间Samplingtime编号No.河南济源市3.1238南阳市新野县4.1739漯河市西平县4.2940洛阳市宜阳县赵堡乡4.2941郑州市6.1542安徽滁州市来安县2.2543合肥市巢湖市3.1044滁州市凤阳县3.1245滁州市凤阳县4.246六安市舒城县4.847池州市青阳县5.948黄山市歙县深渡镇15.1649黄山市歙县深渡镇25.1650文安市10.1451浙江嘉兴市永江3.2652湖北天门市2.753黄冈市浠水县3.354黄冈市红安县3.3155孝感市安陆市濮水镇4.1456武汉市5.157襄樊市南漳县6.1758湖南常德市4.759四川内江市威远县镇西镇3.560峨眉山市3.2661广东深圳市坪山新区8.1162深圳市龙肖区9.663山东德州市宁津县4.764烟台市牟平区王格庄镇5.965济南市5.966潍坊市寿光市111.1467潍坊市寿光市211.1468
表2 引物信息
Table 2 Information of primers

基因Gene引物名Primername序列(5′⁃3′)Sequence(5′⁃3′)物种Species产物长度/bpProductlength16SrRNAMITOC⁃FMITOC⁃RCGGCGACGATGTGATATGAAAATATTAACCCGGTCATTCTCAAACAAAAAACCG东方蜜蜂微孢子虫Nosemaceranae21816SrRNAAPIS⁃FAPIS⁃RGGGGGCATGTCTTTGACGTACTATGTAGGGGGGCGTTTAAAATGTGAAACAACTATG蜜蜂微孢子虫Nosemaapis321β⁃actinβ⁃actin⁃Fβ⁃actin⁃RGCAAAAAGAAATCACTGCCCTAGGATGGTCCAGACTCGTCGTAT蜜蜂166
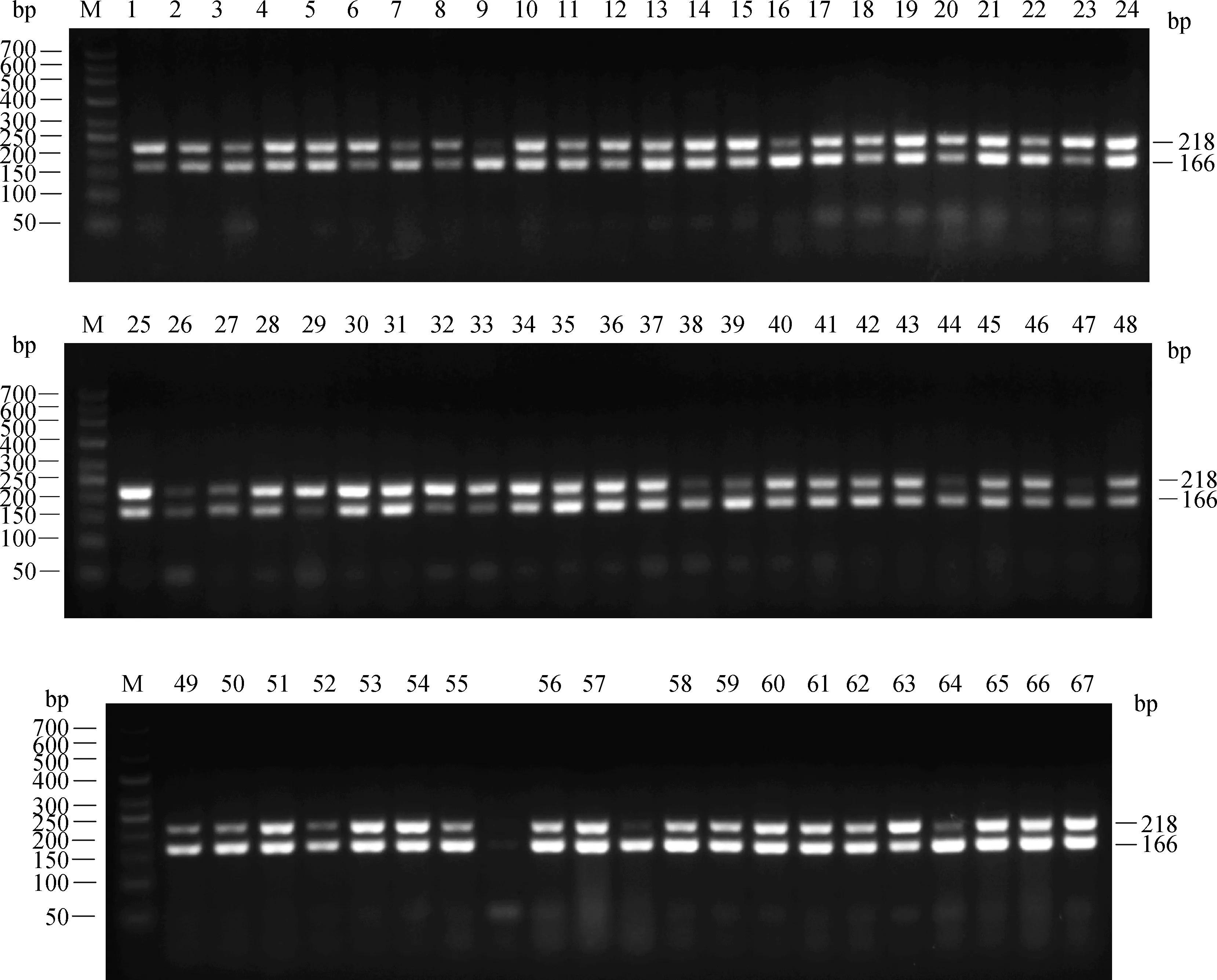
M.DNA相对分子质量标准;1~67.样品M.DNA molecular weight marker;1-67.Samples图1 东方蜜蜂微孢子虫(N.ceranae)检测结果Fig.1 The results of N.ceranae detection

M.DNA相对分子质量标准;67、68.样品M.DNA molecular weight marker;67,68.Samples图2 蜜蜂微孢子虫(N.apis)检测结果Fig.2 The results of N.apis detection
2.2 测序结果
用东方蜜蜂微孢子虫(N.ceranae)特异性引物扩增出来的218 bp的DNA片段的测序序列与NCBI上GenBank登录号分别为EF584422、EF458657、DQ374656、DQ673615和DQ286728的序列进行同源性序列比对,其相似性最高为98%;蜜蜂微孢子虫(N.apis)特异性引物扩增出来的321 bp的DNA片段的测序序列与NCBI上GenBank登录号分别为DQ235446、X73894、EU545140、EF458660和EF584423的序列进行同源性序列比对,其相似性最高为83%。
从序列比对结果可以看出,两种微孢子虫16S rRNA特异序列扩增产物与已发表的东方蜜蜂微孢子虫(N.ceranae)和蜜蜂微孢子虫(N.apis)的16S rRNA序列信息相似度较高,表明PCR扩增产物为东方蜜蜂微孢子虫(N.ceranae)和蜜蜂微孢子虫(N.apis)的特异序列。
3 讨 论
多重PCR对蜜蜂微孢子虫的种质鉴定中微孢子虫的检出率为100%,并且通过PCR扩增产物的序列分析证明了所得到的PCR扩增产物为所需要的两种蜜蜂微孢子虫条带,多重PCR方法的高检出率以及序列分析结果保证了多重PCR法进行微孢子虫种质鉴定的准确度和可靠性。
微孢子虫(nosemaspp.)是中国乃至世界范围内影响蜂群健康发展的一个重要病原。随着分子生物学检测技术的发展,自2006年起陆续在欧洲、美洲及台湾等地区的西方蜜蜂群中发现东方蜜蜂微孢子虫[7-9,23,24],近些年国际范围内的研究发现许多地区的西方蜜蜂群(A.mellifera)中东方蜜蜂微孢子虫(N.ceranae)已逐渐取代蜜蜂孢子虫(N.apis)成为孢子虫病的主要病原[6,10-11,13]。本项研究结果初步明确了东方蜜蜂微孢子虫在中国西方蜜蜂群中已成为主要的病原种,这一结果与国际上的研究结果相同。结合蜜蜂微孢子虫病在中国的发生及流行调查[25],认为这一结果有可能是近些年我国蜜蜂微孢子虫病害流行及危害逐年增加的原因之一。此外,采自山东寿光的同一蜂场的样品同时鉴定出了2个种,这也验证了前人的观点,即同一个蜂场可能会同时感染2个种的微孢子虫[7,21]。
由于项目开展时间有限,部分省份所采集的样品相对缺乏代表性,还有些地区尚无数据,后续将进一步对这些地区继续进行重点跟踪调查,以彻底明确我国蜜蜂微孢子虫的种系构成与分布。
[2] DUSSAUBAT C,BRUNET J L,HIGES M,et al.Gut pathology and responses to the microsporidiumNosemaceranaein the honey beeApismellifera[J].PLoSOne,2012,7(5):e37017.
[3] MAIOLINO P,IAFIGLIOLA L,RINALDI L,et al.Histopathological findings of the midgut in European honey bee(ApismelliferaL.) naturally infected byNosemaspp.[J].VetMedAnimSci,2014,2(1):4.
[4] GOBLIRSCH M,HUANG Z Y,SPIVAK M.Physiological and behavioral changes in honey bees(Apismellifera) induced byNosemaceranaeinfection[J].PLoSOne,2013,8(3):e58165.
[5] HOLT H L,ARONSTEIN K A,GROZINGER C M.Chronic parasitization by Nosema microsporidia causes global expression changes in core nutritional,metabolic and behavioral pathways in honey bee workers(Apismellifera)[J].BMCGenomics,2013,14:799.
[6] BOLLAN K A,HOTHERSALL J D,MOFFAT C,et al.The microsporidian parasitesNosemaceranaeandNosemaapisare widespread in honeybee(Apismellifera) colonies across Scotland[J].ParasitolRes,2013,112(2):751-759.
[7] HIGES M,MARTN R,MEANA A.Nosemaceranae,a new microsporidian parasite in honeybees in Europe[J].JInvertebrPathol,2006,92(2):93-95.
[8] HUANG W,JIANG J,CHEN Y,et al.ANosemaceranaeisolate from the honeybeeApismellifera[J].Apidologie,2007,38(1):30-37.
[9] CHEN Y P,HUANG Z Y.Nosemaceranae,a newly identified pathogen ofApismelliferain the USA and Asia*[J].Apidologie,2010,41(3):364-374.
[10] CHEN Y,EVANS J D,SMITH I B,et al.Nosemaceranaeis a long-present and wide-spread microsporidian infection of the European honey bee(Apismellifera) in the United States[J].JInvertebrPathol,2008,97(2):186-188.
[11] INVERNIZZI C,ABUD C,TOMASCO I H,et al.Presence ofNosemaceranaein honeybees(Apismellifera) in Uruguay[J].JInvertebrPathol,2009,101(2):150-153.
[12] FRIES I.Nosemaceranaein European honey bees (Apismellifera)[J].JInvertebrPathol,2010,103,(Suppl1):S73-S79.
[14] HIGES M,MARTIN-HERNNDEZ R,BOTAS C,et al.How natural infection byNosemaceranaecauses honeybee colony collapse[J].EnvironMicrobiol,2008,10(10):2659-2669.
[15] HIGES M,MARTN-HERNNDEZ R,GARRIDO-BAILN E,et al.Honeybee colony collapse due toNosemaceranaein professional apiaries[J].EnvironMicrobiolRep,2009,1(2):110-113.
[16] PAXTON R J.Does infection byNosemaceranaecause “Colony Collapse Disorder” in honey bees (Apismellifera)[J].JApicultRes,2010,49(1):80-84.[17] HIGES M,GARCA-PALENCIA P,MARTN-HERNNDEZ R,et al.Experimental infection ofApismelliferahoneybees withNosemaceranae(Microsporidia)[J].JInvertebrPathol,2007,94(3):211-217.
[18] ALAUX C,BTUNET J L,DUSSAUBAT C,et al.Interactions between Nosema microspores and a neonicotinoid weaken honeybees(Apismellifera)[J].EnvironMicrobiol,2010,12(3):774-782.
[19] HAMIDUZZAMAN M M,GUZMAN-NOVOA E,GOODWIN P H.A multiplex PCR assay to diagnose and quantify Nosema infections in honey bees(Apismellifera)[J].JInvertebrPathol,2010,105(2):151-155.
[20] 吴 杰,陈文锋,李继莲.感染蜜蜂及熊蜂的微孢子虫检测与鉴定方法[J].中国农学通报,2010,26(19):8-12.
WU J,CHEN W F,LI J L.Detection and identification methods of microsporidia in honeybees and bumblebees[J].ChineseAgriculturalScienceBulletin,2010,26(19):8-12.(in Chinese)
[22] 秦浩然,李继莲,和绍禹,等.Calcofluor White M2R与Sytox Green双重染色法鉴别蜜蜂微孢子虫[J].应用昆虫学报, 2012,49(5):1392-1396.
QIN H R,LI J L,HE S Y,et al.Detection and identification ofNosemaceranaeby dual fluorescent staining with Calcofluor White M2R and Sytox Green[J].ChineseJournalofAppliedEntomology,2012,49(5):1392-1396.(in Chinese)
[23] PAXTON R J,KLEE J,KORPELA S,et al.Nosemaceranaehas infectedApismelliferain Europe since at least 1998 and may be more virulent thanNosemaapis[J].Apidologie,2007,38(6):558-565.
[24] TEIXEIRA E W,SANTOS L G,SATTLER A,et al.Nosemaceranaehas been present in Brazil for more than three decades infecting Africanized honey bees[J].JInvertebrPathol,2013,114(3):250-254.
[25] 王 强,代平礼,吴艳艳,等.我国蜜蜂病虫害诊断、防治现状及对策分析[J].中国农业科技导报, 2013,15(4):97-101.
WANG Q,DAI P L,WU Y Y,et al.Analysis on the diagnosis and control status of honeybee diseases and pests in China[J].JournalofAgriculturalScienceandTechnology,2013,15(4):97-101.(in Chinese)
(编辑 白永平)
Germplasm Distribution ofNosemaspp.inApismelliferain China
ZHANG Jian-yan,DIAO Qing-yun,DAI Ping-li,CHU Yan-na,WU Yan-yan,ZHOU Ting,WANG Qiang*
(KeyLaboratoryofPollinatingInsectBiologyofAgriculture,InstituteofApiculturalResearch,ChineseAcademyofAgriculturalSciences,Beijing100093,China)
In order to clarify distribution ofNosemagermplasm in China,68 samples of adult honey bee from 16 provinces of China were collected.All of the samples which with clear signs of population depletion and positive to microsporidian spores using light microscopy were selected for molecular germplasm identification by method of multiplex PCR.The sequenced products of all of the 68 samples were identical to the correspondingNosemaceranaesequence.Only one of samples collected from Shandong was found that had infected byNosemaapis.The results indicated that vast majority species of nosema infectApismelliferain China isNosemaceranae,Nosemaapisis very rare withinApismellifera.
Apismellifera;Nosemaspp.;multiplex PCR;germplasm distribution
10.11843/j.issn.0366-6964.2015.09.020
2014-12-24
农业部“948”项目(2013-S5);中国农业科学院科技创新工程(CAAS-ASTIP-2015-IAR)
张建燕(1988-),女,河南濮阳人,硕士生,主要从事特种经济动物饲养研究,E-mail:zhangjianyan2012@126.com
*通信作者:王 强,副研究员,Tel:010-62597285,E-mail:beeprotect@yeah.net
S852.723;S895.39
A
0366-6964(2015)09-1638-06
