野百合碱注射建立大鼠肺动脉高压模型的方法
2015-03-21李松华石仁华史承勇赵仙先陈少萍秦永文
李松华,石仁华,朱 琴,史承勇,杜 贺,赵仙先,陈少萍,秦永文
第二军医大学,上海 2004331长海医院心血管内科;2翔殷路干休所
野百合碱注射建立大鼠肺动脉高压模型的方法
李松华1,石仁华1,朱 琴2,史承勇1,杜 贺1,赵仙先1,陈少萍1,秦永文1
第二军医大学,上海 2004331长海医院心血管内科;2翔殷路干休所
目的探讨野百合碱注射建立大鼠肺动脉高压模型的方法和关键点。方法SPF级雄性SD大鼠30只,随机分为实验组和对照组各15只。实验组大鼠颈背部皮下注射野百合碱50 mg/kg;对照组皮下注射0.9%氯化钠注射液1 ml。3周后大鼠行右心导管检查、病理检查和免疫组化检查。结果实验组大鼠表现为进行性右心功能衰竭,死亡2只,平均肺动脉压力、右心室收缩压均明显高于对照组[(40.05±1.78) mmHg vs (18.63±1.80) mmHg(1 mmHg=0.133 kPa),(62.99±2.03) mmHg vs (28.04±2.26) mmHg,P均<0.05]。病理切片HE染色,实验组大鼠肺血管中膜明显增生,管腔狭窄,中膜管壁厚度百分比、中膜管腔面积百分比、右心室肥厚指数[RV/(LV+IVS)]均明显大于对照组[(0.292±0.064) vs (0.106±0.026)、(0.0495±0.092) vs (0.200±0.045)、(0.473±0.041) vs (0.295±0.035),P均<0.05]。实验组大鼠肺血管增殖细胞核抗原免疫组化IA值明显高于对照组[(39.5±8.7) vs (18.5±5.3),P<0.05]。结论经颈背部皮下注射野百合碱建立大鼠肺动脉高压动物模型是一种操作简单、有效可靠的方法,把握几个关键点可以提高建模成功率。
肺动脉高压;大鼠;野百合碱;动物模型
肺动脉高压(pulmonary artery hypertension,PAH)是一类以肺小动脉收缩、增殖与重构为主要特征,进而引起肺血管阻力进行性升高,最终导致右心功能衰竭的肺血管疾病。目前,肺动脉高压尚缺乏有效的根治方法,是肺血管病的研究热点。为了更好地研究其病因及发病机制,本实验拟建立野百合碱注射建立大鼠肺动脉高压的动物模型,并检测其肺血管血流动力学及结构变化,探讨这一动物模型构建过程中的关键点。
材料和方法
1 实验动物及分组 SPF级健康雄性SD大鼠30只,由第二军医大学实验动物中心提供[合格证号:SYXK(沪)2012-0003)],鼠龄6 ~ 8周,体质量160 ~ 200 g。采用随机数字表法将大鼠分为实验组和对照组,每组各15只。
2 肺动脉高压模型建立 健康雄性SD大鼠适应性喂养1周,分笼喂养,每笼5只大鼠,自由饮水,进食普通饲料。野百合碱结晶(美国Sigma Chemical公司)用无水乙醇与0.9%氯化钠注射液混合液(1∶4)配成1%溶液,实验组大鼠按50 mg/kg,一次性颈背部皮下注射。对照组大鼠颈背部皮下注射0.9%氯化钠注射液1 ml。
3 血流动力学检测 给药3周后行右心导管检查。大鼠称重后予30 ml/kg水合氯醛腹腔注射麻醉。将麻醉好的动物仰位固定于手术板上。手术区域颈部剪毛,消毒,于胸骨上窝向上沿正中切开约1 cm皮肤,逐步钝性分离皮下组织和肌肉。参照袁平等[1]改良心导管测定大鼠肺血管阻力的方法,沿右锁骨上5 mm处分离颈外静脉,游离约1 cm,结扎血管远心端,剪口,插入自制弯曲的PE-50导管,固定。导管末端弯曲向左下方向缓慢推进,1 ~2 cm到达颈外静脉与腋静脉交汇处,顺时针旋转导管进入上腔静脉,继续向前推进1 ~ 2 cm进入右心房,适当旋转继续推进1 cm,若感阻力明显下降,多道生理仪显示右心室波形后提示导管进入右心室。导管前端在右心室停留片刻,使其能流向肺动脉入口,然后缓慢推进0.5 ~ 1 cm,当显示器呈现“M”与“N”交替的肺动脉波形时,提示导管已进入肺动脉,固定导管,记录压力曲线。
4 组织学观察 大鼠右心导管测压后放血处死大鼠,取出心脏,去左、右心房及相连的大血管,游离右心室(right ventricular,RV)、左心室(left ventricular,LV)与室间隔(interventricular septum,IVS),0.9%氯化钠注射液冲洗掉附在其上的血栓,滤纸吸去组织表面水分,称重,计算右心室肥厚指数,即RV/(LV+IVS)。各部分组织在4%多聚甲醛溶液中固定48 h,常规石蜡包埋,连续切片,备用于伊红染色(Hematoxylin-Eosin staining,HE)和免疫组化。选取10个与呼吸性细支气管及肺泡管伴行的直径75 ~ 150 μm的肺小动脉,400倍光学显微镜下拍照,用Image J图像分析软件测量血管内径(D1,内弹力膜间距)、血管外径(D2,外弹力膜间距)、血管腔内面积(A1,内弹力膜内面积)和血管壁内面积(A2,外弹力膜内面积),计算肺小动脉管壁厚度百分比(percentage of wall thickness,WT%)与管腔面积百分比(percentage of wall area,WA%)。WT%=(D2-D1)/D2×100%反映肺小动脉管壁的增殖程度,WA%=(A2-A1)/A2×100%反映肺小动脉管腔的狭窄程度。肺组织PCNA免疫组化染色切片用Image-Pro Plus软件扫描作积分光密度(IA)值半定量分析,每只大鼠随机观察10个高倍视野取平均值。
5 统计学处理 统计分析以SPSS19.0软件进行。数据经正态分布检验后,以-x±s表示,数据采用Oneway ANOVA检验;P<0.05为差异有统计学意义。
结 果
1 建模情况 实验组大鼠于注射野百合碱后第2周末逐渐出现进食量和活动量减少、反应迟钝、体质量下降、毛发干枯、呼吸频率加快、喘息加重等症状,且症状进行性加重,在第18、20天时各死亡1只,死亡前表现为口唇部有出血点、呼吸急促、萎靡不振等症状。正常对照组大鼠生长良好,无异常变化及死亡。
2 血流动力学 给药后第22天,两组大鼠行右心导管检查,其中实验组大鼠13只,对照组大鼠15只。正常组大鼠12只成功完成了右心导管检查,测量了右心室压和肺动脉压力;2只PE50导管无法进入右心室;1只PE50导管进入右心室后,反复尝试无法进入肺动脉。实验组大鼠11只成功测量右心室压和肺动脉压力,2只PE50导管无法进入右心室。右心导管检查结果显示,实验组大鼠注射野百合碱后第3周末的右心室收缩压、平均肺动脉压均显著高于正常对照组大鼠(P<0.01)。见表1。

表1 两组大鼠血流动力学参数Tab. 1 Indexes of hemodynamics in rats
3 病理 对照组大鼠全身各组织均无异常改变,实验组大鼠肺组织(尤其左肺中、下叶)明显发暗,可见片状淤血、瘀斑。肺组织HE染色显示,对照组大鼠肺泡完整,肺间质无炎性细胞浸润,肺小动脉血管壁光滑无增厚,管腔无狭窄,血管内皮细胞分布均匀,连续性完整;实验组大鼠肺泡明显破坏,肺间质增厚伴有中性粒细胞浸润,肺小动脉血管壁明显增厚,管腔狭窄,内皮细胞连续性不完整,中层平滑肌细胞增殖肥大、排列紊乱(图1)。大鼠肺小动脉中膜厚度百分比和中膜面积百分比实验组均明显高于对照组(P<0.01);右心室肥厚指数[RV/(LV+IVS)],实验组亦显著高于对照组(P<0.01)。PCNA抗体免疫组化染色IA值实验组较对照组有明显增高(P<0.01)。见图2,表2。
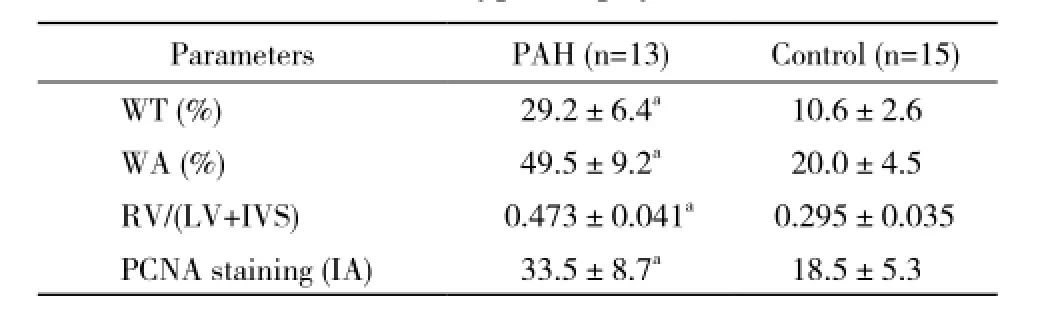
表2 两组大鼠肺小动脉与右心肥厚指数检测结果Tab. 2 Results of pulmonary arterioles and right ventricular hypertrophy in rats
aP<0.01, vs control
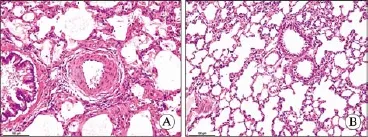
图 1 大鼠肺血管HE染色(×200) A:实验组; B:对照组Fig. 1 HE staining of pulmonary artery in rats (×200) A: experimental group; B: control group
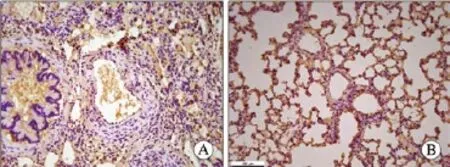
图 2 大鼠肺血管PCNA免疫组化(×200) A:实验组; B:对照组Fig. 2 PCNA immunohistochemistry of pulmonary artery in rats (×200) A: experimental group; B: control group
讨 论
肺动脉高压动物模型的成功建立是肺动脉高压相关性研究的前提和基础,为其提供了可靠的实验平台。据文献报道,建立肺动脉高压大鼠模型一般有4种方法,即野百合碱诱导模型、低氧模型、高肺血流模型和野百合碱诱导联合高肺血流模型,前两种应用较多,后两种使用较少[2-4]。野百合碱可引起肺血管内皮损伤、血管重构,进而导致肺血管阻力增加,肺动脉高压形成,这与人肺动脉高压发病的病理生理机制类似[5]。
野百合碱属于双稠吡咯啶生物碱,药物本身无直接活性,进入机体后在肝内经P450单氧化酶转化成具有活性的野百合碱吡咯[6]。它可选择性地损伤肺动脉内皮,使内皮源性的一氧化氮的合成和分泌明显减少,同时增加缩血管物质的释放,如内皮素1、血小板源性生长因子等,从而引起肺动脉持续性收缩、血管腔狭窄或闭塞。此外,内皮细胞坏死脱落容易启动内源性和外源性凝血途径,导致血栓形成,最终诱导肺动脉高压的发生[7-8]。Labinskyy等[9]研究发现,野百合碱诱导的肺动脉高压大鼠肺动脉周围有大量中性粒细胞浸润,炎症反应明显。体外实验显示野百合碱对神经胶质细胞具有明显的毒性作用,在肝内经细胞色素P450代谢产生具有生物活性的脱氢野百合碱,非竞争性抑制了呼吸链复合体Ⅰ,损害线粒体膜电位,消耗了细胞内三磷酸腺苷,干扰了各种途径的糖代谢产生,从而抑制了肝能量代谢[10-12]。
在建立野百合碱诱导的大鼠肺动脉高压模型中,为了提高建模的成功率,需要关注以下问题:1)野百合碱溶液配制的溶剂有两种,一种是先用盐酸充分溶解,再用氢氧化钠滴定,使pH值达到7.4;另一种是采用1∶4的无水乙醇/0.9%氯化钠注射液进行溶解,这两种方法效果类似,不影响建模的成功率,但后一种方法操作更为简单。2)野百合碱注射的部位,绝大多数文献采用颈背部皮下注射,也有少部分文献报道可以通过腹腔注射;腹腔注射野百合碱在肺动脉高压自然发病过程中并不存在,这种方法复制的肺动脉高压动物模型不能真实地反映肺动脉高压病理生理状态;腹腔内腹膜面积大、吸收快,野百合碱的毒性作用可使大鼠死亡率升高[13-14]。3)野百合碱注射的剂量,肺动脉高压建模使用的野百合碱剂量可以为30 mg/kg、40 mg/kg、50 mg/kg或60 mg/kg,药物使用剂量越大,肺血管破坏就越严重,肺小动脉增殖和重构越明显,肺动脉压力也就越高,同时大鼠的死亡率也随之上升;但低剂量组造模时间稍长,需要4周以上,而高剂量组在第3周就显示造模成功[15-16]。在本研究中,我们建模采用的是50 mg/kg野百合碱大鼠颈背部皮下注射,这样既保证了大鼠肺动脉高压的造模成功率,又降低了其死亡风险。4)野百合碱注射的频率,野百合碱会引起肺血管内皮破坏、刺激中膜增殖、导致肺血管重构,这种作用比较剧烈,1次注射药物就可成功建立肺动脉高压的模型。5)大鼠饲养注意通风、清洁,适宜的温度和湿度,定期喂食、水可以有效提高大鼠生存率。本实验中,野百合碱注射3周后右心导管检查显示,与正常对照组相比,实验组大鼠右心室收缩压、肺动脉压均明显升高,平均肺动脉压均超过25 mmHg,达到了中度以上肺动脉高压的标准。实验组大鼠HE染色的病理切片显示,肺血管增殖、重构,肺间质增生伴大量炎细胞浸润,肺小动脉内皮细胞连续性不完整,中层平滑肌细胞增殖肥大、排列紊乱,管壁增厚管腔狭窄;肺血管PCNA免疫组化显示,肺血管中膜明显增殖。而且,实验组大鼠出现肺小动脉管腔内明显淤血,气管有少许血液渗出等右心功能衰竭征象,这些都提示肺动脉高压大鼠模型成功建立。
本研究证实了,野百合碱注射诱导大鼠肺动脉高压是一种操作简单、有效、可靠的理想动物模型。在实验过程中,对于野百合碱的溶质选择、配制浓度、注射部位以及注射频率等条件的准确把握,是提高和确保建模成功率的关键。
1 Yuan P, Wu WH, Liu D, et al. Determination of pulmonary vascular resistance by improved right heart catheter in rat[J]. Zhonghua Xin Xue Guan Bing Za Zhi, 2011, 39(10):901-904.
2 Fricker M, Deane A, Hansbro PM. Animal models of chronic obstructive pulmonary disease[J]. Expert Opin Drug Discov,2014, 9(6): 629-645.
3 Rungatscher A, Linardi D, Milani EA, et al. Chronic overcirculationinduced pulmonary arterial hypertension in aorto-caval shunt[J]. Microvasc Res, 2014, 94: 73-79.
4 Ryan JJ, Marsboom G, Archer SL. Rodent models of group 1 pulmonary hypertension[J]. Handb Exp Pharmacol, 2013, 218:105-149.
5 Abe K, Shimokawa H, Morikawa K, et al. Long-term treatment with a Rho-kinase inhibitor improves monocrotaline-induced fatal pulmonary hypertension in rats[J]. Circ Res, 2004, 94(3):385-393.
6 Bal E, Ilgin S, Atli O, et al. The effects of gender difference on monocrotaline-induced pulmonary hypertension in rats[J]. Hum Exp Toxicol, 2013, 32(7): 766-774.
7 Paulin R, Meloche J, Courboulin A, et al. Targeting cell motility in pulmonary arterial hypertension[J]. Eur Respir J, 2014, 43(2):531-544.
8 Yamada Y, Maruyama J, Zhang EQ, et al. Effect of thrombomodulin on the development of monocrotaline-induced pulmonary hypertension[J]. J Anesth, 2014, 28(1): 26-33.
9 Labinskyy N, Csiszar A, Wu JM, et al. Resveratrol prevents monocrotaline-induced pulmonary hypertension in rats[J]. Hypertension, 2008, 22(3): 668-675.
10 Silva-Neto JP, Barreto RA, Pitanga B, et al. Genotoxicity and morphological changes induced by the alkaloid monocrotaline,extracted from Crotalaria retusa, in a model of glial cells[J]. Toxicon, 2010, 55(1): 105-117.
11 Mingatto FE, Dorta DJ, Dos Santos AB, et al. Dehydromonocrotaline inhibits mitochondrial complex 1. A potential mechanism accounting for hepatotoxicity of monocrotaline[J]. Toxicon, 2007, 50(5):724-730.
12 Mingatto FE, Maioli MA, Bracht A, et al. Effects of monocrotaline on energy metabolism in the rat liver[J]. Toxicol Lett, 2008, 182(1/3):115-120.
13 Campian ME, Hardziyenka M, De Bruin K, et al. Early inflammatory response during the development of right ventricular heart failure in a rat model[J]. Eur J Heart Fail, 2010, 12(7): 653-658.
14 Karasu-Minareci E, Ozbudak IH, Ozbilim GA. Acute effects of vardenafil on pulmonary artery responsiveness in pulmonary hypertension[J/OL]. http://www.hindawi.com/journals/ tswj/2012/718279
15 Tofovic SP, Jones T, Petrusevska G. Dose-dependent therapeutic effects of 2-Methoxyestradiol on Monocrotaline-Induced pulmonary hypertension and vascular remodelling[J]. Prilozi, 2010, 31(1):279-295.
16 马凯,邢泉生,邢介龙,等.不同剂量野百合碱诱导大鼠肺动脉高压模型的实验研究[J].现代生物医学进展,2013,13(21):4005-4009.
Monocrotaline injection in establishing rat model of pulmonary hypertension
LI Songhua1, SHI Renhua1, ZHU Qin2, SHI Chengyong1, DU He1, ZHAO Xianxian1, CHEN Shaoping1, QIN Yongwen11Department of Cardiovasology, Changhai Hospital;2Retired Cadres Sanatorium in Xiangyin Road Second Military Medical University, Shanghai 200433, China
QIN Yongwen. Email: qyw2009@163.com
Objective To investigate the method and key points of monocrotaline injection in establishing pulmonary hypertension model of rats. Methods Thirty Sprague dawley (SD) male rats of SPF grade were randomly divided into two groups: experiment group (n=15) and control group (n=15). The experimental rats received subcutaneous injection of monocrotaline accounting for 50 mg/kg, and rats in control group received subcutaneous injection of 0.9% sodium chloride accounting for 1 ml. Three weeks later, the rats underwent right heart catheterization, pathology and immunohistochemistry. Results Rats in experimental group showed progressive right heart failure with 2 rats died. The mean pulmonary artery pressure and right ventricular systolic pressure in experimental rats were significantly higher than control group [(40.05±1.78) mmHg vs (18.63±1.80) mmHg (1 mmHg=0.133 kPa), (62.99±2.03) mmHg vs (28.04±2.26) mmHg, P<0.05]. HE staining showed rats in the experimental group with pulmonary vascular membrane hyperplasia and stenosis, and WT%, WA%, RV/(LV + IVS) in rats of experimental group were signif i cantly higher than control group [(0.292±0.064) vs (0.106±0.026), (0.0495±0.092) vs (0.200±0.045), (0.473±0.041) vs (0.295±0.035), P<0.05]. IA value of pulmonary vascular PCNA immunohistochemistry in experimental group was significantly higher than control group [(39.5±8.7) vs (18.5±5.3), P<0.05]. Conclusion Monocrotaline injection in establishing rat model of pulmonary hypertension is a simple, effective and reliable method, and the modeling success rate can be improved with a few key points.
pulmonary hypertension; rats; monocrotaline; animal model
R 692
A
2095-5227(2015)02-0171-04
10.3969/j.issn.2095-5227.2015.02.020
时间:2014-10-20 16:15
http://www.cnki.net/kcms/detail/11.3275.R.20141020.1615.002.html
2014-07-29
上海市科学技术委员会科研计划项目(13ZR1409000);上海市卫生局局级科研项目(2012461);长海医院“1255”学科建设计划资助项目(CH125531702)
Supported by Project of the Science and Technology Committee of Shanghai (13ZR1409000); Shanghai Health Bureau Scientific Research Found Project (2012461)
李松华,男,博士,主治医师。研究方向:肺血管疾病。Email: lisonghua2000@163.com;共同第一作者:石仁华,学士,医师。研究方向:疾病预防与控制。Email: xiaohua0920@163.com
秦永文,男,主任医师,主任,博士生导师。Email: qy w2009@163.com
