金雀异黄素对兔增生性玻璃体视网膜病变的防治实验
2015-03-20张玉玲吴秀娟
张玉玲,吴秀娟,赵 平
1河北省唐山市人民医院 眼科,河北唐山 063000;2河北医科大学第三医院 眼科,河北石家庄 050000
金雀异黄素对兔增生性玻璃体视网膜病变的防治实验
张玉玲1,吴秀娟1,赵 平2
1河北省唐山市人民医院 眼科,河北唐山 063000;2河北医科大学第三医院 眼科,河北石家庄 050000
目的探讨金雀异黄素对兔增生性玻璃体视网膜病变的防治作用。方法24只健康新西兰大白兔随机分为空白组、模型组(自血+ 0.1 ml 0.9%氯化钠注射液)和实验组(自血+ 0.1 ml 40 mg/L金雀异黄素)。用裂隙灯显微镜、眼底镜观察玻璃体视网膜的增生情况。术后第28天采用双抗夹心酶联免疫吸附试验检测血小板源性生长因子和表皮生长因子在玻璃体腔内的含量,并用HE染色法在光镜下观察各组视网膜组织结构。结果术后第14天模型组及实验组视网膜增生程度分别为2.54%、0.69%,第21天为3.00%、0.93%,第28天为3.13%、1.06%,实验组视网膜增生程度均显著低于模型组(P<0.05)。术后第28天空白组、模型组及实验组血小板源性生长因子含量分别为(79.29±24.77) pg/ml、(349.98±67.36) pg/ml、(180.45± 38.99) pg/ml,表皮生长因子含量分别为(0.192±0.385)μg/L、(1.215±0.087)μg/L、(0.367±0.06)μg/L,实验组和空白组的血小板源性生长因子和表皮细胞生长因子含量均显著低于模型组(P<0.01)。结论玻璃体腔内注射金雀异黄素对玻璃体视网膜的增生有明显抑制作用。
增生性玻璃体视网膜病变;金雀异黄素;血小板源性生长因子;表皮生长因子
金雀异黄素是酪氨酸激酶抑制剂,而酪氨酸激酶在细胞生长、增殖、分化中起着重要作用[1]。血小板源性生长因子(platelet-derived growth factor,PDGF)和表皮生长因子(epidermal growth factor,EGF)受体具有酪氨酸激酶的特性,金雀异黄素可以通过抑制生长因子受体的酪氨酸激酶而抑制生长因子发挥生物学作用,而这两种生长因子在增生性玻璃体视网膜病变(proliferative vitreoretinopathy, PVR)的发展过程中有着重要作用。因此,金雀异黄素对PVR的发生、发展可能具有防治作用。本实验将40 mg/L金雀异黄素注射到兔眼玻璃体腔内,观察不同时期玻璃体视网膜的变化,定量检测玻璃体腔内血小板源性生长因子、表皮生长因子含量并用光镜观察视网膜组织结构的改变,探讨金雀异黄素对PVR的防治效果。
材料和方法
1 实验动物及分组 新西兰大白兔24只,体质量1.8 ~ 2.0 kg,左眼为实验眼,随机分为3组。空白组:不做任何处理;模型组:玻璃体腔内注射0.1ml自血+ 0.1 ml 0.9%氯化钠注射液;实验组:0.1 ml自血+ 0.1 ml 40 mg/L金雀异黄素(华北制药厂)。
2 模型制作 16只实验动物左眼用复方托吡卡胺滴眼液充分散瞳,检查瞳孔充分散大,2.5%硫喷妥钠溶液,按70 mg/kg的剂量,肌内注射,麻醉满意后用盐酸丙美卡因滴眼液角膜表面麻醉,0.9%氯化钠注射液充分冲洗结膜囊,1 ml注射器前房穿刺,放出0.2 ml房水;于颞上方距角膜缘后4 mm处向玻璃体中心方向进针3 ~ 5 mm,直视下将实验药物注射到玻璃体腔中央;用另一个1 ml注射器从实验动物耳缘静脉抽取自血0.1 ml,用同样的方法行玻璃体腔内注射,拔针后立刻压迫针孔防止血液和药物反流。
3 视网膜增生评级标准 术后第1、3、7、14、21、28天充分散大左眼瞳孔,裂隙灯显微镜和直接检眼镜观察并记录伤口、前房、晶状体及玻璃体视网膜增生情况,按Weiss评级标准对玻璃体视网膜的增生情况进行分级:0级:无增生;0.5级:玻璃体腔内勉强可见增生痕迹;1级:可见细小增生束,但无真正条索形成;2级:浓厚增生束形成;3级:细薄增生条索;4级:浓厚增生条索[2]。
4 玻璃体视网膜观察 术后第1、3、7、14、21、28天用裂隙灯显微镜、眼底镜观察玻璃体视网膜的改变,并按Weiss评级标准记录。
5 玻璃体PDGF和EGF检测 3组实验动物于造模后第28天充分散大瞳孔,采用耳缘静脉注射空气的方法处死,于角膜缘后4 mm处从不同的钟点位用7号针头从玻璃体腔内抽取玻璃体液0.5 ml两份,储存于-20℃冰箱内待测。采用双抗夹心酶联免疫吸附试验(试剂盒上海贝西公司进口分装)检测玻璃体液中PDGF和EGF的含量。
6 视网膜组织观察 术后第28天抽取实验动物玻璃体后,立即摘除眼球,去除角膜和晶状体,取距视盘颞侧2PD的视网膜组织,大小为10 mm×10 mm,固定于10%甲醛溶液中,用HE染色法在光镜下观察视网膜组织结构。
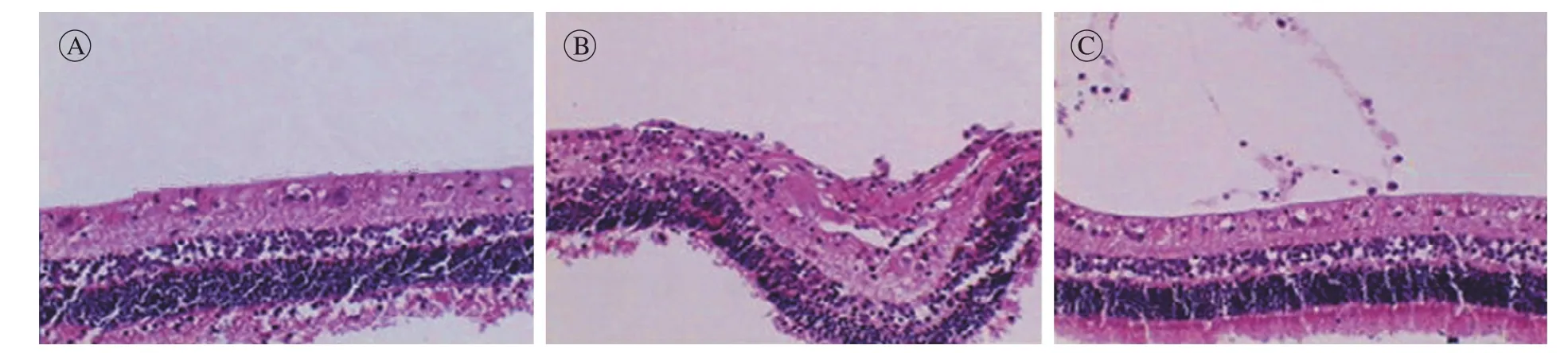
图 2 视网膜组织染色(HE染色×200) A:空白组; B:模型组; C:实验组Fig. 2 HE staining of retinal tissue (HE×200) A: blank group; B: model group; C: experiment group
7 统计学处理 各组玻璃体视网膜的增生程度随时间的变化情况用曲线图表示。用SPSS12.0统计软件对PDGF和EGF的含量测定结果进行分析,实验数据用表示,两两比较采用q检验,P<0.05为差异有统计学意义。秩和检验用于PVR分级情况的比较。
结 果
1 各组视网膜增生情况比较 空白组在整个实验过程中玻璃体腔透明,均未见混浊及增生。模型组和实验组玻璃体视网膜的增生均随着时间的延长而加重,但实验组较模型组明显缓慢,且增生程度明显轻于模型组。见图1。
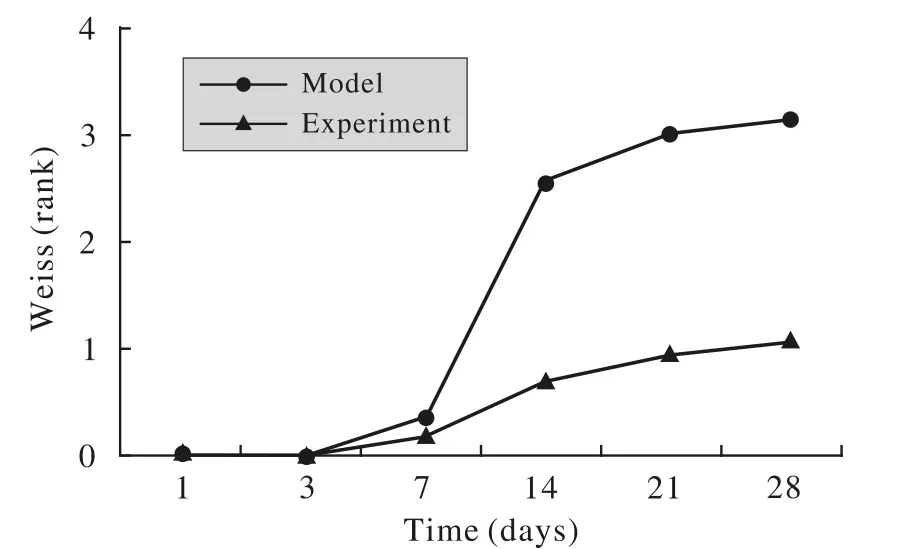
图 1 视网膜增生随时间变化情况Fig. 1 Time-elapsed conditions of proliferative in retina
2 PVR分级比较 术后第14天,PVR平均分级实验组为0.69,模型组为2.54;术后第21、28天实验组玻璃体视网膜的增生程度较模型组显著低;术后第28天实验组PVR严重程度明显低于模型组;以上差异均有统计学意义(P<0.05)。见表1。
3 玻璃体液中PDGF和EGF的含量 造模后第28天,实验组及模型组玻璃体中PDGF和EGF的含量均较正常组升高(P<0.01或P<0.05)。实验组中PDGF和EGF的含量均显著低于模型组(P<0.01)。见表2。
4 视网膜组织病理学检查 空白组各层组织结构清晰,未见水肿及细胞数量变化,玻璃体透明,未见渗出、出血及纤维增殖膜形成。模型组神经纤维层局部性水肿,神经节细胞数量减少,神经胶质细胞数量增加,玻璃体腔中有少量渗出和出血,浓厚的增生条索。实验组:各层组织结构稍紊乱,细胞排列整齐,局部神经纤维层水肿,少许渗出物附于内界膜上。见图2。
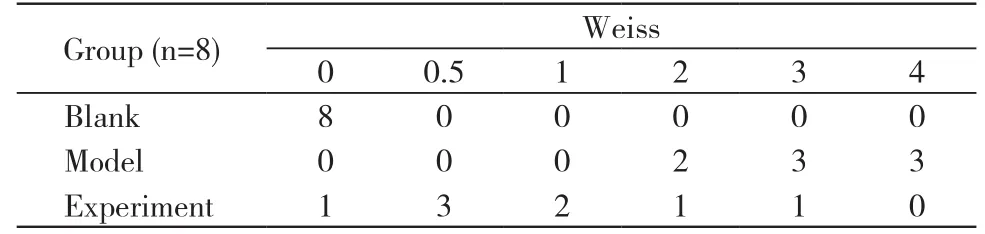
表1 术后第28天各组 PVR分级Tab. 1 PVR stages in each group on the 28 th day after operation
表2 玻璃体腔内PDGF和EGF含量表达比较Tab. 2 Comparison of PDGF and EGF concentration in vitreous ()

表2 玻璃体腔内PDGF和EGF含量表达比较Tab. 2 Comparison of PDGF and EGF concentration in vitreous ()
aP<0.05,bP<0.01, vs blank group;cP<0.05,dP<0.01, vs model group
讨 论
金雀异黄素是生长因子受体酪氨酸激酶抑制剂,特别对表皮生长因子受体和血小板源性生长因子受体的酪氨酸激酶的有明显抑制作用,通过抑制酪氨酸激酶的活性抑制细胞增殖,促进细胞凋亡,阻止病变发展[1,3]。血小板源性生长因子和表皮生长因子在PVR发展过程中有着极为重要的作用[4-6]。
血小板源性生长因子由多种细胞分泌产生,发挥生理学作用主要是通过与相应的受体结合。在PVR增生膜上可检测到PDGF及其受体,当PDGF和PDGFR结合后通过酪氨酸激酶启动细胞增殖信号,细胞开始增生,PVR发展,且发展程度与PDGF的浓度具有相关性[7-8]。因此,应用激酶抑制剂阻断PDGFR信号通路,可阻止PVR的发展[9]。从本实验结果中可以看到,实验组玻璃体腔内PDGF含量较模型组均显著降低,且玻璃体视网膜增生程度较模型组也明显降低。
表皮生长因子具有刺激细胞增生和分化的能力,其发挥作用需与相应的受体结合。表皮生长因子受体属于PTK受体[10]。在视网膜色素上皮(retinal pigment epithepithelium,RPE)细胞上可检测到EGFR的表达,通过细胞因子的刺激激活,EGFR促进视网膜色素上皮细胞增殖、迁移,加速PVR的发展[11]。研究表明,应用EGFR阻断剂可以阻止视网膜色素上皮细胞迁移,减轻PVR[12]。从本实验的结果中可以看到,实验组玻璃体腔内EGF含量较模型组均显著降低,而且从玻璃体视网膜增生变化曲线看,实验组增生程度进展缓慢,增生程度减轻。
视网膜色素上皮细胞是PVR增生膜主要的细胞成分,在PVR的发展过程中发挥重要作用,主要表现为细胞的脱落、移行和增生,并可转化为其他细胞,分泌多种细胞因子,细胞因子反过来参与RPE细胞生长的调节,提高RPE细胞自身反应性,加速PVR的发生和发展[13-15]。
金雀异黄素可以抑制视网膜色素上皮细胞增生,诱导其凋亡,并可抑制视网膜色素上皮细胞分泌多种细胞因子,而且抑制增生、诱导凋亡的作用具有剂量依赖性,浓度越高其抑制作用越明显,对视网膜毒性也越显著,研究证实眼内注入40 mg/L是安全的,对视网膜无明显毒性反应[16-17]。
本实验结果显示,模型组及实验组中玻璃体腔内PDGF和EGF含量均明显高于正常对照组,表明这两种细胞因子参与了PVR的发生发展。实验组玻璃体腔内PDGF和EGF含量较模型组均显著降低,证实金雀异黄素能够降低玻璃体腔内PDGF和EGF的含量。金雀异黄素抑制了细胞的增生,从而使其自分泌或旁分泌的细胞因子相应减少,这可能是实验组玻璃体腔内PDGF和EGF低于模型组的原因。玻璃体腔内细胞因子含量的降低,使细胞增生、迁移减弱,从而阻止了PVR的发展。术后7 ~ 14 d为PVR的增生期,此期间由于各种生长因子的大量分泌,导致视网膜前和玻璃体腔内有大量细胞增生,玻璃体视网膜增生程度加剧。从模型组玻璃体视网膜增生变化曲线看,7 ~ 14 d玻璃体视网膜增生程度显著加剧,大多数眼出现纤维增生条索,随增生过程进展,增生条索渐粗大。而实验组玻璃体视网膜增生程度相对缓和,在观察时间内未见明显增生条索。对取材视网膜组织病理学观察结果也显示,实验组视网膜增生程度明显轻于模型组。以上实验结果表明,此浓度的金雀异黄素能有效抑制实验性PVR的发生发展。
本研究结果表明,金雀异黄素具有防治PVR的作用,其可能作用机制:1)金雀异黄素抑制了酪氨酸激酶受体,阻断了PDGF和EGF与其相应的受体结合后促进细胞增生、迁移的作用,从而抑制了PVR的发生、发展;2)金雀异黄素抑制了视网膜色素上皮细胞增生,从而减少了RPE细胞分泌的细胞因子,细胞因子的减少反过来使RPE细胞迁移、增生减轻,从而中断了PVR的链式反应,减轻了病变。因此,金雀异黄素可经过多条途径,在PVR的发展过程中发挥作用。
综上,金雀异黄素能够通过降低玻璃体腔内PDGF和EGF的含量,降低玻璃体视网膜增生的程度。因此,金雀异黄素有望成为玻璃体腔内的填充物,用于防治PVR。
1 Akiyama T, Ishida J, Nakagawa S, et al. Genistein, a specific inhibitor of tyrosine-specific protein kinases[J]. J Biol Chem,1987, 262(12):5592-5595.
2 Weiss JF, Belkin M. The effect of penicillamine on posttraumatic vitreous proliferation[J]. Am J Ophthalmol, 1981, 92(5):625-627.
3 Vanharanta M, Voutilainen S, Rissanen TH, et al. Risk of cardiovascular disease-related and all-cause death according to serum concentrations of enterolactone: Kuopio Ischaemic Heart Disease Risk Factor Study[J]. Arch Intern Med, 2003, 163(9):1099-1104.
4 聂玉红, 瞿雯, 邢怡桥, 等. PDGF对人RPE细胞中MMP-2、MMP-9和TIMP-1表达的影响[J]. 中华实验眼科杂志, 2014,32(1): 6-11.
5 Chen Z, Chen CZ, Gong WR, et al. Integrin-alpha(5) Mediates Epidermal Growth Factor-Induced Retinal Pigment Epithelial Cell Proliferation and Migration[J]. Pathobiology, 2010, 77(2): 88-95.
6 Jabbarvand M, Salamatrad A, Hashemian HA, et al. Continuous intracorneal ring implantation for keratoconus using a femtosecond laser[J]. J Cataract Refract Surg, 2013, 39(7): 1081-1087.
7 Cui J, Lei HT, Samad A, et al. PDGF receptors are activated in human epiretinal membranes[J]. Exp Eye Res, 2009, 88(3):438-444.
8 蒋姣姣,彭燕一,黄海,等.PDGF-α受体反义寡核苷酸治疗实验性增生性玻璃体视网膜病变[J].眼科新进展,2013,33(9):812-815.
9 苗景鹏, 魏文斌. 增生性玻璃体视网膜病变的发病机制及治疗研究进展[J]. 国际眼科纵览, 2013, 37(6): 367-373.
10 Hubbard SR, Miller WT. Receptor tyrosine kinases: mechanisms of activation and signaling[J]. Curr Opin Cell Biol, 2007, 19(2):117-123.
11 张磊, 孙晓东. 表皮生长因子及受体与增生性玻璃体视网膜病变[J]. 国际眼科杂志, 2009, 9(1): 132-134.
12 Xu KP, Yu FS. Cross talk between c-Met and epidermal growth factor receptor during retinal pigment epithelial wound healing[J]. Invest Ophthalmol Vis Sci, 2007, 48(5):2242-2248.
13 Leiderman YI, Miller JW. Proliferative vitreoretinopathy:pathobiology and therapeutic targets[J]. Semin Ophthalmol, 2009,24(2): 62-69.
14 Karthikeyan B, Kalishwaralal K, Sheikpranbabu S, et al. Gold nanoparticles downregulate VEGF-and IL-1β-induced cell proliferation through Src kinase in retinal pigment epithelial cells[J]. Exp Eye Res, 2010, 91(5): 769-778.
15 段娜, 周灵. 增殖性玻璃体视网膜病变的研究进展[J]. 山东医药, 2013, 53(42): 103-105.
16 曹鎏, 马健, 袁志兰, 等. 金雀异黄素对培养的人RPE细胞诱导凋亡作用的研究[J]. 眼科新进展, 2010, 30(12): 1123-1126.
17 游江, 姜德咏. Genistin防治增生性玻璃体视网膜病变的研究[J]. 中南大学学报:医学版, 2010, 35(7): 749-753.
Protective effect of genistein on proliferative vitreoretinopathy
ZHANG Yuling1, WU Xiujuan1, ZHAO Ping2
1Department of Ophthalmology, Tangshan City People's Hospital, Tangshan 063000, Hebei Province, China;2Department of Ophthalmology, the Third Hospital of Hebei Medical University, Shijiazhuang 050000, Hebei Province, China
ZHAO Ping. Email: zhpsjz@126.com
ObjectiveTo investigate the preventing effect of genistein on proliferative vitreoretinopathy.MethodsTwentyfour healthy New Zealand white rabbits were selected randomly and divided into three groups: blank group, model group (blood therapy+0.9% sodium chloride accouting for 0.1 ml) and experimental group (blood therapy+40 mg/L genistein accounting for 0.1 ml). Changes in vitreous body and retina were observed with silt lamp microscope and funduscope. The eyes were enucleated to make samples for optical microscope for observing pathological changes of the retina by HE staining on the 28th day after injection of drug. The content of platelet-derived growth factor (PDGF) and epidermal growth factor (EGF) was measured by ELISA. Results Hyperplasia level of vitreous and retina in experiment group was significantly lower than model group on the 14th, 21th and 28th day (0.69% vs 2.54%; 0.93% vs 3.00%; 1.06% vs 3.13%; P<0.05). The contents of PDGF and EGF in experiment group were significantly lower than model group and blank group [(180.45±38.99) pg/ml and (79.29±24.77) pg/ml vs (349.98±67.36) pg/ml; (1.215±0.087) μg/L and (0.192±0.385) μg/L vs (0.367±0.06) μg/L, P<0.05].ConclusionIntravitreal injection of genistein has obvious inhibitory to proliferative vitreoretinopathy (PVR).
proliferative vitreoretinopathy; genistein; platelet-derived growth factor; epidermal growth factor
R 774.1;R 776.4
A
2095-5227(2015)12-1232-04
10.3969/j.issn.2095-5227.2015.12.019
时间:2015-10-21 09:46:14
http://www.cnki.net/kcms/detail/11.3275.R.20151021.0946.006.html
2015-06-15
张玉玲,女,硕士,主治医师。研究方向:眼科学。Email: xiaoke-happy@126.com
赵平,女,主任医师,硕士生导师。Email: zhpsjz@ 126.com
