索拉非尼治疗中老年晚期肾癌的疗效观察
2015-03-20令狐锐霞王英哲饶辉辉杨俊兰
令狐锐霞,司 文,王英哲,饶辉辉,杨俊兰
1解放军总医院 肿瘤内科,北京 100853;2南开大学医学院 天津 300071
索拉非尼治疗中老年晚期肾癌的疗效观察
令狐锐霞1,司 文2,王英哲1,饶辉辉1,杨俊兰1
1解放军总医院 肿瘤内科,北京 100853;2南开大学医学院 天津 300071
目的研究索拉非尼治疗中老年转移性肾癌(metastatic renal cell carcinoma,mRCC)的长期疗效及安全性。方法回顾性分析解放军总医院2006年10月- 2012年4月口服索拉菲尼(Sorafenib)治疗的20例转移性肾癌患者的临床疗效。结果20例中男性17例,女性3例,中位年龄61(45 ~ 83)岁,平均随访时间40个月。其中完全缓解(CR)1例,部分缓解(PR)5例,疾病稳定(SD)14例,至随访截止6例疾病进展(PD)均死亡;客观有效率(objective response rate,ORR)为30%(6/20),临床获益率(clinical benefit response rate,CBR)指CR+PR+SD≥18个月的患者百分比,为65%(13/20)。中位无进展生存期(progression-free-survival,PFS)为46.1(35.8 ~ 56.4)个月。结论索拉非尼对中老年晚期肾癌的病情控制理想,长期疗效肯定。
肾癌;索拉菲尼;无进展生存期
肾癌是泌尿生殖系常见的恶性肿瘤。据统计,肾癌占美国所有新发恶性肿瘤的4.2%[1]。在我国,肾癌发病率位于泌尿外科恶性肿瘤第2位,仅次于膀胱癌;约25%的患者就诊时已有远处转移,局限性肾癌手术的患者切除后约1/3出现远处转移,其5年生存率<10%[2]。与其他恶性肿瘤相比,肾癌对放、化疗和激素治疗均不敏感[3]。2006年美国食品和药品管理局(Food and Drug Administration,FDA)正式批准索拉非尼用于治疗转移性肾癌,标志着肾癌分子靶向治疗时代的来临。索拉非尼是一种口服的小分子多激酶抑制剂,能够抑制细胞内b-RAF、c-RAF激酶、RAS基因及多种受体酪氨酸激酶的活性,并阻断RAF/MEK/ERK磷酸化从而抑制肿瘤细胞的生长和增殖;索拉非尼还可以抑制血管内皮生长因子和血小板衍生生长因子受体,从而阻断肿瘤新生血管的形成,是具有双重抗肿瘤作用的药物[4-5]。已有多项研究结果证实索拉非尼在欧美人群中可显著延长晚期肾癌患者的无进展生存期(progression-free-survival,PFS)和总生存期(overall survival,OS)[6-8]。据国内外文献报道,其治疗亚裔人群的疗效优于欧美人群[9-10]。本文回顾性分析了索拉非尼治疗20例中老年肾癌患者的长期疗效及不良反应耐受情况,为高龄晚期肾癌患者的临床用药提供依据。
对象和方法
1 对象 2006年10月- 2012年4月解放军总医院肿瘤内科连续收治的经索拉菲尼一线治疗的中老年晚期肾癌患者20例,其中男性17例,女性3例,中位年龄为61(45 ~ 83)岁。全部患者均经穿刺活检或术后病理确诊,主要病理类型为透明细胞癌17例,乳头状细胞癌1例,颗粒细胞癌2例。13例曾行根治性肾切除术,术后中位无病生存期(disease-free survival,DFS)为65.2(5.8 ~ 98.7)个月,其中3例既往接受过低剂量干扰素(interferon,IFN)或白细胞介素-2(interleukin-2,IL-2)辅助治疗。转移累及≥2个脏器者10例,单纯肺转移4例,胸膜转移1例,腹膜后转移3例,肝转移1例,手术局部种植转移1例。按实体瘤评价标准(Response Evaluation Criteria Insolid Tumors,RECIST)至少有1处可测量病灶(最大单径≥1 cm)。
2 治疗方法 索拉非尼单药口服400 mg/d,2次/d,空腹给药,服药后2 h内禁止摄入高脂饮食,若服药过程中出现严重不良反应,减量或暂停服药。本组20例中仅1例女性患者服药2周后因不良反应减半药量,维持15 d后再次恢复正常剂量。2例服药期间病情进展后,继续接受索拉非尼增量治疗,每次600 mg,2次/d,药物加量后患者不良反应仍可耐受。
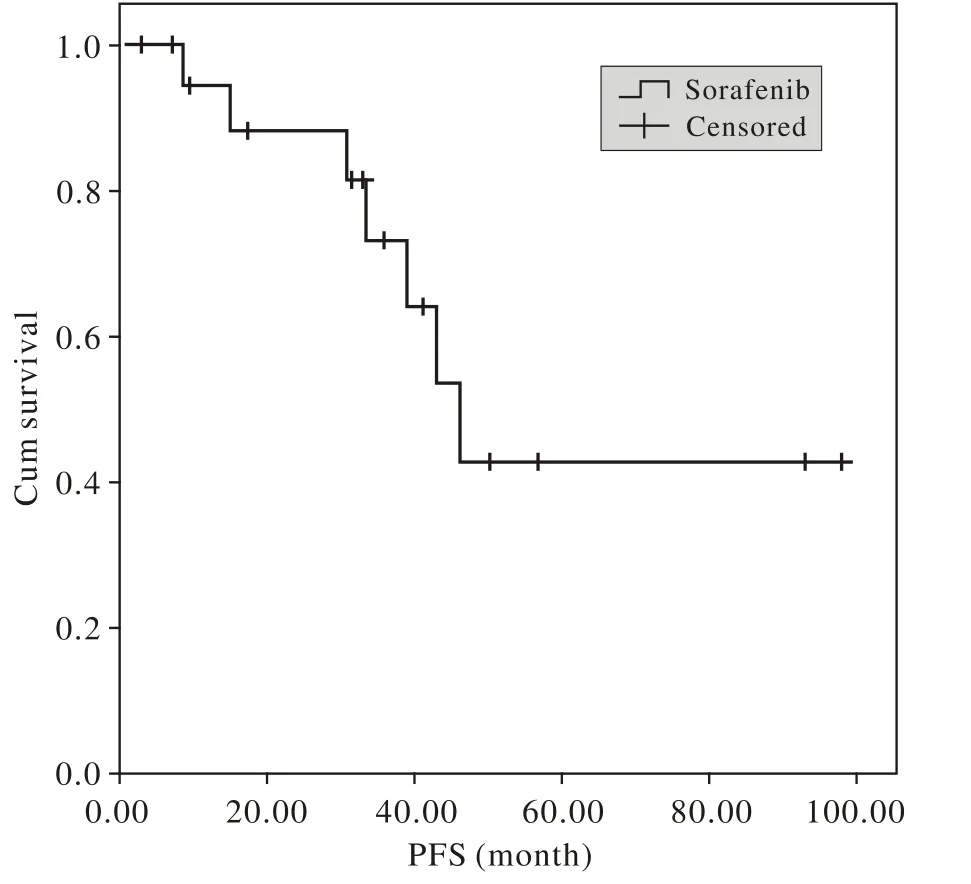
图 1 20例经索拉菲尼治疗肾癌患者的PFSFig. 1 PFS of 20 metastatic renal cell carcinoma patients treated with Sorafenib
3 临床疗效及不良反应评价标准 按照RECIST实体瘤治疗评价标准,主要采用CT进行疗效评估,用药开始1年内每8周全面复查进行评价,1年后若病情稳定改为每12周评价疗效。每6个月检查ECT骨显像。不良反应的评定参照2003年版美国国家癌症研究所通用不良反应评定标准(NCI-CTCAE V3.0)。主要观察终点为中位PFS,次要观察终点为客观有效率(objective response rate,ORR)、疾病控制率和安全性。按照RECIST评价标准,疗效分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。ORR为治疗期间达到客观缓解(CR+PR)的患者百分比,临床获益率(clinical benefit response rate,CBR)为临床获益达到18个月(CR+PR+SD≥18个月)的患者百分比。
结 果
1 临床疗效 随访截止至2014年12月1日,中位随访时间为41.0(32.9 ~ 98.0)个月,无失访。总计20例,均为有效,其中CR 1例,PR 5例,SD 14例;ORR为30%(6/20),CBR为65%(13/20)。至随访截止6例出现PD,均死亡;中位PFS为46.1 (35.8 ~ 56.4)个月,见图1。其中4例有效时间>48个月,2例>90个月。2例PD后加量服药再次达到SD并维持超过4个月,其中1例目前仍在治疗中。
2 安全性 服药后的不良反应主要包括手足皮肤反应、腹泻、乏力、高血压、黏膜及牙龈溃疡等。最常见不良反应为手足皮肤反应,发生率为80%,其次为皮疹65%,腹泻55%,乏力45%,高血压25%,黏膜溃疡及牙龈出血20%。不良反应多为1 ~2级,多于服药后2 ~ 4周出现,一般在服药2 ~ 3个月后逐渐耐受。较为严重者减半药量或暂停服药,不良反应减轻,再次恢复或加量后不良反应可耐受,未出现因无法耐受不良反应而终止治疗者。见表1。
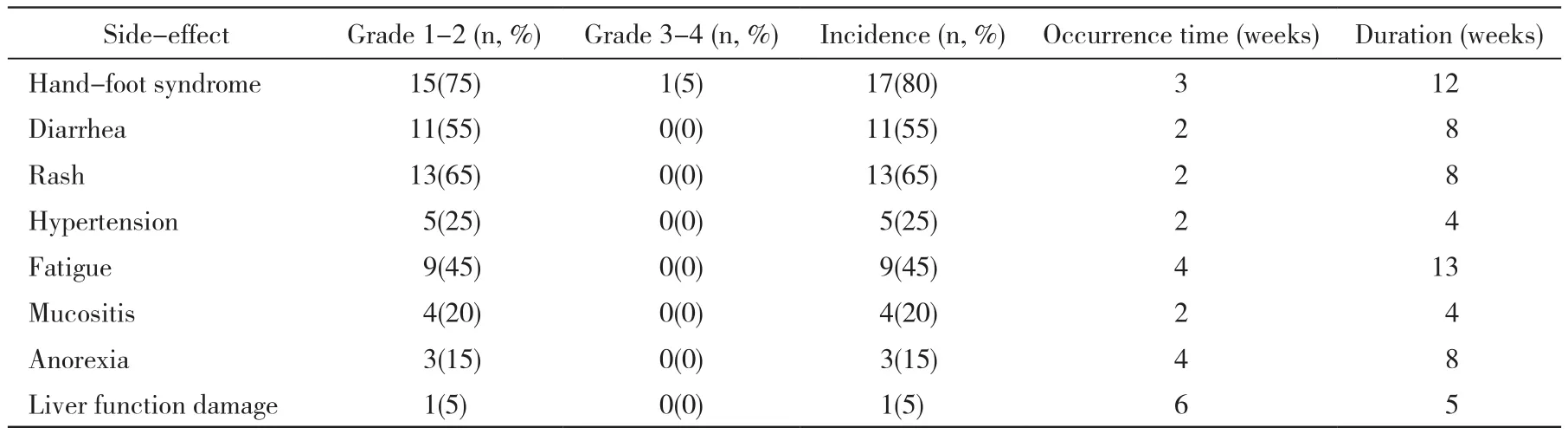
表1 20例经索拉菲尼治疗肾癌患者的安全性Tab. 1 Safety of 20 metastatic renal cell carcinoma patients treated with Sorafenib
讨 论
晚期肾癌对传统的放化疗不敏感,对IFN及高剂量IL-2治疗有一定疗效,但免疫治疗总有效率仅为15%[10-11]。Stadler等[12]报道了索拉非尼治疗晚期肾癌2 504例的扩展研究结果,包括既往未系统治疗过、非透明细胞癌、脑转移、老年患者,最终得出索拉非尼治疗非透明细胞癌与透明细胞癌疗效接近,对于老年患者耐受性好。张奇夫等[13]报道索拉菲尼对高龄晚期肾癌患者有效,且具有良好的耐受性与安全性。ARCCS研究中的结果也证明索拉非尼对老年患者安全性良好,亚组分析发现其临床疗效与中青年肾癌患者无明显差异[7]。
本文观察的20例病例,中位年龄为61岁,虽然为回顾性小样本研究,但随访观察时间长,提供了索拉菲尼长期获益患者的临床资料支持。本组观察患者中3例曾接受过低剂量IFN或IL-2辅助治疗,全组患者入组后均接受一线治疗,治疗方案为单药索拉菲尼,20例中有1例达到CR,5例达到PR,其余14例达到SD,18个月的临床获益率达到65%(13/20),中位PFS为46.1个月,随访截止至2014年12月,2例的PFS达到93个月、98个月,且至今尚未进展,目前仍在服药中,不良反应可耐受。
本研究中1例82岁高龄老年患者,出现肾癌双肺、骨转移后服用索拉菲尼,PFS达30个月,仅出现1 ~ 2级的手足皮肤反应和腹泻,在服药2个月后逐渐缓解。Strumberg等[5]报道索拉菲尼标准剂量治疗晚期肾癌出现明显皮肤反应和腹泻反应的患者疗效可能更佳,皮肤和腹泻不良反应严重者有效时间更长。这种不良反应与疗效相关现象在其他靶向药物中也有出现。Kollmannsberger等[14]认为,疲乏是舒尼替尼治疗晚期肾癌PFS与OS的独立预测因子。多项国内外研究均显示高血压与贝伐单抗、索拉菲尼、舒尼替尼等药物的疗效相关,然而关于不良反应对索拉菲尼等靶向药物的疗效预测作用仍然存在争议[15-18]。索拉菲尼的不良反应具有多样性,这与其多靶点作用机制相关。本组患者中出现的最主要不良反应是手足皮肤反应,发生率为80%,但多为1 ~ 2级,仅1例为3级,剂量减半2个月后逐渐消失,预防性外用药物可一定程度减缓其发生;此外腹泻和皮疹的发生率分别为65%和55%,但均为1 ~ 2级不良反应,可以通过控制饮食得以缓解。皮疹的发生与剂量相关,减少剂量通常可以消退,一般不需停药。本组患者大多数参加了中华慈善总会索拉菲尼慈善赠药项目,患者经济方面压力较小,依从性较好。
综上所述,索拉菲尼多靶点治疗中老年转移性肾癌安全有效,显著延长无进展生存期,临床获益率高,长期用药耐受性好,是中老年晚期肾癌患者的理想选择。
1 Adamy A, Chong KT, Chade D, et al. Clinical characteristics and outcomes of patients with recurrence 5 years after nephrectomy for localized renal cell carcinoma[J]. J Urol, 2011, 185(2): 433-438.
2 Cohen HT, McGovern FJ. Renal-cell carcinoma[J]. N Engl J Med, 2005, 353(23):2477-2490.
3 Bellmunt J, Montagut C, Albiol S, et al. Present strategies in the treatment of metastatic renal cell carcinoma: an update on molecular targeting agents[J]. BJU Int, 2007, 99(2): 274-280.
4 Wilhelm S, Chien DS. BAY 43-9006: preclinical data[J]. Curr Pharm Des, 2002, 8(25):2255-2257.
5 Strumberg D, Clark JW, Awada A, et al. Safety, pharmacokinetics,and preliminary antitumor activity of sorafenib: a review of four phase I trials in patients with advanced refractory solid tumors[J]. Oncologist, 2007, 12(4): 426-437.
6 Escudier B, Eisen T, Stadler WM, et al. Sorafenib for treatment of renal cell carcinoma: Final efficacy and safety results of the phase III treatment approaches in renal cancer global evaluation trial[J]. J Clin Oncol, 2009, 27(20): 3312-3318.
7 Knox JJ, Figlin RA, Stadler WM. et al. The Advanced Renal Cell Carcinoma Sorafenib (ARCCS) expanded access trial in North America: Safety and efficacy[J]. J Clin Oncol, 2007, 25(18S):5011.
8 Beck J, Verzoni E, Negrier S, et al. A large open-lable, noncomparative, phase III study of the multi-targeted kinase inhibitor sorafenib in European patients with advanced renal cell carcinoma[J]. European Urology Supplements, 2008, 7: 244.
9 周爱萍, 何志嵩, 于世英, 等. 索拉非尼治疗转移性肾癌的临床研究[J]. 中华泌尿外科杂志, 2009, 30(1): 10-14.
10 Akaza H, Tsukamoto T, Murai M, et al. Phase II study to investigate the efficacy, safety, and pharmacokinetics of sorafenib in Japanese patients with advanced renal cell carcinoma[J]. Jpn J Clin Oncol,2007, 37(10): 755-762.
11 Mcdermott DF, Regan MM, Clark JI, et al. Randomized phase III trial of high-dose interleukin-2 versus subcutaneous interleukin-2 and interferon in patients with metastatic renal cell carcinoma[J]. J Clin Oncol, 2005, 23(1): 133-141.
12 Stadler WM, Figlin RA, Mcdermott DF, et al. Safety and efficacy results of the advanced renal cell carcinoma sorafenib expanded access program in North America[J]. Cancer, 2010, 116(5):1272-1280.
13 张奇夫, 汪清, 付成, 等. 索拉非尼治疗老年晚期肾癌患者有效性与安全性的初步评价[J]. 中华泌尿外科杂志, 2010, 31(1): 12-14.
14 Kollmannsberger C, Bjarnason G, Burnett P, et al. Sunitinib in metastatic renal cell carcinoma: recommendations for management of noncardiovascular toxicities[J]. Oncologist, 2011, 16(5): 543-553.
15 杨帆,王德林,吴小候,等.索拉非尼治疗25例晚期肾癌的长期不良反应研究[J].重庆医科大学学报,2014,39(6):832-836.16 Ravaud A, Sire M. Arterial hypertension and clinical benefit of sunitinib, sorafenib and bevacizumab in first and second-line treatment of metastatic renal cell cancer[J]. Ann Oncol, 2009, 20(5): 966-967.
17 Rini BI, Cohen DP, Lu DR, et al. Hypertension as a biomarker of efficacy in patients with metastatic renal cell carcinoma treated with sunitinib[J]. J Natl Cancer Inst, 2011, 103(9): 763-773.
18 Bamias A, Manios E, Karadimou A, et al. The use of 24-h ambulatory blood pressure monitoring (ABPM) during the first cycle of sunitinib improves the diagnostic accuracy and management of hypertension in patients with advanced renal cancer[J]. Eur J Cancer, 2011, 47(11): 1660-1668.
Clinical observation of Sorafenib in treatment of middle aged and elderly patients with metastatic renal cell carcinoma
LINGHU Ruixia1, SI Wen2, WANG Yingzhe1, RAO Huihui1, YANG Junlan1
1Department of Medical Oncology, Chinese PLA General Hospital, Beijing, 100853, China;2Medical college of Nankai University, Tianjin 300071, China
YANG Junlan. Email: yangjunlan301@sina.cn
ObjectiveTo investigate the effect and safety of Sorafenib in treatment of middle aged and elderly patients with metastatic renal cell carcinoma.MethodsClinical efficacy of Sorafenib in 20 patients diagnosed with metastatic renal cell carcinoma in our hospital from October 2006 to April 2012 were ascertained.ResultsOf the 20 patients, 17 were male, and 3 were female, with a median age of 61 years (range from 45 to 83 years) and an average follow-up time of 40 months. CR was achieved in 1 case (5.0%), PR in 5 cases (25.0%), SD in 14 cases (70.0%), and PD in 6 cases while these cases were all dead. The objective response rate (ORR) was 30.0% (6/20), and the clinical benefit response rate (CBR) was 65.0% (13/20). The progression-free-survival (PFS) was 46.1 (95% CI: 35.8-56.4) months.ConclusionThere is a favorable efficacy for Sorafenib in treatment of middle aged and elderly patients with metastatic renal cell carcinoma.
renal carcinoma; sorafenib; progression-free survival
R 737.11
A
2095-5227(2015)12-1178-04
10.3969/j.issn.2095-5227.2015.12.005
时间:2015-09-29 10:34:48
http://www.cnki.net/kcms/detail/11.3275.R.20150929.1034.012.html
2015-05-27
令狐锐霞,女,学士,医师。Email: lhrx@foxmail.com
杨俊兰,女,主任医师,教授。Email: yangjunlan301@ sina.cn
