细胞自噬在多发性创伤大鼠肺组织内的变化
2015-03-20张桂通李海鹏李绍光孙天胜
张桂通,李海鹏,刘 佳,郝 刚,李绍光,孙天胜
1解放军医学院,北京 100853;2北京军区总医院 骨科,北京 100700
基础研究论著
细胞自噬在多发性创伤大鼠肺组织内的变化
张桂通1,2,李海鹏2,刘 佳2,郝 刚2,李绍光2,孙天胜2
1解放军医学院,北京 100853;2北京军区总医院 骨科,北京 100700
目的观察多发伤性创伤大鼠肺组织内的变化,探讨多发性创伤后急性肺损伤的相关机制。方法选取健康雌性SD大鼠56只,随机分为假手术组(只在颅骨钻孔,28只)和模型组(股骨干闭合骨折合并脑损伤,28只)。分别在术后6 h、12 h、24 h、48 h及5 d取大鼠右肺下叶组织,Real Time-PCR检测各个时间点Beclin-1和LC3-Ⅱ基因的动态表达。结果在以上各个时间点,模型组Beclin-1、LC3-Ⅱ的mRNA水平较假手术组均明显上调。术后48 h模型组Beclin-1、LC3-Ⅱ的mRNA水平(7.532±0.03,10.843±0.03)明显高于假手术组(1.063±0.10,1.091±0.11),差异有统计学意义(P<0.01)。结论自噬可能参与了股骨干骨折合并脑损伤这类严重多发伤后的急性肺损伤。
脑损伤;股骨干骨折;自噬;急性肺损伤;大鼠
股骨干骨折合并脑损伤为临床常见严重多发伤,具有较高的死亡率。急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是引发患者院内死亡的主要原因[1-3]。即便不发生死亡,由此引起的肺部并发症也会大大延长患者的住院时间并增加其经济负担。目前,严重创伤后ALI的发生机制尚不十分清楚,给临床上的针对性治疗带来很大的困扰[4]。以往的报道显示,多发性创伤后肺组织的凋亡蛋白表达量显著升高,且在肺泡上皮细胞内可以观察到凋亡小体的存在[5-6]。但是过表达抗凋亡蛋白Bcl-2或者抑制凋亡关键分子Caspase-3均未得到满意的疗效[7-9]。上述结果提示还有其他的细胞死亡方式参与了多发性创伤后的ALI。自噬是一种新近发现的细胞程序性死亡方式,一般认为其在动物发育和维持组织器官内环境稳定中发挥着重要的作用[10]。然而,越来越多的证据表明,当其调控机制出现紊乱,自噬会广泛参与到各种疾病的病理进程当中[11-12]。那么这种细胞死亡方式是否也参与到多发伤后的ALI至今未见相关报道。本研究沿用课题组一直采用的股骨干骨折合并脑损伤大鼠模型,对其肺组织的细胞自噬水平进行检测,旨在探讨这类多发伤后ALI的分子机制,为临床寻求新的治疗手段提供理论基础及实验依据。
材料和方法
1 实验动物及分组 成年雌性SD大鼠56只,体质量230 ~ 300 g(军事医学科学院动物实验中心提供)。自然光照,自由食水,适应性饲养7 d。所有动物随机分为假手术组和模型组(股骨干骨折合并脑损伤组),每组28只。
2 模型制备 假手术组大鼠在额部颅骨钻孔,保持硬脑膜完整。股骨干骨折合并脑损伤模型制备方法:参照Floyd等[13]方法,常规颅骨钻孔后,连接HPD-1700型液压打击器,以2.0 atm的强度,制备闭合性颅脑损伤模型;而后参照Einhorn等动物骨折造模法支架理念,采用自制的骨折打击器,制备闭合性股骨干骨折模型[14]。
3 实时荧光定量PCR检测肺组织LC3-Ⅱ和Beclin-1 mRNA的表达 两组大鼠分别于术后6 h、12 h、24 h、48 h及5 d取大鼠左肺下叶组织100 mg,按Trizol法提取总RNA,逆转录合成cDNA。以GAPDH作为内参,其引物片段:上游引物5’-CCCCCATGTTTGTGATG-3’,下游引物5’-GTGGTCATGAGCCCTTCCA-3’。检测的目的基因Beclin-1引物序列:上游引物5’-CCGGAGACTCAAGGTCACTGA-3’,下游引物5’-AGCTCATCATCCAGCTCCAG-3’;LC3-Ⅱ上游引物5’-CGGAGCTTCGAACAAAGAGT-3’,下游引物5’-CCATTCACCAGGAGGAAGAA-3’。PCR扩增采用50μl的反应体系,加入cDNA模板5μl,ddH2O 32μl,PCR buffer(5×)10 μl,荧光探针0.5μl,Taq DNA聚合酶1μl,dNTPs 0.5μl,Beclin-1及LC3-Ⅱ上下游引物各0.5μl。扩增条件:1)95℃ 30 s;2)95℃ 5 s,60℃ 1 min 10 Cycles;3)95℃ 5 s,60℃ 30 s,35 Cycles。扩增产物分析:数据采用仪器自带软件ABIPrism 7300 SDS Software分析。Beclin-1和LC3-ⅡmRNA表达水平以它们与GAPDH的相对表达量表示。
4 透射电子显微镜观测细胞内自噬体 新鲜薄片肺组织经2%戊二醛和1%锇酸先后固定,丙酮浓度梯度脱水,再经环氧树脂包埋,制成超薄切片,最后经醋酸双氧铀和枸橼酸铅双重染色各10 min。标本制备完毕在电子显微镜下观察拍照。
结 果
1 股骨干骨折合并脑损伤诱导肺组织的自噬水平升高 与假手术组比较,模型组大鼠各个时间右肺组织中自噬标记物LC3-Ⅱ及Beclin-1 mRNA水平均有升高,48 h达到高峰,5 d后仍高于假手术组(表1)。
2 股骨干合并脑损伤后肺组织内自噬小体增多透射电子显微镜显示,与假手术组比较,模型组大鼠肺部于48 h更易发现自噬小体,主要位于Ⅰ型肺泡上皮细胞和血管内皮细胞内(图1 ~ 图4)。
表1 创伤后各时间点mRNA和LC3-ⅡmRNA的表达Tab. 1 Expression of Beclin-1 mRNA and LC3-ⅡmRNAat different time points after trauma ()
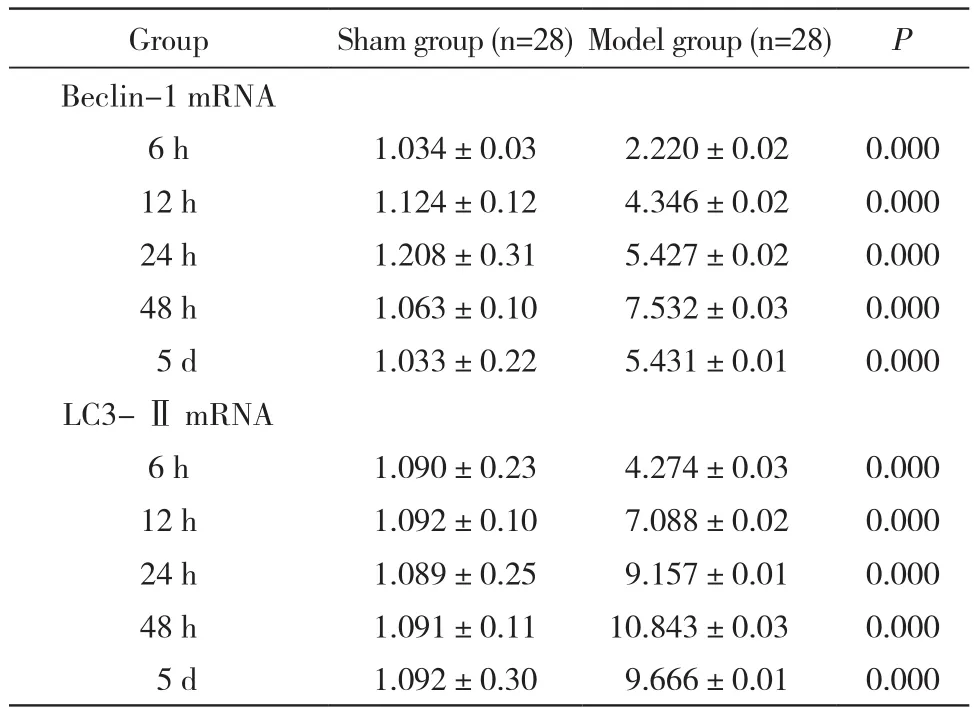
表1 创伤后各时间点mRNA和LC3-ⅡmRNA的表达Tab. 1 Expression of Beclin-1 mRNA and LC3-ⅡmRNAat different time points after trauma ()
GroupSham group (n=28)Model group (n=28)P Beclin-1 mRNA 6 h1.034±0.032.220±0.020.000 12 h1.124±0.124.346±0.020.000 24 h1.208±0.315.427±0.020.000 48 h1.063±0.107.532±0.030.000 5 d1.033±0.225.431±0.010.000 LC3-ⅡmRNA 6 h1.090±0.234.274±0.030.000 12 h1.092±0.107.088±0.020.000 24 h1.089±0.259.157±0.010.000 48 h1.091±0.1110.843±0.030.000 5 d1.092±0.309.666±0.010.000

图 1 假手术组肺泡上皮细胞Fig. 1 Alveolar epithelial cell of rats in sham group
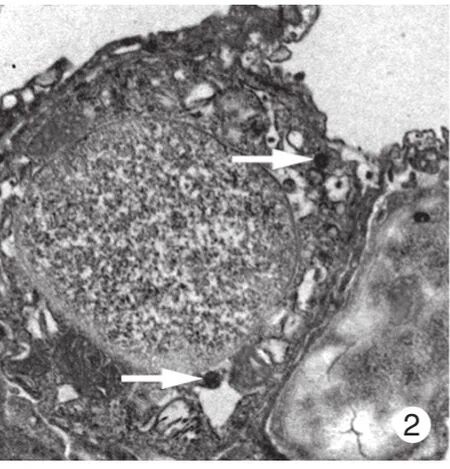
图 2 模型组肺泡上皮细胞中的自噬小体Fig. 2 Alveolar epithelial cell of autophagosome of rats in model group
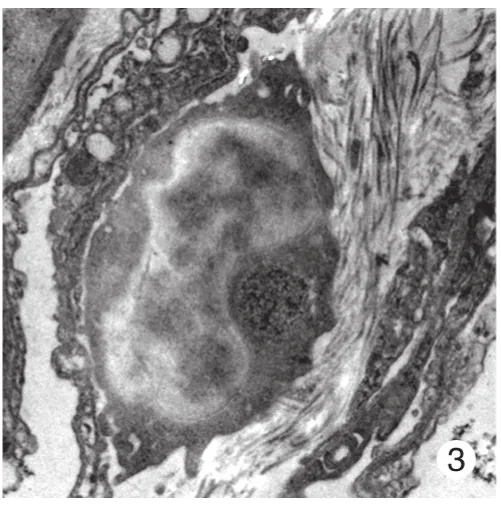
图 3 假手术组血管内皮细胞Fig. 3 Vascular endothelial cell of rats in sham group
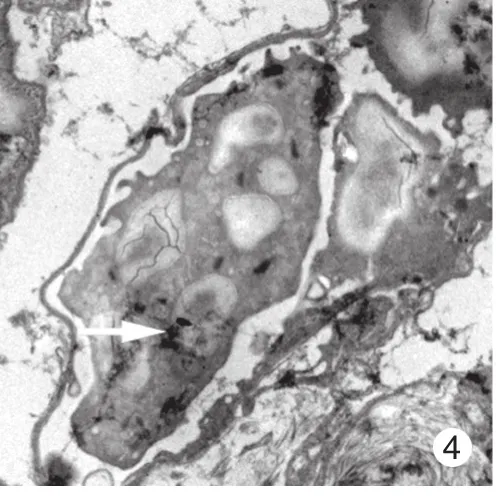
图 4 模型组血管内皮细胞中的自噬小体Fig. 4 Vascular endothelial cell of autophagosome of rats in sham group
讨 论
作为细胞程序性死亡的一种重要形式,细胞自噬近年来在各组织器官损伤领域受到广泛关注。截至目前,学者们已在特发性肺纤维化、慢性阻塞性肺病等肺部疾病中证实了细胞自噬水平的改变[15]。但是自噬是否参与多发性创伤后的ALI,至今未见相关报道。本研究首次证实了股骨干骨折合并脑损伤这类多发性创伤可以诱导肺局部自噬标志性分子mRNA表达的上调,同时发现Ⅰ型肺泡上皮细胞内自噬小体数量的增多。以上证据提示自噬可能参与了股骨干骨折合并脑损伤这类多发伤后ALI的病理生理过程。
在既往的研究中,ALI期间肺泡上皮细胞的大量丢失已经得到证实,而且其丢失程度与患者的临床表现密切相关[16-17]。关于肺泡上皮细胞死亡的机制尚存在争议。根据现有的证据,凋亡无疑是导致ALI时肺上皮细胞数量减少的重要原因[6]。本研究小组在前期的研究中也在股骨干骨折合并脑损伤大鼠模型的肺上皮细胞发现了凋亡小体的大量存在。但是针对凋亡的治疗效果并不尽如人意,抗凋亡蛋白Bcl-2的过度表达或者凋亡关键分子Caspase-3的基因沉默均未得到满意的疗效,这提示我们,还有其他细胞死亡机制参与了多发性创伤后ALI的病理进程。
本研究中首次证实了股骨干骨折合并脑损伤这类多发伤可以导致肺部自噬水平的提高,但是导致肺泡上皮细胞发生自噬的原因需要更加深入的探讨。本课题小组在之前的实验中发现,上述模型的肺部存在大量浸润的中性粒细胞及激活的巨噬细胞,同时炎症介质浓度也显著高于假手术组(数据中未显示)。根据现有的证据,这些炎症介质可以诱导细胞的凋亡,这可能是ALI期间肺泡上皮细胞发生凋亡的原因之一。此外,中性粒细胞大量蓄积会产生高浓度的活性氧,而活性氧与细胞自噬的激活密切相关[18]。深入揭示多发伤后ALI过程中细胞凋亡与自噬,及二者与炎症反应之间的关系,有助于解释ALI的病理生理机制。
总之,本实验中发现的肺泡上皮细胞自噬水平的升高可能是由过度蓄积的炎症细胞诱导,也可能同时存在其他诱因,有待进一步深入探讨。同时,自噬在后ALI病理进程中的作用同样需要进一步实验的证实。本实验小组将针对上述问题继续开展一系列的动物实验,以期为严重多发伤后ALI的临床治疗提供有力的理论基础及实验依据。
1 Mutlu GM, Budinger GR. Incidence and outcomes of acute lung injury[J]. N Engl J Med, 2006, 354(4):416-417.
2 Rincon F, Ghosh S, Dey S, et al. Impact of acute lung injury and acute respiratory distress syndrome after traumatic brain injury in the United States[J]. Neurosurgery, 2012, 71(4): 795-803.
3 李新甫,汪建新.内毒素与急性肺损伤[J].军医进修学院学报,2005,26(6):484-485.
4 刘庆辉, 孙宝君, 安莉, 等. 盐酸氨溴索对成年大鼠高氧肺损伤的影响[J]. 军医进修学院学报, 2011, 32(11): 1144-1146.
5 黄炎,宋耀宗,张建政.股骨干骨折合并脑损伤对大鼠肺泡Ⅱ型上皮细胞超微结构的影响[J].解放军医药杂志,2013,25(5):21-24.
6 Bardales RH, Xie SS, Schaefer RF, et al. Apoptosis is a major pathway responsible for the resolution of type II pneumocytes in acute lung injury[J]. Am J Pathol, 1996, 149(3): 845-852.
7 Perl M, Chung CS, Perl U, et al. Therapeutic accessibility of caspase-mediated cell death as a key pathomechanism in indirect acute lung injury[J]. Crit Care Med, 2010, 38(4): 1179-1186.
8 Zanetti F, Giacomello M, Donati Y, et al. Nicotine mediates oxidative stress and apoptosis through cross talk between NOX1 and Bcl-2 in lung epithelial cells[J]. Free Radic Biol Med, 2014, 76: 173-184.
9 Métrailler-Ruchonnet I, Pagano A, Carnesecchi S, et al. Bcl-2 overexpression in type II epithelial cells does not prevent hyperoxiainduced acute lung injury in mice[J]. Am J Physiol Lung Cell Mol Physiol, 2010, 299(3): L312-L322.
10 Hale AN, Ledbetter DJ, Gawriluk TR, et al. Autophagy: regulation and role in development[J]. Autophagy, 2013, 9(7): 951-972.
11 Kirshenbaum LA. Regulation of autophagy in the heart in health and disease[J]. J Cardiovasc Pharmacol, 2012, 60(2): 109.
12 Sandri M. Autophagy in health and disease. 3. Involvement of autophagy in muscle atrophy[J]. Am J Physiol Cell Physiol, 2010,298(6): C1291-C1297.
13 Floyd CL, Golden KM, Black RT, et al. Craniectomy position affects morris water maze performance and hippocampal cell loss after parasagittal fluid percussion[J]. J Neurotrauma, 2002, 19(3):303-316.
14 Shefelbine SJ, Simon U, Claes L, et al. Prediction of fracture callus mechanical properties using micro-CT images and voxel-based finite element analysis[J]. Bone, 2005, 36(3): 480-488.
15 Araya J, Hara H, Kuwano K. Autophagy in the pathogenesis of pulmonary disease[J]. Intern Med, 2013, 52(20): 2295-2303.
16 Baker CS, Evans TW, Randle BJ, et al. Damage to surfactantspecific protein in acute respiratory distress syndrome[J]. Lancet,1999, 353(9160): 1232-1237.
17 Ware LB, Matthay MA. Alveolar fluid clearance is impaired in the majority of patients with acute lung injury and the acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2001, 163(6):1376-1383.
18 Scherz-Shouval R, Shvets E, Fass E, et al. Reactive Oxygen species are essential for autophagy and specifically regulate the activity of Atg4[J]. EMBO J, 2007, 26(7): 1749-1760.
Autophagic changes in lung tissues of rats with multiple trauma
ZHANG Guitong1,2, LI Haipeng2, LIU Jia2, HAO Gang2, LI Shaoguang2, SUN Tiansheng2
1Chinese PLA Medical School, Beijing 100853, China;2Department of Orthopedics, Beijing Army General Hospital, Beijing 100700, China
SUN Tiansheng. Email: suntiansheng-@163.com
ObjectiveTo investigate the changes of autophagy in lung tissues of rats with mutiple trauma.MethodsFifty-six Sprague-Dawley (SD) rats were randomly divided into sham group (n=28) and model group (n=28). The lower lobe of right lung were taken and the expressions of Beclin-1 and LC3-Ⅱ mRNA in lung tissues of rats were measured by real-time fluorescent polymerase chain reaction (PCR) at 6 h, 12 h, 24 h, 48 h and 5 d after trauma.ResultsCompared with the sham group, the expressions of LC3-Ⅱand Beclin-1 mRNA in model group increased significantly at different time points. Beclin-1 and LC3-Ⅱ of model group increased significantly than sham group at 48 hours after operation [(7.532±0.03) vs (1.063±0.10), (10.843±0.03) vs (1.091±0.11), P<0. 01].ConclusionAutophagy may be involved in multiple trauma of acute lung injury, like femoral shaft fracture combined with brain injury.
brain injury; femoral shaft fracture; autophagy; acute lung injury; rats
R 563.9
A
2095-5227(2015)12-1211-03
10.3969/j.issn.2095-5227.2015.12.014
时间:2015-10-12 10:10:15
http://www.cnki.net/kcms/detail/11.3275.R.20151012.1010.002.html
2015-07-10
国际科技合作项目(2010DFA31250)
Supported by the International Technical Cooperation and Communication Project (2010FDA31250)
张桂通,男,硕士,医师。研究方向:脊柱脊髓损伤。Email: zhanggt116114@163.com
孙天胜,男,博士,主任医师,教授。Email: suntiansh eng-@163.com
