人颗粒酶A 活性段的表达、纯化及其活性鉴定①
2015-03-18胡雪菲江文正华东师范大学生命科学学院上海200241
胡雪菲 江文正 (华东师范大学 生命科学学院 上海 200241)
颗粒酶A(Granzyme A,GzmA)是一种存在于细胞毒性T 淋巴细胞(Cytotoxic T lymphocyte,CTL)及自然杀伤细胞(Natural killer,NK)中的丝氨酸蛋白酶[1]。GzmA 主要诱导一种caspases 非依赖性的细胞凋亡,它通过颗粒的胞吐作用释放,在穿孔素(Perforin)协同作用下进入靶细胞的细胞浆中,并聚集在细胞核[2-4],通过裂解SET 复合物释放的脱氧核糖核酸酶NM23-H1 对染色体DNA 形成单股DNA链切(缺)口而引起DNA 断裂,最终引起靶细胞的凋亡[5]。近来的一项研究发现,在一些健康捐助者的血清中检测到了颗粒酶A 的存在,而当炎症发生时,在血清和其他体液中可检测到更高水平的颗粒酶A[6],说明颗粒酶A 除了具有细胞毒性功能外,还可能在细胞外发挥促进炎症和降解细胞外基质的功能,从而允许细胞毒性细胞接近组织内的靶细胞,但具体机制还有待进一步研究。本研究以含GzmA全长基因的质粒为模板,PCR 扩增aGzmA 基因,构建重组表达质粒,并在大肠杆菌表达系统中进行表达和表达条件的优化,以期获得有活性的人颗粒酶A 重组蛋白,为进一步研究其功能和机制奠定基础。
1 材料与方法
1.1 质粒与菌株 含全长人GzmA 基因的重组质粒pET24a-GzmA 由本实验室构建[7]。原核表达载体pET24a(+)、E.coli DH5α、E.coli BL21(DE3)均为本实验室保存。
1.2 主要试剂 限制性内切酶NdeⅠ、XhoⅠ、T4 DNA 连接酶和PCR 试剂盒购自TaKaRa 公司;IPTG和DNA 胶回收试剂盒购自北京鼎国生物技术公司;DNA marker、蛋白质marker 和小鼠抗His 单克隆抗体购自天根生化科技(北京)有限公司;HRP 标记的兔抗小鼠IgG 二抗购自Sigma 公司;ECL Western Blotting Substrate Kit 购自Thermo Scientific 公司。N-alpha-benzyloxycarbonyl-L-lysine thiobenzyl ester (BLT)为CALBIOCHEM 公司产品。
1.3 引物设计及合成 根据GenBank 中GzmA 全长序列(CR456968.1)设计人活性颗粒酶A 上下游引物,并引入相应的限制性核酸内切酶酶切位点,上游引物序列为:5'-GGAATTCCATATGATTATTGGAGGAAATGAAG-3'(下划线部分为NedⅠ酶切位点,85-103);下游引物序列为:5'-CGCTCGAGAACTGCTCCCTTGATAGT-3'(下划线部分为XhoⅠ酶切位点,769-786),扩增片段大小约为700 bp。引物由生工生物工程(上海)有限公司合成。
1.4 人aGzmA 基因的扩增 以含全长人GzmA 基因的质粒pET24a-GzmA 为模板扩增aGzmA 基因,PCR 反应条件为94℃2 min;94℃45 s,58℃30 s,72℃1 min,共35 个循环;72℃再延伸10 min。PCR产物经0.5%琼脂糖凝胶电泳分析并回收。
1.5 重组表达质粒的构建 将PCR 产物用NdeⅠ和XhoⅠ于37℃双酶切3~8 h,回收酶切产物,与经同样酶切处理的载体质粒pET24a(+)在T4 DNA连接酶作用下16℃连接过夜。将连接产物转化大肠杆菌DH5α 感受态菌后,涂平板培养。待菌落长出后,挑取单个菌落,扩大培养后提取质粒,双酶切鉴定。挑选阳性重组子送上海生物工程有限公司测序,测序正确的质粒命名为pET24a-aGzmA。
1.6 目的基因的诱导表达和SDS-PAGE 分析 将测序正确的重组质粒pET24a-aGzmA 转化大肠杆菌BL21(DE3)感受态,挑取单菌落接种至含100 μg/ml 卡那霉素的LB 培养基中,37℃,220 r/min 摇床摇菌过夜,次日按1%转接至含卡那霉素的LB 培养基中,继续培养2~3 h,至OD600达0.4~1.0 时,加入诱导剂硫代半乳糖苷(IPTG)至终浓度1 mmol/L,37℃诱导培养4 h。离心搜集菌体,加入蛋白上样缓冲液,煮沸10 min 后上样进行SDS-PAGE 分析。以未诱导的重组菌、诱导的空载体转化菌BL21/pET24a(+)和诱导的空白菌BL21 作为对照。
1.7 表达产物的Western blot 鉴定 表达产物经SDS-PAGE 分离后转移至NC 膜上,以含5%脱脂奶粉的TBST 常温封闭1~2 h;加入小鼠抗His 单克隆抗体(1∶2 000 稀释),4℃孵育过夜;再加入HRP标记的兔抗小鼠IgG(用5%脱脂奶粉1∶5 000 稀释),常温作用1 h;洗涤后,用ECL Western blot Substrate Kit 显影。以未诱导的重组菌、诱导的空载体转化菌BL21/pET24a(+)和诱导的空白菌BL21作为对照。
1.8 重组蛋白表达条件的优化 对诱导温度(37℃、30℃、25℃)、IPTG 浓度(0.2、0.4、0.6、0.8、1.0、1.2、1.5、2.0 mmol/L)、诱导时间(2、4、6、8、10 h)和开始诱导时菌液浓度(OD600=0.2、0.4、0.6、0.8、1.0、1.2、2.0)进行优化,改变待优化的条件时,其他条件固定。表达产物经SDS-PAGE 电泳后利用软件分析目的蛋白的相对表达量。
1.9 重组蛋白的纯化 收集100 ml 经IPTG 于37℃诱导4 h 的BL21/pET24a-aGzmA 菌液,离心收集菌体,用PBS 重悬,然后置于超声波破碎仪中进行超声破碎;破碎后,于4℃,12 000 r/min,离心15 min,收集的沉淀,用含8 mol/L 尿素的binding buffer溶液重悬,使包涵体中的蛋白溶解在尿素溶液中,离心收集获得的上清,0.45 μm 滤膜过滤。将过滤后的溶液通过预处理好的镍柱进行亲和层析纯化,然后用binding buffer 和washing buffer 洗去未结合的杂质,最后用含高浓度咪唑的elute buffer 使亲和力减弱,从而将人活性颗粒酶A 重组蛋白洗脱下来。洗脱液经透析后超滤浓缩,该浓缩液中即含有重组人活性颗粒酶A 蛋白。
1.10 重组蛋白的活性检测 按文献[8]介绍的方法进行。即将500 μl 20 mmol/L BLT 贮存液、500 μl 20 mmol/L DTNB 贮存液、500 μl Triton X-100 和48.5 ml PBS 混合制备BLT 底物溶液。在96 孔板每孔中加入200 μl 底物溶液,再加入20 μl 目的蛋白,并设置PBS、透析液作为空白对照和阴性对照,37℃放置20 min,用酶标仪测定其在412 nm 处的紫外光吸光度。
2 结果
2.1 人aGzmA 基因PCR 扩增结果 人aGzmA 基因PCR 扩增产物经琼脂糖凝胶电泳分析,可见约700 bp 的特异DNA 片段,大小与预期相符,其电泳结果见图1。
2.2 重组表达质粒的鉴定 将aGzmA 基因和载体质粒pET24a(+)的双酶切产物连接并转化后,从平板上挑选生长良好的菌落,抽提质粒并用NdeⅠ和XhoⅠ进行双酶切鉴定,其酶切图谱见图2。从图2可以看出,阳性重组质粒酶切后呈现两条带,包含约700 bp 目的基因片段,表明目的基因已插入载体质粒中。经测序分析证明该基因序列与GenBank 中登录的序列一致。
2.3 表达产物SDS-PAGE 分析 重组菌BL21/pET24a-aGzmA 的诱导表达产物经SDS-PAGE 分析,结果如图3 所示,重组菌经IPGT 诱导后在相对分子质量约26 kD 处有一特异蛋白条带,而未经诱导的重组菌、诱导的空载体转化菌BL21/pET24a、诱导的空白菌BL21 均未见此条带。
2.4 表达产物的Western blot 分析 表达产物经SDS-PAGE 分离后转膜,分别与小鼠抗His 单克隆抗体和HRP 标记的兔抗小鼠IgG 二抗反应,在相对分子质量约26 kD 处可见特异性显色条带,而未诱导的重组菌、诱导的空载体转化菌和诱导的空白菌均未见特异性显色带(图4)。
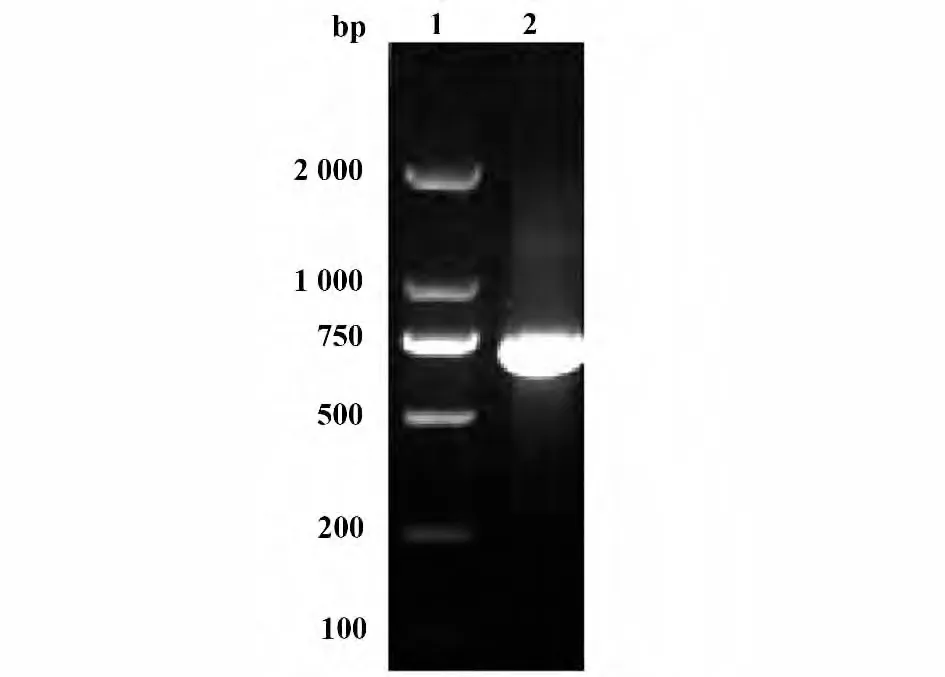
图1 人aGzmA 基因PCR 产物电泳图Fig.1 Electrophoresis profile of PCR products of human aGzmA

图2 重组质粒pET24a-aGzmA 酶切鉴定图谱Fig.2 Enzyme-digestion profile of recombinant plasmid pET24a-aGzmA
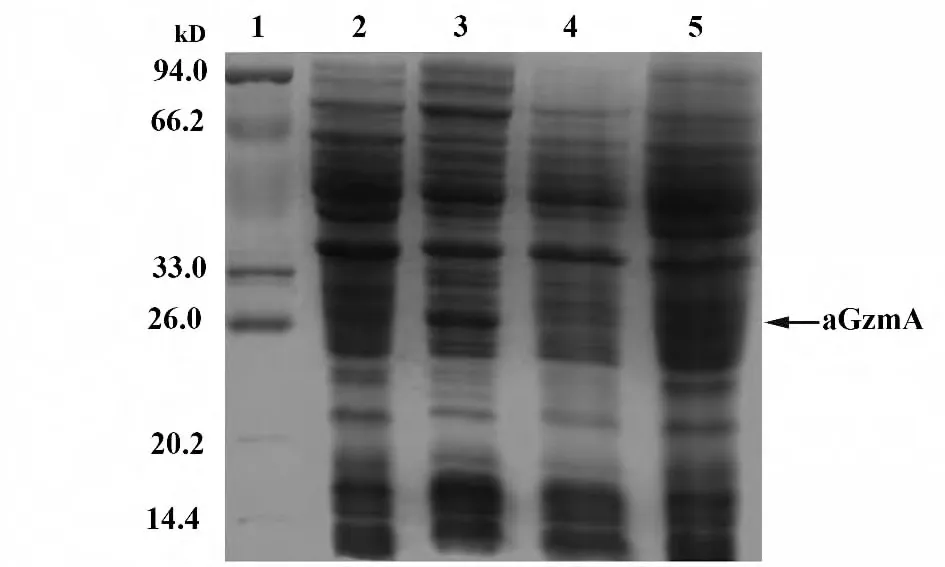
图3 表达产物的SDS-PAGE 分析结果Fig.3 SDS-PAGE analysis of expressed product

图4 表达产物的Western blot 分析结果Fig.4 Western blot analysis of expressed product
2.5 重组蛋白表达条件的优化 将相同条件下接种的菌液分别在25℃、30℃、37℃条件下培养,其他条件严格保持一致,结果发现温度对重组菌株表达目的基因有明显影响,在25℃诱导时表达量较低,37℃条件下诱导表达量最高。当菌液OD600值分别为0.2、0.4、0.6、0.8、1.0、1.2、2.0 时,加入IPTG 于37℃诱导表达,不同OD600值的菌液经IPTG 诱导后,OD600值为0.2 时即有目的蛋白的表达,而在OD600值超过2.0 时目的蛋白不表达,但在OD600值为0.2~2.0 之间,蛋白表达量随OD600值变化不明显。在37℃条件下,分别加入IPTG 至终浓度分别为0.2、0.4、0.6、0.8、1.0、1.2、1.5、2.0 mmol/L 诱导表达,不同浓度IPTG 诱导后差别不大。加入相同浓度的IPTG,分别诱导2、4、6、8、10 h,SDS-PAGE 结果显示,工程菌用IPTG 诱导2 h 即可看到有目的蛋白的表达,但随着时间的延长,表达量并无明显增加。
2.6 重组蛋白的纯化 超声破碎菌体后,分别收集上清和沉淀,取一定量的上清和沉淀进行SDSPAGE 分析,目的蛋白主要位于沉淀中(图略),表明重组蛋白主要以包涵体形式存在。将包涵体变性后利用镍层析柱进行分离纯化,其结果见图5,其纯度可达90%以上,表明利用镍柱亲和层析法可得到纯度较高的目的蛋白。
2.7 重组蛋白的活性检测结果 见图6。将重组蛋白作用于BLT 底物溶液后用酶标仪测定其在412 nm 处的紫外光吸光度值,与对照组透析液(mock)相比,重组蛋白具有明显的酶解BLT 底物溶液的活性,表明该重组蛋白具有较好的生物学活性,可用于其功能的研究。

图5 纯化蛋白的SDS-PAGGE 结果Fig.5 SDS-PAGE analysis of purified protein

图6 重组蛋白aGzmA 活性的检测结果Fig.6 Activity assay of recombinant protein aGzmA
3 讨论
颗粒酶A 在杀伤肿瘤细胞、病毒感染细胞及异体移植物的排异反应中具有重要意义[9-11]。最近有研究关注颗粒酶A 的促炎症作用[12,13],但颗粒酶A如何激活炎症因子的产生,其分子机制有待于进一步研究阐明。为了获得人颗粒酶A 重组蛋白以开展其相关生物学功能的研究,本研究利用PCR 从GzmA 全长基因中扩增得到人颗粒酶A 基因活性段,插入到原核表达载体pET24a(+)的NdeⅠ和XhoⅠ酶切位点之中构建重组质粒pET24a-aGzmA,并在大肠杆菌BL21(DE3)中表达了该重组蛋白。SDS-PAGE 结果及Western blot 分析显示,该重组蛋白大小约为26 kD,可以与小鼠抗His 单克隆抗体发生特异性结合,表明人活性颗粒酶A 成功地进行了表达,且其分子量与预期相符。为了使该蛋白在工程菌中大量表达,获得最佳表达条件,本研究从诱导时间、诱导温度、开始诱导时菌液浓度、诱导剂浓度4 个方面进行表达条件的优化,结果显示,工程菌对温度敏感,在37℃时能较好地表达人aGzmA 蛋白。工程菌在OD600值为0.2~2.0 之间,用IPTG 诱导2 h 后即可表达aGzmA,而IPTG 的浓度对重组蛋白的表达影响不大。将表达菌超声破碎后分别取上清和沉淀进行SDS-PAGE 分析,结果显示重组蛋白主要在沉淀中,表明该重组蛋白主要以包涵体形式存在。为了获得具有生物学活性的重组蛋白,需要对表达蛋白进行变性和复性处理。本研究中利用尿素溶解包涵体,从而可以利用亲和层析进行纯化。为了便于纯化蛋白,本研究将人活性颗粒酶A 基因与6 个His 共同表达,从而可以利用His 标签与镍柱结合的特性进行目的蛋白的分离和纯化,蛋白纯化的结果表明可以获得高纯度的目的蛋白。颗粒酶A 为丝氨酸蛋白酶,对多种底物具有水解活性。为了检测所制备的人颗粒酶A 重组蛋白是否具有酶解活性,我们利用了BLT 底物溶液进行了活性检测,结果显示该重组蛋白具有较好的生物学活性。Kummer 等[14]曾报道的人颗粒酶A 重组蛋白需要用组织蛋白酶C 处理后才能具有酶水解活性,而本研究中制备的重组蛋白为人颗粒酶A 活性段,去除了N 末端28 个氨基酸,该重组蛋白不用任何处理即具有酶水解活性,从而可以降低其制备成本。本研究结果为进一步开展其促炎作用等相关生物学功能的研究奠定了前期基础。
[1]Chowdhury D,Lieberman J.Death by a thousand cuts:granzyme pathways of programmed cell death [J].Annu Rev Immunol,2008,26:389-420.
[2]Martinvalet D,Dykxhoorn DM,Ferrini R,et al.Granzyme A cleaves a mitochondrial complex I protein to initiate caspase-independent cell death[J].Cell,2008,133(4):681-692.
[3]Zhu P,Martinvalet P,Chowdhury D,et al.The cytotoxic T lymphocyte protease granzyme A cleaves and inactivates poly(adeno-sine 5'-diphosphate-ribose)polymerase-1[J].Blood,2009,114(6):1205-1216.
[4]Martinvalet D,Zhu P,Lieberman J.Granzyme A induces caspaseindependent mitochondrial damage,a required first step for apoptosis[J].Immunity,2005,22(3):355-370.
[5]Fan Z,Beresford PJ,Oh DY,et al.Tumor suppressor NM23-H1 is a Granzyme A-activated DNase during CTL-mediated apoptosis,and the nucleosome assembly protein SET is its inhibitor[J].Cell,2003,112:659-672.
[6]Tak PP,Spaeny-Dekking L,Kraan MC,et al.The levels of soluble granzyme A and B are elevated in plasma and synovial fluid of patients with rheumatoid arthritis (RA)[J].Clin Exp Immunol,1999,116:366-370.
[7]杜佳妮,陈 磊,龙凤英,等.人颗粒酶A 全长基因的克隆与原核表达[J].中国生物制品学杂志,2012,25(2):68-70.
[8]Kuwano K,Arai S.Involvement of two distinct killing mechanisms in bystander target cell lysis induced by a cytotoxic T lymphocyte clone[J].Cell Immunol,1996,169(2):288-293.
[9]Mielczarek-Palacz A,Sikora J,Kondera-Anasz Z,et al.Cytotoxic reaction mediators:granzymes A and B in women with ovarian cancer[J].Tissue Antigens,2014,83(6):409-413.
[10]Bem RA,van Woensel JB,Lutter R,et al.Granzyme A-and Bcluster deficiency delays acute lung injury in pneumovirus-infected mice[J].J Immunol,2010,184(2):931-938.
[11]Hoves S,Sutton VR,Haynes NM,et al.A critical role for granzymes in antigen cross-presentation through regulating phagocytosis of killed tumor cells[J].J Immunol,2011,187(3):1166-1175.
[12]Metkar SS,Menaa C,Pardo J,et al.Human and mouse granzyme A induce a proinflammatory cytokine response[J].Immunity,2008,29:720-733.
[13]Yoshikawa Y,Hirayasu H,Tsuzuki S,et al.Granzyme A and thrombin differentially promote the release of interleukin-8 from alveolar epithelial A549 cells[J].Cytotechnology,2010,62(4):325-332
[14]Kummer JA,Kamp AM,Citarella F,et al.Expression of human recombinant granzyme A zymogen and its activation by the cysteine proteinase cathepsin C[J].J Biol Chem,1996,271(16):9281-9286.
