人参皂苷Rh2 抑制肝癌HepG2 细胞迁移的实验研究
2015-03-18冯子强左国伟石庆强赵绿翠游智梅李丹阳陈地龙
冯子强 左国伟 石庆强 赵绿翠 罗 念 游智梅 夏 菁 李丹阳 李 静 陈地龙
(重庆医科大学组织学与胚胎学教研室,干细胞与组织工程研究室,重庆 400016)
肝癌是我国常见的恶性肿瘤,同时也是世界范围内的一种严重危害人类生命的多发性恶性肿瘤[1,2]。原发性肝细胞肝癌(Hepatocellular carcinoma,HCC)早期易于发生浸润和转移,浸润和转移是肝癌细胞重要的生物学行为。HCC 易发生肝内转移,是制约临床治疗效果的重要因素,且预后不佳[3]。
基质金属蛋白酶(MMP)家族通过降解细胞外基质,破坏组织的正常结构,从而有利于肿瘤细胞的迁移、浸润、转移。而组织金属蛋白酶抑制剂(TIMP)能特异性结合MMP,并将其降解,起到抗肿瘤转移的作用[4]。
人参皂苷Rh2 (Ginsenoside Rh2)是从人参中提取的天然活性成分,分子式为C36H62O8H2O,分子质量622,化学名为20(S)-人参二醇-3-氧-β-D-吡喃葡萄糖苷,以往研究已经证实了它能在多个环节上抑制多种肿瘤细胞的增殖、促进肿瘤细胞凋亡等[5,6]。据Tang 报道[7],人参皂苷Rh2 也能抑制肿瘤侵袭及转移的发生,但其作用机制及其作用机理尚不完全清楚,为进一步探讨人参皂苷抗肿瘤侵袭及转移发生的机理我们作了如下研究。
1 材料与方法
1.1 材料 人参皂苷Rh2 购于标准物质网,纯度99%;DMEM-F12 培养基、胎牛血清、0.25%胰酶购于HyClone 公司;DMSO 购于Merk 公司;96 孔板购于BIOFIL 公司;BCA 蛋白浓度测定试剂盒(增强型)、BeyoECL Puls(超敏ECL 化学发光试剂盒)购于Sigma 公司,0.45 μm PDVF 膜购于Millipore 公司;CCK-8 细胞增殖毒性检测试剂盒购于DOJINDO研究所,荧光素报告基因[(pGR-luc),(pAP1-luc),(pMYC-luc),(pTCF/LEF-luc),(pRBP/JK-luc),(pSTAT-luc),(pHIF-luc),(pE2F/DP1-luc),(pSMAD-luc),(pNFAT-luc)]由重庆医科大学检验医学系左国伟教授提供,脂质体购于TaKaRa 公司,荧光素酶购于TaKaRa 公司,小鼠抗人Beta-actin 购于北京中衫金桥公司,兔抗人P-ERK、P-P38、P-JUK、ERK、P-38、JUK、AP1、MMP3 购于美国Cell Signaling Technology 公司。
1.2 方法
1.2.1 细胞培养 HepG2 细胞为本实验室冻存,以1 ×107ml-1接种于含10%胎牛血清的DMEM-F12培养液中,在37℃、5%CO2饱和湿度下常规培养,每2~3 d 传代一次。
20 mg Rh2 溶于1 ml DMSO 配制成160 mmol/L的储存液,-20℃保存,实验时用含10%胎牛血清的DMEM-F12 稀释至相应浓度(DMSO 终体积分数不超过0.1%)。
1.2.2 CCK-8 法检测细胞增殖活性 取对数生长期的HepG2 细胞,以1 ×104/孔的密度接种于96 孔板中,24 h 后药物组分别加入不同浓度的Rh2(10~160 μmol/L);空白组只加入最大剂量0.1%DMSO的DMEM-F12 培养液,对照组加入含等量细胞的DMEM-F12 培养液。每浓度组设6 个复孔。分别培养24、48、72 h 后,每孔加入20 μl 的CCK-8 液体,放回孵箱,孵育3 h,用酶标仪在450nm 波长检测每孔的吸光度(A)值,计算药物对HepG2 细胞的抑制率,抑制率(IR%)=[1-药物组(A)]/对照组(A)×100%,实验重复3 次,筛选出Rh2 最适作用时间和浓度。
1.2.3 用Transwell 检测细胞迁移 取对数生长期HepG2 细胞,Rh2(80 μmol/L)处理24 h,以1 ×104个接种于上室,下室含有10%胎牛血清的DMEMF12,孵育24 h,4%多聚甲醛固定30 min,结晶紫染色30 min,采集图片。
1.2.4 用荧光报告基因检测信号通路 取对数生长期HepG2 细胞,以1 ×106ml-1的密度接种于6 孔板中,待细胞贴壁后,用无血清的DMEM-F12 培养基洗3 次,重新加入950 μl 无血清的DMEM-F12 培养基,并加入脂质体与荧光报告基因质粒,孵育4 h,取出上清液,重新加入含10%胎牛血清的DMEMF12,过夜后药物组加入Rh2(80 μmol/L),分别于6、12、24、48 h 后检测荧光素活性。
1.2.5 Western blot 检测HepG2 细胞中P-ERK、ERK、P-P38、P-38、P-JUK、JUK、MMP3 蛋白的表达取对数生长期HepG2 细胞,以1 ×107ml-1的密度接种,待细胞贴壁后,药物组加入Rh2(80 μmol/L),设空白对照组并加入最大剂量0.1%DMSO,分别培养6、12、24、48 h 后,用0.25%胰酶消化,收集各处理组细胞,提取总蛋白,用蛋白浓度测定试剂盒检测蛋白浓度,用Bio-Rad 的方法定量蛋白。取50 μg 蛋白,进行SDS-PAGE 电泳,电转到PDVF 膜,5%脱脂奶粉封闭2 h,兔抗人抗体P-ERK、ERK、P-P38、P-38、P-JUK、JUK、MMP3(1∶1 000),小鼠抗人Beta-actin(1∶2 000)4℃孵育过夜,用TBST 缓冲液漂洗,分别加入辣根过氧化酶标记的山羊抗兔IgG(1 ∶1 000)和山羊抗小鼠IgG(1∶1 000),37℃孵育1.5 h,TBST 缓冲液漂洗后用ECL 显色剂显色、曝光,运用Quantity One 图像分析软件测得条带的吸光度值,将各组的目的条带和内参比值后,比较各组间差异。
1.2.6 用定量PCR 方法分别检测AP1、MMP3 基因的表达 取对数生长期HepG2 细胞,以1 ×107ml-1的密度接种,24 h 后,药物组加入Rh2(80 μmol/L),设空白对照组并加入最大剂量0.1% DMSO,分别培养6、12、24、48 h 后,用0.25%胰酶消化,收集各处理组细胞,提取总的RNA,测出RNA 浓度,逆转录成功后进行定量分析。AP1:Forward:GCAAACCTCAGCAACTTCAACC;Reverse:GCATCTCGGGCACTGTCTGA;MMP3:Forward:TAATGGAGATGCCCACTTTGATG;Reverse:GAGTGAAAGAGACCCAGGGAGTG。
1.2.7 用荧光显微镜分别观察AP1,MMP3 蛋白的表达 取对数生长期HepG2 细胞,以1 ×107ml-1的密度接种,在6 孔板中置放无菌玻片,24 h 后,药物组加入Rh2(80 μmol/L),设空白对照组并加入最大剂量0.1%DMSO,每组平行接种3 个复孔,用4%多聚甲醛固定,用0.3%Triton-100 破膜,山羊血清封闭,分别加入AP1(1∶50),MMP3(1∶100),过夜,第二天加入抗兔荧光二抗,孵育1 h,用PI 染色,50%甘油封片。
1.3 统计学分析 采用SPSS18.0 软件对所得数据进行统计处理,数据以±s 表示,多组间采用两因素方差分析和单因素方差分析,两两比较采用LSD检验,P <0.05 表示差异有统计学意义。
2 结果
2.1 Rh2 可抑制HepG2 细胞的增殖 采用CCK-8 法,经酶标仪450nm波长检测发现对照组及空白对照组的细胞生长活跃,而加药组在给予Rh2(10~160 μmol/L)后HepG2 细胞增殖受到抑制,且呈剂量和时间依赖性(图1)。与对照组比较差异具有统计学意义(P <0.01)。
2.2 Rh2 可抑制HepG2 细胞的迁移 Transwell 迁移实验结果表明,经Rh2(80 μmol/L)作用于HepG2细胞24 h 后,与空白对照组相比较,加药组穿越过基膜的细胞数量显著减少(图2)。

图1 Rh2 对HepG2 细胞增殖的影响Fig.1 Effect of RH2 on proliferation inhibition rate of HepG2
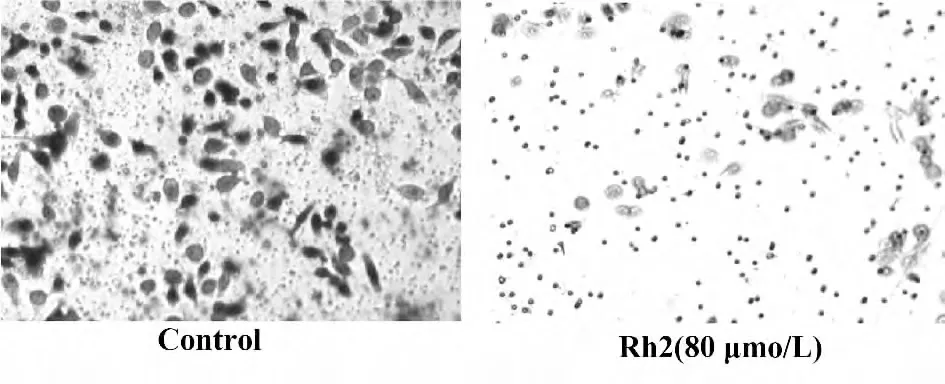
图2 Rh2 可抑制HepG2 细胞的迁移Fig.2 Effect of Rh2 on migration ability of HepG2
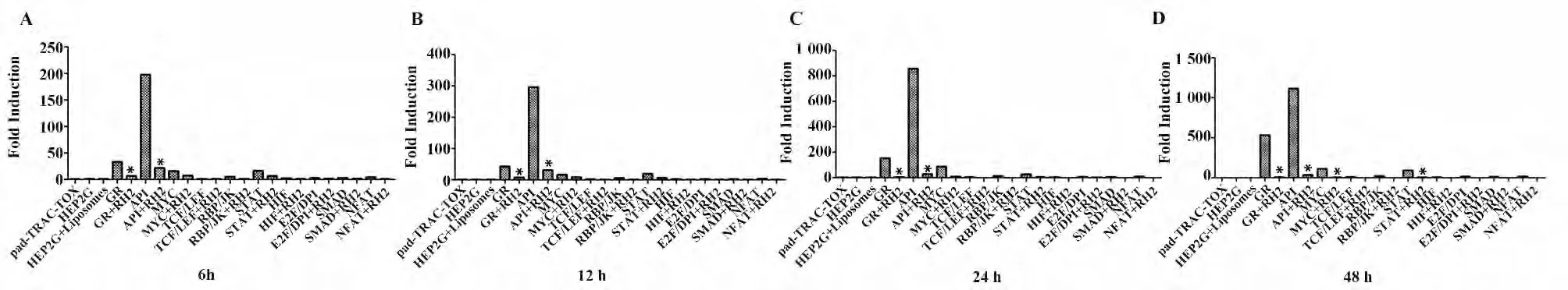
图3 检测HepG2 细胞中(pAP1-luc),(pGR-luc),(pMYC-luc),(pTCF/LEF-luc),(pRBP/JK-luc),(pSTAT-luc),(pHIF-luc),(pE2F/DP1-luc),(pSMAD-luc),(pNFAT-luc)荧光素的活性Fig.3 Renilla luciferase activities of (pAP1-luc),(pGR-luc),(pMYC-luc),(pTCF/LEF-luc),(pRBP/JK-luc),(pSTATluc),(pHIF-luc),(pE2F/DP1-luc),(pSMAD-luc),(pNFAT-luc)were assayed by Luciferase Reporter Assay system reagent
2.3 荧光素报告基因检测信号通路 荧光素报告基因结果显示(图3):在10 条信号通路中,(pAP1-luc)转染在HepG2 细胞后,荧光素的表达分别在6、12、24、48 h 显著升高,而(pGR-luc)、(pMYC-luc)、(pTCF/LEF-luc)、(pRBP/JK-luc)、(pSTAT-luc)、(pHIF-luc)、(pE2F/DP1-luc)、(pSMAD-luc)、(pNFAT -luc)转染在HepG2 细胞后,荧光素的表达在6、12、24、48 h 升高不明显,同时我们发现Rh2(80 μmol/L)处理(pAP1-luc)转染的HepG2 细胞后与(pAP1-luc)转染组相比荧光素的表达分别在6、12、24、48 h 显著降低。故我们推测AP1 转录因子对肝癌HepG2 细胞有着重要作用,让我们感兴趣的是Rh2 能抑制AP1 转录因子。
2.4 Western blot 检测HepG2 细胞中P-ERK、ERK、P-P38、P-JUK、JUK、MMP3 蛋白的表达 Western blot 检测结果显示(图4,5),Rh2(80 μmol/L)经不同时间(6、12、24、48 h)作用于HepG2 细胞后,与空白对照组相比较,HepG2 细胞P-ERK、MMP3 蛋白表达水平均明显下降,P-JUK、P-P38 蛋白表达水平均明显升高,差异有统计学意义(P <0.05),ERK、P-38、JUK 的表达水平则无明显差异。
2.5 用定量PCR 方法分别检测AP1、MMP3 基因的表达 定量荧光PCR 检测结果显示(图6),Rh2(80 μmol/L)经不同时间(6、12、24、48 h)作用于HepG2细胞后,与空白对照组相比较加药组HepG2 细胞AP1、MMP3 基因的表达随作用时间延长逐渐降低。
2.6 用荧光显微镜分别观察AP1,MMP3 蛋白的表达 免疫荧光检测结果显示(图7):经Rh2(80 μmol/L)作用于HepG2 细胞24 h 后,与空白对照组相比较,加药组HepG2 细胞的AP1、MMP3 蛋白在细胞质内的表达显著减少。
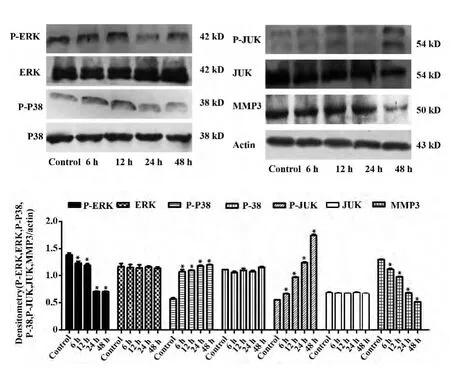
图4 Western blot 检测HepG2 细胞中P-ERK、ERK、P-P38、P-JUK、JUK、MMP3 蛋白的表达Fig.4 Effect of Rh2 on expression of P-ERK,ERK,PP38,P-JUK,JUK and MMP3 proteins

图5 定量PCR 方法分别检测AP1,MMP3 基因的表达(±s,n=3)Fig.5 Effect of Rh2 on expression of AP1,MMP3 genes(±s,n=3)

图6 荧光显微镜法分别检测AP1,MMP3 蛋白的表达Fig.6 Effect of Rh2 on expression of AP1,MMP3 fluorescence proteins
3 讨论
人参作为祖国传统医学的一种“补气”药物使用已有上千年历史,近年在各种肿瘤治疗中作为一种辅助性治疗药物在应用。RH2 作为人参总皂苷成份之一,研究表明它能促进胰腺癌、肝癌、肺癌等肿瘤细胞的凋亡[8],但是它对肿瘤细胞的迁移是否有影响尚未见文献报道。我们此次实验的目的是进一步讨论人参皂苷Rh2 对肝癌HepG2 细胞的迁移作用。
我们采用了CCK-8 法检测人参皂苷Rh2 对肝癌HepG2 细胞增殖的影响。实验结果表明,Rh2 能有效抑制肝癌HepG2 细胞的增殖,并呈剂量和时间依赖性。
在研究中,我们采用Transwell 迁移实验模拟了肿瘤细胞的体外侵袭和迁移,实验中观察到HepG2细胞有很强的侵袭迁移能力,80 μmol/L Rh2 作用于HepG2 细胞后,能显著减少穿过聚碳酸酯膜的细胞数,提示Rh2 能有效抑制肝癌细胞的侵袭迁移能力。
荧光素报告基因在筛选药物研究方面应用广泛,同时也是一种分析转录因子和特异性启动子方法[9]。我们应用十种荧光素报告基因去筛选人参皂苷Rh2 作用于肝癌HepG2 细胞的转录因子,让我们感兴趣的是在肝癌HepG2 细胞中AP1 转录因子处于高表达状态,更令我们惊讶的是Rh2 能抑制AP1 转录因子的表达,因此我们设想Rh2 可能是通过抑制AP1 转录因子的活性来抑制肝癌HepG2 细胞的迁移。随后我们又用免疫荧光去检测HepG2细胞内的AP1 转录因子,也发现与对照组相比,加药组AP1 转录因子的荧光强度明显减弱。
AP1 转录因子由是多聚体(JUN、FOS、JTF、MAF)构成的复合物,JUN、FOS 构成聚合物是一种癌基因蛋白,促进肿瘤生长[10,11]。我们通过Western blot 检测了AP1 转录因子的上游信号通路MAPK(ERK、JUK、P38),实验结果表明,不同时间加药组(6、12、24、48 h)作用于HepG2 细胞后,与空白对照组相比较,P-ERK 蛋白表达水平均明显下降,P38、JUK 蛋白表达水平均明显升高,MAPK 通路的异常活化能导致细胞丧失凋亡和分化的能力,促使细胞恶性转化,异常增殖,产生肿瘤,并能促使肿瘤进一步增殖,这表明Rh2 对MAPK 信号通路的调控对治疗肿瘤有一定意义,同时我们检测了AP1 转录因子的下游信号通路MMP3[12]。MMPs 是降解细胞外基质的重要蛋白水解酶,主要的作用底物是Ⅳ型胶原,通过降解细胞外基质和基底膜的主要成分Ⅳ型胶原,从而参与肿瘤的浸润和转移过程,因而与肿瘤转移的关系更为密切,故我们用Western blot 检测了MMP3[13]。不同时间加药组(6、12、24、48 h)作用于HepG2 细胞后,与对照组相比较,MMP3 蛋白明显降低,同时我们也检测MMP3 的基因表达,与对照组相比较,药物组的MMP3 基因表达显著降低;免疫荧光检测结果也显示,与对照组相比较,药物组的MMP3 在细胞质内显著减少。
综上所述,人参皂苷Rh2 抑制肝癌HepG2 细胞迁移是通过MAPK 通路抑制AP1 转录因子从而降低MMP3 的表达来实现的。
[1]Page AJ,Cosgrove DC,Philosophe B,et al.Hepatocellular Carcinoma:Diagnosis,Management,and Prognosis[J].Surg Oncol Clin N Am,2014,23(2):289-311.
[2]杨秉辉,张博恒.重视肝癌的病因和预防[J].临床肝胆病杂志,2014,28(4):253-255.
[3]Scaggiante B,Kazemi M,Pozzato G,et al.Novel hepatocellular carcinoma molecules with prognostic and therapeutic potentials[J].World J Gastroenterol,2014,20(5):1268-1288.
[4]Fanjul-Fernandez M,Folgueras AR,Cabrera S,et al,Matrix metalloproteinases:evolution,gene regulation and functional analysis in mouse models[J].Biochim Biophys Acta,2010,1803(1):3-19.
[5]Chung KS,Cho SH,Shin JS,et al.Ginsenoside Rh2 induces cell cycle arrest and differentiation in human leukemia cells by upregulating TGF-beta expression[J].Carcinogenesis,2013,34(2):331-340.
[6]Christensen LP.Ginsenosides chemistry,biosynthesis,analysis,and potential health effects[J].Adv Food Nutr Res,2009,55:1-99.
[7]Tang XP,Tang GD,Fang CY,et al.,Effects of ginsenoside Rh2 on growth and migration of pancreatic cancer cells[J].World J Gastroenterol,2013,19(10):1582-1592.
[8]Cheng CC,Yang SM,Huang CY,et al.Molecular mechanisms of ginsenoside Rh2-mediated G1 growth arrest and apoptosis in human lung adenocarcinoma A549 cell[J]s.Cancer Chemother Pharmacol,2005,55(6):531-540.
[9]Naylor LH.Reporter gene technology:the future looks bright[J].Biochem Pharmacol,1999,58(5):749-757.
[10]Eferl RE,Wagner F.AP-1:a double-edged sword in tumorig-enesis[J].Nat Rev Cancer,2003,3(11):859-868.
[11]Eckert RL,Adhikary G,Young CA,et al.AP1 transcription factors in epidermal differen-tiation and skin cancer[J].J Skin Cancer,2013,2013:537028.
[12]Mittelstadt ML,Patel RC.AP-1 mediated transcriptional repression of matrix metalloproteinase-9 by recruitment of histone deacetylase 1 in response to interferon beta[J].PLoS One,2012,7(8):e42152.
[13]Konstantinopoulos PA,Karamouzis MV,Papatsoris AG,et al.Matrix metalloproteinase inhibitors as anticancer agents[J].Int J Biochem Cell Biol,2008,40(6-7):1156-1168.
