膜表达型InsB15-23H-2Kd dtSCT 对NOD 小鼠1 型糖尿病发病的影响
2015-03-18潘兴元陈则东余鸣鸣季明春
潘兴元 陈则东 窦 延 梁 锴 余鸣鸣 季明春
(扬州大学医学院病原生物学与免疫学教研室,扬州 225001)
1 型糖尿病(Type 1 diabetes mellitus,T1D)是由T 淋巴细胞介导的,以胰岛β 细胞损伤为主要特征的器官特异性自身免疫疾病,目前仍无有效的根治方法[1]。非肥胖型糖尿病小鼠(Nonobese diabetic,NOD)能自然发生1 型糖尿病,从12 周龄时开始出现明显糖尿病症状,至30 周龄时雌性小鼠累计发病率可达到80%。并且与人类似,在疾病早期(4~5周龄)发生胰岛炎,进行性破坏胰岛β 细胞,是目前研究1 型糖尿病的主要动物模型之一[2,3]。
在NOD 小鼠1 型糖尿病病程中,CD8+细胞毒T 细胞(Cytotoxic T lymphocytes,CTLs)发挥着重要作用[4],特别是启动抗原胰岛素(insulin)特异性的CTLs 更是研究热点之一[1]。insulin B15-23(简写为InsB15-23)是H-2Kd限制性的优势表位[5],但它与H-2Kd的亲和力很低。为了研究InsB15-23表位在T1D病程中的作用,我们引入了二硫键陷阱单链三聚体(disulfide trap single chain trimer,dtSCT)技术[6,7],来提高InsB15-23的稳态肽占位水平(level of steadystate peptide occupancy)。我们用前期构建的膜表达型InsB15-23H-2KddtSCT (简写为InsB15-23mdtSCT)真核表达载体皮下免疫3 周龄母鼠,观察其对NOD小鼠血糖和发病情况的影响。
1 材料与方法
1.1 小鼠 3 周龄SPF 级NOD/ShiLtJ 雌性小鼠购自南京大学国家遗传工程小鼠资源库,在SPF 条件下饲养,所用饲料、饮水与垫料均经高压灭菌处理,实验所有操作均在无菌超净工作台内进行。操作都符合实验动物福利。
1.2 免疫小鼠 24 只3 周龄的NOD 母鼠随机分为两组,每组12 只。实验组小鼠首免使用50 μg InsB15-23mdtSCT 加等体积的弗氏完全佐剂,接种于NOD 小鼠右后肢外侧皮下;1 周以后,用50 μg InsB15-23mdtSCT 加等体积的弗氏不完全佐剂,于相同部位行第二次免疫;距二次免疫后一周进行第三次免疫,方法与第二次接种相同。对照组采用pcDNA3.1(-)空载体,方法同实验组。
1.3 NOD 小鼠的血糖监测 从10 周龄开始,采用三诺公司的安稳血糖仪检测小鼠血糖,每周监测一次,直到30 周。每次检测前对NOD 小鼠行6 h 的禁食处理,并更换垫料,防止小鼠采食食物残渣对血糖测定值造成干扰。
1.4 胰岛单个核细胞浸润分析 取3 周龄的NOD母鼠4 只,随机分为两组,同法免疫。7 周龄时处死小鼠,取胰腺制成石蜡切片。取连续切片置于显微镜下观察,分别统计0~1/4 浸润、1/4~1/2 浸润、1/2~3/4 浸润、3/4~完全浸润的胰岛个数,并作统计分析。
1.5 IGRP206-214H-2KddtSCT 四聚体的制备 胰岛细胞特异性葡萄糖-6-磷酸酶催化亚基相关蛋白(Islet glucose-6-phosphatase catalytic subunit-related protein,IGRP)是1 型糖尿病病程晚期的重要抗原,其H-2Kd限制性表位是IGRP206-214[1]。为了研究InsB15-23mdtSCT 分子影响1 型糖尿病病程的细胞学机制,我们制备了IGRP206-214H-2KddtSCT 四聚体来监测NOD 小鼠IGRP206-214特异性CTLs 的变化。方法参照本实验室可溶性dtSCT 四聚体制备方法。简而言之就是通过SOE-PCR 将InsB15-23抗原肽、β2m和H-2Kd胞外区依次相连,并在H-2Kd的84 位引入一个酪氨酸-半胱氨酸(Y84C)突变,与linker1 中的半胱氨酸形成分子内二硫键,帮助抗原肽更好地与抗原结合槽结合[8]。同时在H-2Kd胞外区3'端加上可生物素化Avitag(GGGLNDIFEAQKIEWHE)序列[9],在5'端和3'端分别加上NdeⅠ和XhoⅠ酶切位点,克隆入pET-22b 原核表达载体中。经过原核表达、洗涤包涵体、纯化包涵体、稀释复性得到IGRP206-214H-2KddtSCT 单体,再将单体生物素化后与PE 荧光素标记的streptavidin 按4∶1比例混合制备成四聚体。
1.6 流式检测 先标记APC-mCD8α 单抗,再标记IGRP206-214H-2KddtSCT 四聚体。用含有0.5%FBS的PBS 洗3 次后在BD Calibur 上进行检测。同周龄的BALB/c 小鼠作为阴性对照来检测非特异性标记水平。
1.7 统计学分析 用GraphPad Prism 软件进行数据分析。
2 结果
2.1 InsB15-23mdtSCT 能够降低NOD 小鼠T1D 的发病率 因为实验周期较长,期间有部分小鼠意外死亡,统计最终结果时InsB15-23mdtSCT 组还剩11 只,pcDNA3.1(-)组还剩10 只。由图1A 可见,30 周龄时两组小鼠的平均血糖有显著差异(P <0.05),InsB15-23mdtSCT 组中91%(10/11)NOD 小鼠的血糖值低于阈值(13.9 mmol/dl,即250 mg/L),而pcDNA3.1(-)组这一比例仅40%(4/10)。由图1B 可见,InsB15-23mdtSCT 组NOD 小鼠的发病率是9%,显著低于pcDNA3.1(-)组的60%和自然发病组的80%。由此可见InsB15-23mdtSCT 具有保护NOD 小鼠,降低其糖尿病发生率的作用。
2.2 过表达InsB15-23mdtSCT 降低NOD 小鼠胰岛浸润淋巴细胞 我们通过连续切片的方法,系统地检查NOD 小鼠每个胰岛的浸润情况,发现InsB15-23mdtSCT 处理组的细胞浸润程度降低,0~1/4 浸润胰岛的比率明显多于pcDNA3.1(-)组;而1/4~1/2、1/2~3/4、3/4~1 浸润胰岛的比率均显著减少(图2)。由此可见InsB15-23rndtSCT 具有减轻炎性细胞浸润,保护胰岛的作用。
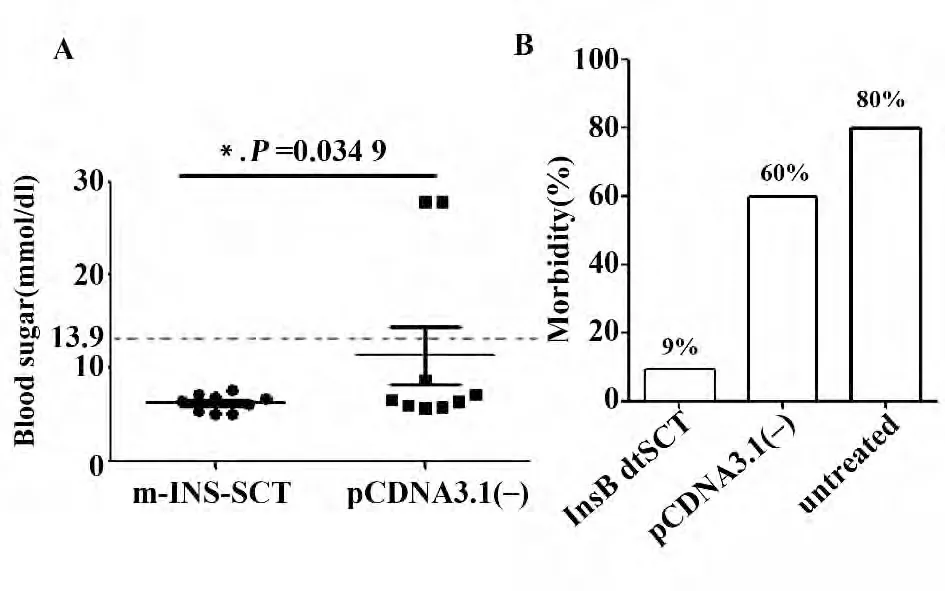
图1 30 周龄时NOD 小鼠的血糖及发病率Fig.1 Blood sugar value and morbidity of NOD mice in 30 weeks
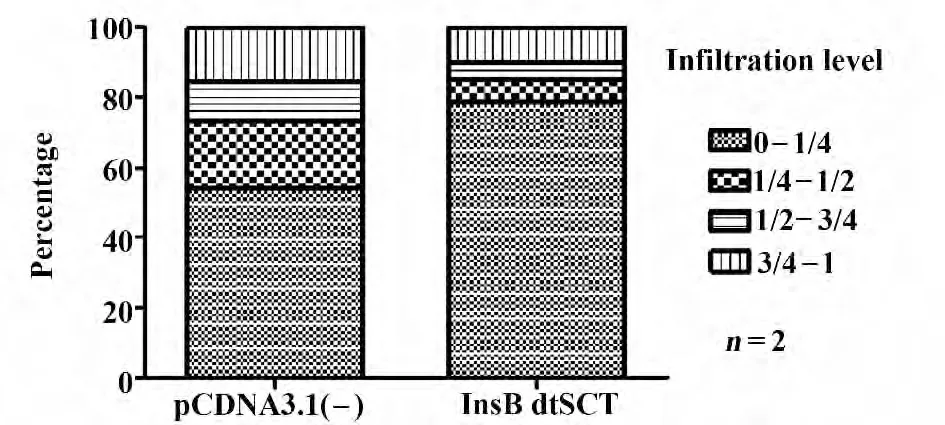
图2 胰岛浸润情况Fig.2 Infiltration of islets
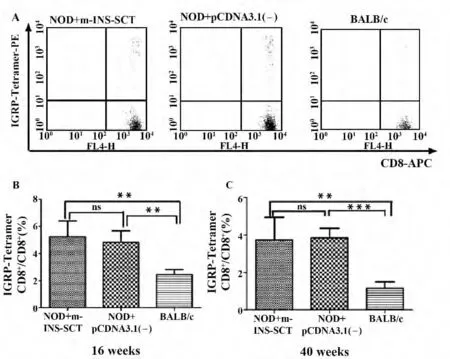
图3 InsB15-23mdtSCT 过表达对NOD 小鼠外周血IGRP206-214特异性CTLs 频率无影响Fig.3 Overexpression of InsB15-23mdtSCT does not influence frequency of IGRP206-214specific CTLs in PBMC
2.3 InsB15-23mdtSCT 通过IGRP206-214非依赖性途径来保护NOD 小鼠 在1 型糖尿病的发生与发展过程中存在着抗原表位扩展的现象[4],因此针对上游的抗原进行免疫干预,势必会干扰到下游抗原的暴露,进而影响到相应抗原特异性CTLs 的水平和疾病的发展。InsB15-23特异性CTLs 大约在4~5 周龄时最多[10,11],是T1D 进程中起始抗原特异性CTLs,数量较少;而IGRP206-214特异性CTLs 是目前发现的1 型糖尿病后期的重要自身反应性CTLs,往往就在发生糖尿病前达到高峰[12]。那么InsB15-23mdtSCT对NOD 小鼠的保护作用是通过影响IGRP206-214特异性CTLs 水平来实现的吗?我们发现16 周龄、40 周龄的NOD 小鼠外周血中IGRP206-214特异性CTLs 的频率都和pcDNA3.1(-)组均无显著差异,但都与阴性对照BALB/c 有显著或极显著差异(图3),说明我们自制的四聚体是有效的,并且InsB15-23mdtSCT 是通过IGRP206-214非依赖性机制来保护NOD小鼠的。
3 讨论
NOD 小鼠饲养于本实验室的IVC 笼盒中,严格按照IVC 操作规范进行饲养管理。在交配繁殖工作中,通过血糖测定选取血糖值明显偏高的小鼠进行交配繁殖,防止糖尿病性状的丢失。通过对本实验室截止至30 周龄的NOD 小鼠分析发现,母鼠的发病率为80%,公鼠的发病率为22.2%,与美国杰克逊实验室公布的数据基本一致。
CTLs 在NOD 小鼠1 型糖尿病病程中有着重要作用,β2mnullNOD 小鼠不表达MHCⅠ类分子,CTLs缺失,结果完全不发生1 型糖尿病,甚至连胰岛炎都100%不发生[13,14]。有报道表明CTLs 在1 型糖尿病除了晚期的各个时期都是必需的,尤其对NOD 小鼠早期疾病的引发以及自身反应性CD4+T 细胞的扩增是必不可少的[15,16]。在疾病的发生和发展过程中会出现多种自身抗原,存在表位扩展的现象。其中胰岛素作为疾病进程中早期的关键性抗原,对于其他抗原的暴露及相应CTLs 的诱导有着关键作用。用编码preproinsulinⅡ、proinsulinⅡ、insulinⅡ的质粒免疫NOD 小鼠,都可以加速T1D 的发病[17],所以我们将关注点集中在胰岛素特异性CTLs,也就是InsB15-23特异性、H-2Kd限制性CTLs 上,研究其在1型糖尿病病程中的作用。
以往这方面的研究往往用流式分选出InsB15-23特异性CTLs,再过继转移给NOD·SCID 小鼠或经半致死剂量辐照的NOD 幼龄小鼠[5],因为受体小鼠都是免疫缺陷的,并且是将CTLs 单独过继给受体小鼠,所以这种方法不是严格的体内实验,不能反映NOD 小鼠体内的真实情况。还有一种常用的方法是用人工合成的InsB15-23肽来免疫NOD 小鼠。这种方法较为简便,但合成肽存在纯度问题,哪怕是99.9%纯度的肽中也必然混有其他抗原肽,而其中一些强免疫原性的痕量杂肽就有可能导致错误的结果[18]。基于以上考虑,我们决定用真核表达质粒来免疫动物。因为InsB15-23肽的低亲和力,我们采用dtSCT 技术来提高肽与H-2Kd分子抗原结合槽的亲和力。
DNA 疫苗最常用的免疫途径是肌肉免疫。肌肉组织里抗原递呈细胞极少,主要是肌细胞摄取并表达抗原,但肌细胞缺乏共刺激分子,在诱导CTLs应答中并不起直接作用,而是合成抗原并通过某种方式释放到细胞外,供抗原递呈细胞摄取(交叉激活)[19]。我们的dtSCT 分子在细胞内“预装配”,需要直接表达,而不是经过加工递呈,所以我们选择了皮下免疫。
因为dtSCT 分子在细胞内“预装配”,有效地绕过细胞对抗原处理和提呈过程中的各种限制,可以提高抗原提呈的效率,展示出了活化CTLs 的良好前景[20]。本实验室前期的工作也发现InsB15-23mdtSCT 分子能够在真核细胞膜表面展示,并可以提高NOD 小鼠外周血和脾脏中InsB15-23特异性CTLs的频率(另文发表),所以我们初始的预期是InsB15-23mdtSCT 真核表达载体会加速疾病的进程。然而,在本研究中却发现InsB15-23mdtSCT 具有降低NOD 小鼠1 型糖尿病发病率的作用。我们检查了胰岛浸润情况,发现免疫InsB15-23mdtSCT 的NOD 小鼠胰岛单个核细胞的浸润确实减轻了。这可能由于我们构建的InsB15-23mdtSCT 是由强启动子CMV 控制的,免疫动物后短期内能产生过量的抗原信号,导致CTLs 的活化后凋亡,尚需进一步的实验来验证。并且,我们还发现InsB15-23mdtSCT 对小鼠的保护作用并不是通过IGRP206-214依赖性机制来发挥作用的,具体的机制很值得我们深入研究。
我们在实验中还发现,pcDNA3.1(-)对照组的发病率略低于自然发病率,这可能是由于弗氏完全佐剂对NOD 小鼠免疫系统的干预引起的[21]。但在我们的实验中,两组小鼠初次免疫都使用了弗氏完全佐剂,对小鼠的影响是相同的,两组小鼠发病率的差异是由于免疫不同的真核表达质粒造成的。
[1]Culina S,Brezar V,Mallone R.Insulin and type 1 diabetes:immune connections[J].Eur J Endocrinol,2013,168(2):R19-R31.
[2]Anderson MS,Bluestone JA.The NOD mouse:a model of immune dysregulation[J].Annu Rev Immunol,2005,23:447-485.
[3]Qin H,Trudeau JD,Reid GS,et al.Progression of spontaneous autoimmune diabetes is associated with a switch in the killing mechanism used by autoreactive CTL[J].Int Immunol,2004,16(11):1657-1662.
[4]Luo X,Herold KC,Miller SD.Immunotherapy of type 1 diabetes:where are we and where should we be going?[J].Immunity,2010,32(4):488-499.
[5]Wong FS,Visintin I,Wen L,et al.CD8 T cell clones from young nonobese diabetic (NOD)islets can transfer rapid onset of diabetes in NOD mice in the absence of CD4 cells[J].J Exp Med,1996,183(1):67-76.
[6]Truscott SM,Lybarger L,Martinko JM,et al.Disulfide bond engineering to trap peptides in the MHC class I binding groove[J].J Immunol,2007,178(10):6280-6289.
[7]Truscott SM,Wang X,Lybarger L,et al.Human major histocompatibility complex (MHC)class I molecules with disulfide traps secure disease-related antigenic peptides and exclude competitor peptides[J].J Biol Chem,2008,283(12):7480-7490.
[8]Heckman KL,Pease LR.Gene splicing and mutagenesis by PCRdriven overlap extension[J].Nat Protoc,2007,2(4):924-932.
[9]Beckett D,Kovaleva E,Schatz PJ.A minimal peptide substrate in biotin holoenzyme synthetase-catalyzed biotinylation[J].Protein Sci,8(4):921-929.
[10]Wong FS,Karttunen J,Dumont C,et al.Identification of an MHC class I-restricted autoantigen in type 1 diabetes by screening an organ-specific cDNA library[J].Nat Med,1999,5 (9):1026-1031.
[11]Martinuzzi E,Novelli G,Scotto M,et al.The frequency and immunodominance of islet-specific CD8+T-cell responses change after type 1 diabetes diagnosis and treatment[J].Diabetes,2008,57(5):1312-1320.
[12]Amrani A,Verdaguer J,Serra P,et al.Progression of autoimmune diabetes driven by avidity maturation of a T-cell population[J].Nature,2000,406(6797):739-742.
[13]Wicker LS,Leiter EH,Todd JA,et al.Beta 2-microglobulin-deficient NOD mice do not develop insulitis or diabetes[J].Diabetes,1994,43:500-504.
[14]Sumida T,Furukawa M,Sakamoto A,et al.Prevention of insulitis and diabetes in beta 2-microglobulin-deficient non-obese diabetic mice[J].Int Immunol,1994,6(9):1445-1449.
[15]Wang B,Gonzalez A,Benoist C,et al.The role of CD8+T cells in the initiation of insulin-dependent diabetes mellitus[J].Eur J Immunol,1996,26(8):1762-1769.
[16]DiLorenzo TP,Graser RT,Ono T,et al.Major histocompatibility complex class I-restricted T cells are required for all but the end stages of diabetes development in nonobese diabetic mice and use a prevalent T cell receptor alpha chain gene rearrangement[J].Proc Natl Acad Sci USA,1998,95(21):12538-12543.
[17]Karges W,Pechhold K,Al Dahouk S,et al.Induction of autoimmune diabetes through insulin (but not GAD65)DNA vaccination in nonobese diabetic and in RIP-B7.1 mice[J].Diabetes.2002,51(11):3237-3244.
[18]Brezar V,Culina S,Østerbye T,et al.T cells recognizing a peptide contaminant undetectable by mass spectrometry[J].PLoS One,2011,6(12):e28866.
[19]Coban C,Koyama S,Takeshita F,et al.Molecular and cellular mechanisms of DNA vaccines[J].Hum Vaccin,2008,4(6):453-456.
[20]Chang CC,Ferrone S.Immune selective pressure and HLA class I antigen defects in malignant lesions[J].Cancer Immunol Immunother,2007,56(2):227-236.
[21]牛晓红,王晓希,蒋铁建,等.完全弗氏佐剂诱导胸腺细胞凋亡对NOD 鼠1 型糖尿病发生的影响[J].解放军医学杂志,2009,34(8):34-42.
