细菌生物膜对Th17 免疫细胞的刺激作用①
2015-03-18王国戗王小方张华丽潘亚晶娄婷叶
王国戗 王小方 汪 磊 张华丽 仲 华 潘亚晶 张 磊 娄婷叶
(新乡医学院第一附属医院检验科,卫辉 453100)
细菌生物膜是细菌在各种各样的外界环境中形成的一种最普遍的结构,细菌生物膜形成是对外界环境压力的一种反应,细菌形成生物膜后对外界的不利环境因素产生了抗性,包括对抗生素和宿主的免疫力[1]。细菌形成生物膜感染机体后引起感染的慢性化这一观点已经形成广泛共识[2-5]。关于细菌生物膜感染机体后引发的免疫反应目前报道的较少[6,7],在这些少有的报道中,有文献认为细菌生物膜感染刺激了Th17 细胞增殖和IL-17 细胞因子的表达增加[8-11],但是也有报道称生物膜并没有引起机体明显的免疫反应[12],鉴于此,本研究的目的是研究生物膜形成能力和Th17 细胞的关系。
1 材料与方法
1.1 实验中所用菌株 实验中所用的铜绿假单胞菌和鲍曼不动杆菌来自于新乡医学院第一附属医院临床肺泡灌洗液标本(细菌由肺泡灌洗液中培养分离)中第一代分离菌株(细菌在生长对数期时检测生物膜形成能力)。
1.1.2 仪器和试剂 仪器:流式细胞仪为美国BD公司(FACS Canto)、酶免仪为烟台艾德康公司生产全自动酶免疫工作站;试剂:Biolegend 公司人Th17流式检测试剂盒:包括FITC 标记的抗人CD3,PE 标记的抗人CD4,Alexa Fluor 647 标记的抗人IL-7 及相匹配的鼠IgG1 同型对照,固定液和破膜洗液;Biolegend 公司CD4+CD25+Foxp3+Treg 一步法流式检测试剂盒:包括FITC 标记的抗人CD4,PE 标记的抗人CD25,Alexa Fluor647 标记的Foxp3 及相匹配的鼠IgG1 同型对照,Foxp3+固定/破膜液和破膜缓冲液;佛波酯、离子霉素均购自Sigma 公司;莫能霉素购自Biolegend 公司;IL-17ELSIA 试剂盒为Biosource公司生产,结晶紫染液为自行配置。
1.2 实验方法
1.2.1 IL-17 的检测 临床上无菌手续采集的肺泡灌洗液通过4 层无菌纱布过滤注入10 ml 的无菌试管中,2 000 r/min 离心5 min,上清液用于IL-17 的检测,操作步骤严格按照说明书进行,离心沉淀用于细菌培养和Th17 细胞的检测,2013 年1 月至2013年12 月共收到肺泡灌洗液标本253 例,另外检测病人以及健康对照人群的外周血清IL-17 水平。
1.2.2 细菌培养与鉴定 上述离心后的肺泡灌洗液标本无菌手续取出少许用于细菌培养与鉴定,剩余标本用于Th17 细胞的检测,沉淀标本接种于血琼脂平板和麦康凯培养平板,次日将单个菌落用于细菌鉴定和生物膜形成能力的检测(依据细菌菌落和细菌形态特点初步判断铜绿假单胞菌和鲍曼不动杆菌的菌落用于检测生物膜形成能力,经鉴定后不是上述两种细菌的生物膜形成能力检测结果剔除)。
1.3 细菌生物膜形成能力的检测 用结晶紫染色法[13]对临床分离的鲍曼不动杆菌和铜绿假单胞菌进行生物被膜生成能力检测。具体方法如下:用细菌标准比浊管将鲍曼不动杆菌和铜绿假单胞菌菌液调节至0.5 麦氏浊度,取10 μl 加入96 孔平底组织培养板中(每孔含200 μl 的1∶50 稀释的LB 培养液)。每株菌作3 个复孔,一个空白对照孔只加培养液,37℃静止培养48 h;每个菌的3 个复孔中分别加入150 μl 0.25 g/L 的结晶紫染液,室温下染色20 min;生理盐水冲洗5 次后晾干;每孔加入95%乙醇300 μl,室温脱色10 min;用紫外可见分光光度计检测每孔脱色液在570 nm 处的吸光度值(A570)。每个菌的A570 等于其3 个复孔的A570 的平均值减去空白对照孔A570 值。
1.4 Th17 细胞的检测 Th17 细胞的检测严格按照操作说明进行,检测对象为上述培养出铜绿假单胞菌和鲍曼不动杆菌的肺泡灌洗液标本以及上述病人的外周血以及24 例健康人外周血的Th17细胞。
1.5 数据统计 采用SPSS17.0 统计学软件,所有数据均数均采用±s 表示,各组间均数差异统计采用独立样本t 检验和配对资料的t 检验,以P <0.05为差异有统计学意义。
2 结果
2.1 细菌培养与鉴定结果 共分离培养出铜绿假单胞菌59 例,鲍曼不动杆菌54 例,这两种细菌共计113 例。
2.2 细菌生物膜形成能力检测结果 113 株细菌的生物被膜形成能力检测结果为A570 值的最大分布范围为:0.15~2.12,其中A570 值0.5 以下24株,A570 值1.5 以上28 份。在此本研究将A570 值0.5 以下的24 株细菌定为弱生物膜形成菌,感染此菌的病人定为非生物膜感染组,A570 值1.5 以上的28 株菌定为强生物膜形成菌,感染此菌的病人定为生物膜感染组。
2.3 生物膜感染组和非生物膜感染组Th17 细胞和IL-17 水平
2.3.1 不同实验组外周血Th17 细胞和血清IL-17水平比较,见表1。
Th17 细胞三组之间比较P >0.05,分别为生物膜感染组对非生物膜感染组P=0.409,对健康对照组P=0.779,非生物膜感染组对健康对照P=0.598,血清IL-17 水平三组之间比较P >0.05,分别为生物膜感染组对非生物膜感染组P=0.138,对健康对照组P=0.136,非生物膜感染组对健康对照P=0.992。
2.3.2 不同实验组支气管灌洗液Th17 细胞和IL-17水平比较(±s),见表2 以及流Th17 细胞式细胞图(图1)。
表1 不同实验组外周血Th17 细胞和IL-17 水平比较(±s)Tab.1 Respective comparison of Th17 cell ratio and IL-17 level in peripheral blood in different experimentation groups(±s)

表1 不同实验组外周血Th17 细胞和IL-17 水平比较(±s)Tab.1 Respective comparison of Th17 cell ratio and IL-17 level in peripheral blood in different experimentation groups(±s)
表2 不同实验组支气管灌洗液Th17 细胞和IL-17 水平比较(±s)Tab.2 Respective comparison of Th17 cell ratio and IL-17 level in bronchus alveolus washing-water between bio-film infection and Non bio-film infection group±s)

表2 不同实验组支气管灌洗液Th17 细胞和IL-17 水平比较(±s)Tab.2 Respective comparison of Th17 cell ratio and IL-17 level in bronchus alveolus washing-water between bio-film infection and Non bio-film infection group±s)
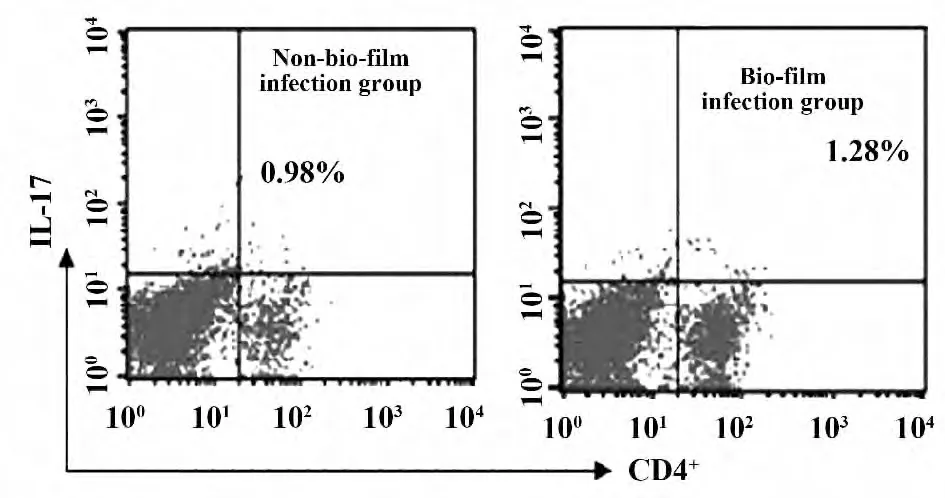
图1 生物膜感染组与非生物膜感染组支气管灌洗液中Th17 细胞流式细胞图Fig.1 Flow cytometry pictures of Th17 cell in bronchoalveolar lavage fluid
3 讨论
细菌生物膜是细菌在外界环境压力下形成的一种普遍的结构,是对外界压力的一种适应性反应。细菌形成生物膜后对外界的抗性增加,包括对抗生素的耐药性和对机体的免疫逃避。报道认为细菌生物膜刺激机体并引起了机体的免疫反应,并引起感染机体的组织损害[8],但也有报道认为细菌生物膜并没有引起机体的免疫反应[12],有报道认为细菌生物膜诱导了IL-6、IL-8 升高[2,14,15],也有报道认为,浮游菌相对于生物膜细菌引起机体产生更多的IL-6、IL-8、血管内皮因子、TGF-β1,但生物膜细菌诱导机体产生了更多的TNF-α[16]。
Th17 细胞是新发现的隶属于T 细胞的细胞系,在处理浮游菌细胞外感染中起关键作用,在慢性生物膜菌感染发生囊性纤维化或者支气管扩张时Th17 细胞也可能起到了关键作用[17],鉴于生物膜菌感染结果引起的不一致报道,我们的研究集中在了生物膜细菌感染引起的Th17 细胞的变化。
我们的研究结果表明,生物膜感染主要引起了感染局部Th17 细胞的变化,并没有引起全身系统性的免疫变化,局部Th17 细胞的聚集,Th17 细胞通过分泌细胞趋化因子引起更多的中性粒细胞到达感染部位[17],中性粒细胞在杀死感染细菌的同时也引起了感染机体组织的损伤,另一方面细菌生物膜的存在导致细菌的多重耐药[18]和对机体免疫力的抵抗[19],这可能是细菌形成生物膜后引起感染慢性化的机制,从而导致了感染机体的长期慢性损害。所以对于生物膜细菌感染机体适当地降低免疫反应有利于减轻感染局部的炎症损害。关于细菌生物膜引起Th17 细胞增殖的机制,我们没有检索到相关文献,这方面的机制我们研究小组正继续努力通过生物膜的主要成分分别研究。
[1]Sadowska B,Wickowska-Szakiel M,Paszkiewicz M,et al.The immunomodulatory activity of Staphylococcus aureus products derived from biofilm and planktonic cultures[J].Arch Immunol Ther Exp(Warsz),2013,61(5):413-420.
[2]Cantero D,Cooksley C,Bassiouni A,et al.Staphylococcus aureus biofilm activates the nucleotide-binding oligomerization domain containing 2 (Nod2)pathway and proinflammatory factors on a human sinonasal explant model[J].Int Forum Allergy Rhinol,2013,3(11):877-884.
[3]Peyyala R,Kirakodu SS,Novak KF,et al.Oral microbial biofilm stimulation of epithelial cell responses[J].Cytokine,2012 Apr;58(1):65-72.
[4]Prabhakara R,Harro JM,Leid JG,et al.Suppression of the inflammatory immune response prevents the development of chronic biofilm infection due to methicillin-resistant Staphylococcus aureus[J].Infect Immun,2011,79(12):5010-5018.
[5]Moutsopoulos NM,Kling HM,Angelov N,et al.Porphyromonas gingivalis promotes Th17 inducing pathways in chronic periodontitis[J].J Autoimmun,2012,39(4):294-303.
[6]Granslo HN,Klingenberg C,Fredheim EA,et al.Staphylococcus epidermidis biofilms induce lower complement activation in neonates as compared with adults[J].Pediatr Res,2013,73(3):294-300.
[7]Sun Y,Zhou B,Wang C,et al.Biofilm formation and Toll-like receptor 2,Toll-like receptor 4,and NF-kappaB expression in sinus tissues of patients with chronic rhinosinusitis[J].Am J Rhinol Allergy,2012,26(2):104-109.
[8]Prabhakara R,Harro JM,Leid JG,et al.Murine immune response to a chronic Staphylococcus aureus biofilm infection[J].Infect Immun,2011,79(4):1789-1796.
[9]Snowden JN,Beaver M,Smeltzer MS,et al.Biofilm-infected intracerebroventricular shunts elicit inflammation within the central nervous system[J].Infect Immun,2012,80(9):3206-3214.
[10]Cheng WC,Hughes FJ,Taams LS.The presence,function and regulation of IL-17 and Th17 cells in periodontitis[J].J Clin Periodontol,2014,41:541-549.
[11]Ohlrich EJ,Cullinan MP,Seymour GJ.The immunopathogenesis of periodontal disease[J].Aust Dent J,2009,54(Suppl 1):S2-S10.
[12]Wood AJ,Fraser JD,Swift S,et al.Intramucosal bacterial microcolonies exist in chronic rhinosinusitis without inducing a local immune response[J].Am J Rhinol Allergy,2012,26 (4):265-270.
[13]杨维青,刘晓峰,黄 震.铜绿假单胞茵临床菌株生物被膜的定量分析[J].中国抗生素杂志,2009,34(3):181-183.
[14]Cantero D,Cooksley C,Jardeleza C,et al.A human nasal explant model to study Staphylococcus aureus biofilm in vitro[J].Int Forum Allergy Rhinol,2013,3(7):556-562.
[15]Eberhard J,Pietschmann R,Falk W,et al.The immune response of oral epithelial cells induced by single-species and complex naturally formed biofilms[J].Oral Microbiol Immunol,2009,24(4):325-330.
[16]Kirker KR,James GA,Fleckman P,et al.Differential effects of planktonic and biofilm MRSA on human fibroblasts[J].Wound Repair Regen,2012,20(2):253-261.
[17]Aujla SJ,Dubin PJ,Kolls JK.Th17 cells and mucosal host defense.Semin Immunol,2007,19(6):377-382.
[18]Pradeep Kumar SS,Easwer HV,Maya Nandkumar A.Multiple drug resistant bacterial biofilms on implanted catheters -a reservoir of infection[J].Assoc Physicians India,2013,61(10):702-707.
[19]Alhede M,Bjarnsholt T,Givskov M,et al.Pseudomonas aeruginosa biofilms:mechanisms of immune evasion[J].Adv Appl Microbiol,2014;86:1-40.
