人毛囊干细胞体外培养纤维连接蛋白铺层最佳浓度的实验研究
2015-03-16段惠川曹谊林
吴 巍,段惠川,曹谊林
(上海交通大学医学院附属第九人民医院整复外科,上海 200011)
·论 著·
人毛囊干细胞体外培养纤维连接蛋白铺层最佳浓度的实验研究
吴 巍,段惠川,曹谊林△
(上海交通大学医学院附属第九人民医院整复外科,上海 200011)
目的 探讨最适合人毛囊干细胞体外培养及扩增的纤维连接蛋白(FN)铺层浓度。方法 将新鲜FN稀释至所需要的4个浓度:5 μg/mL、200 ng/mL、10 ng/mL、0 ng/mL。使用酶消化法分离人毛囊细胞,将原代人毛囊干细胞在不同浓度铺层的培养皿中的细胞增值能力和克隆形成率进行统计分析,获得最适合人毛囊干细胞体外培养的铺层浓度。结果 接种同一样本相同数量细胞,做克隆效率测定,在原代培养第8天做Giemsa染色,结果显示0 ng/cm2铺层的培养皿中克隆团小,数量少;10 ng/cm2铺层的克隆团大,数量多;200 ng/cm2和5 μg/cm2铺层的克隆团较小,数量不多。取10个样本,分别对4个FN铺层浓度的克隆效率进行统计分析,10 ng/cm2铺层的克隆效率最高。在不同FN铺层浓度条件下,细胞扩增能力也不同,10 ng/cm2铺层浓度细胞扩增能力最强,与其他3个浓度比较,差异均有统计学意义(P<0.05),200 ng/cm2与其余3个浓度差异均无统计学意义(P>0.05)。结论 10 ng/cm2的FN铺层浓度效果最佳。
毛囊干细胞; 外根鞘; 组织工程; 纤维连接蛋白; 细胞培养
毛囊具有循环更新的能力,这种能力是由毛囊组织中的干细胞,即毛囊干细胞(HFSC)所产生[1]。有研究报道,毛囊干细胞不仅对于皮肤及其附属结构有着再生和修复作用,还能在体外被诱导成骨、软骨、脂肪、肌肉和神经细胞,有望在未来被应用于各类组织的修复[2-3]。但是毛囊干细胞,尤其是其在体外的培养和扩增还无特别有效的方法;提高毛囊干细胞在体外培养过程中干性(stemness)和增殖能力是其研究的基础问题。细胞体外贴壁培养,影响细胞增殖和生物学特性的2个主要因素:一是培养皿(板)的铺层,二是培养液。以往的研究主要通过3T3细胞作为饲养层(铺层)从而改善毛囊干细胞在体外的环境;但是作为小鼠来源的3T3细胞容易混入所饲养的毛囊干细胞中,在未来人体应用时带来安全和伦理隐患。纤维连接蛋白(FN)是皮肤基底膜的主要成分之一,具有促进多种细胞黏附、细胞迁移和生长的作用,其对表皮角质形成细胞黏附的促进作用要强于Ⅳ型胶原和层粘连蛋白[4]。使用FN作细胞铺层,从理论上可模拟体内环境下细胞与细胞外基质接触的状态,为毛囊干细胞提供统一的类似生理状态下的生长环境,可能为一种有效的手段,避免3T3作为滋养层所带来的伦理学问题。因此,本研究旨在寻找最适合人毛囊干细胞黏附的FN铺层浓度,这也是人毛囊干细胞体外培养研究的一个关键技术问题。报道如下。
1 材料与方法
1.1 仪器与试剂 (1)仪器:去离子水系统 (Millipore,美国);恒温CO2培养箱(Forma Scientific,美国);隔水式电热恒温培养箱(上海跃进医疗器械厂,中国);离心机(Thermo,美国);微量精密天平秤(Startorius,德国);精密天平秤(Shangping,中国);倒置相差显微镜(Olympus,日本);荧光显微镜(Nikon,日本);超净工作台(苏州安泰空气技术有限公司,中国);冰箱(海尔,中国);24孔板(BD Falcon,美国);4孔板(BD Falcon,美国);6孔板(BD Falcon,美国); 10 cm 培养皿(BD Falcon,美国);15 mL离心管(BD Falcon,美国); 50 mL离心管(BD Falcon,美国); 0.22 μm针头滤器 (Millipore,美国); 40 μm滤网(BD Falcon,美国);显微外科手术器械(上海手术器械厂,中国);电动移液器(Jencons,英国);Z2粒度计数仪(Beckman Coulter,美国)。(2)试剂:Human Fibronectin(BD,美国);中性蛋白酶(Dispase,Roche,德国);胰蛋白酶、荧光封片剂(Gibco,美国);无血清角质细胞培养基(K-SFM,美国),添加表皮生长因子和牛垂体添加物、F12培养液(Gibco,美国);胎牛血清(Hyclone,美国);维生素、 L-谷氨酰胺(Sigma,美国);青霉素(上海新先锋药业有限公司,中国);链霉素(华北制药股份有限公司,中国);腺嘌呤、氢化可的松、胰岛素(Sigma,美国);各类抗体。
1.2 方法
1.2.1 FN的配制方法和实验分组 在无菌操作下,将FN粉末溶于PBS 中配制终浓度为100 μg/mL,共1 L,4 ℃保存,使用期限为1个月,每次铺层时,新鲜FN稀释至所需的4个浓度:5 μg/mL、200 ng/mL、10 ng/mL、0 ng/mL。
1.2.2 FN铺盘 在培养皿内加入100 μL/cm2的FN溶液,摇晃培养皿至液体均匀铺满皿底;将培养皿放入4 ℃冰箱60 min或者过夜;负压吸除FN溶液,置入37 ℃温箱4~6 h,封口待用(1周内使用)。
1.2.3 人毛囊外根鞘细胞的获取与原代培养 手术(整形外科除皱手术或毛发移植术)获取的健康者头皮样本浸泡于添加双抗的DMEM,4 ℃下保存不超过6 h。头皮样本采用氯霉素及PBS反复冲洗,在解剖显微镜下,剔除皮下脂肪组织,应用手术刀将头皮分剪成(0.25×0.25)cm2的小组织块,加入用DMEM稀释的12.5 mg/mL中性蛋白酶Ⅱ,4 ℃过夜;用显微镊子将表皮完整地去除,然后将完整的生长期毛囊从真皮中拔出,使用PBS冲洗,以防止表皮细胞或真皮细胞的污染。为了得到毛囊单细胞悬液,将取下的毛囊用0.05% 胰酶+0.02%EDTA在 37 ℃下消化15 min,然后用含有10% FBS的DMEM液终止消化。反复吹打后,将细胞悬液通过40 μm滤网得到单细胞悬液,并将细胞悬液600 r/min离心5min,弃上清液,加入新鲜K-SFM培养液,重悬细胞,计数。按照1×104/cm2的接种密度将细胞种入无铺层的6孔板中,放入含5% 二氧化碳的37 ℃培养箱培养。
1.2.4 无滋养层无血清培养基K-SFM培养人毛囊干细胞及其传代扩增 将消化所得的原代毛囊细胞按照1×104/cm2接种于事前铺层好的4孔板中,采用无血清的角化上皮细胞培养基K-SFM培养。当细胞扩增到80%汇合时,以0.05% 胰酶消化细胞,37 ℃ 1~3 min,使用10% FBS终止消化,刮下细胞后收集细胞悬液离心(600 r/min,5 min),弃上清液,加入新鲜K-SFM培养液,重悬细胞,计数。按照同样的接种密度将细胞种入事前铺层的培养皿中。放入含5% 二氧化碳的37 ℃培养箱培养,按照同样方法传代直至细胞停止扩增为止。
1.2.5 细胞计数 使用毛囊细胞培养基重悬细胞,将细胞混匀后,吸出10 μL用血细胞计数板计数3次取平均值。每次传代时采用血细胞计数板计数3次,取平均值。
1.2.6 Giemsa染色 取Giemsa染料3.8 g,置玛瑙乳钵中,加少量甲醇研磨,逐渐加甲醇至375 mL,溶解后再加125 mL 纯甘油,于37 ℃温箱保温48 h;在此期间摇动数次,放置1~2 周过滤,制成Giemsa储存液(10×)。使用前,临时配置Giemsa工作液:取1 mL 储存液加入9 mL PBS,混匀后方可使用。吸干培养皿内培养液,PBS漂洗1次,加入4%多聚甲醛溶液室温下固定10 min,吸除固定液后加入Giemsa工作液100 μL/cm2,室温下静置10~15 min后吸出工作液,PBS漂洗3~5次,晾干。

1.2.8 细胞增殖能力 将同一样本的毛囊细胞原代按照1×104/cm2接种在不同FN浓度铺层的培养皿中,K-SFM培养第8天时,用0.05%胰酶消化细胞,计数细胞数量(计数3次取平均值作为P0-D8的细胞数),通过公式分别计算出不同浓度FN铺层的增殖能力。
1.2.9 免疫荧光鉴定 负压吸除毛囊细胞培养液,加入37 ℃预热的4%多聚甲醛溶液,室温固定10 min;PBS漂洗3次,每次3 min;10%羊血清(或兔血清)室温封闭30 min;加入1抗4 ℃孵育过夜;PBS漂洗3次,每次5 min;加入2抗,37 ℃孵育60 min;PBS漂洗3次,每次5 min;Hoechst 33342(1∶1 000)核衬染10 s或者DAPI(1∶500)核衬染10 s,PBS漂洗5 min 1次;荧光封片剂封片,荧光显微镜观察及拍摄照片。
1.3 统计学处理 采用SPSS 13.0统计软件进行分析,使用Mann-WhitneyU检验,统计量为Z,P<0.05为差异有统计学意义。
2 结 果
2.1 人毛囊干细胞的获取与原代培养 经酶消化后,所获得的细胞接种于不同FN浓度铺层的培养皿,20 min可见有部分细胞贴壁,大约在24 h后,大多数细胞已经贴壁,呈圆形,没有伸展,在第2~3天,贴壁细胞逐渐伸展,绝大多数细胞最终形成铺路石样的细胞,细胞较小,呈圆形或多角形,核浆比例小,胞核圆,细胞形成小的克隆团,但有极少量细胞呈椭圆形或梭形生长,5~7 d迅速生长成较大克隆团。见图1。

图1 不同浓度FN铺层对人毛囊干细胞体外培养的影响
2.2 细胞克隆效率检测4种不同浓度FN铺层 接种同一样本相同数量细胞,做克隆效率检测,在原代培养第8天做Giemsa染色,结果显示,0 ng/cm2的铺层的培养皿中克隆团小,数量少;10 ng/cm2铺层的克隆团大,数量多;200 ng/cm2和5 μg/cm2铺层的克隆团较小,数量不多。取10个样本,分别对4个FN铺层浓度的克隆效率进行统计分析,结果表明,10 ng/cm2铺层的克隆效率最高。见图2。
2.3 不同FN 浓度对人毛囊干细胞扩增能力的影响 在不同FN铺层浓度条件下,细胞扩增能力也不同,经统计分析提示,10 ng/cm2铺层浓度细胞扩增能力最强,与其他3个浓度比较,差异均有统计学意义(P<0.05),200 ng/cm2与其他3个浓度差异均无统计学意义(P>0.05)。见图3。

图2 不同浓度FN铺层对人毛囊干细胞克隆效率的影响
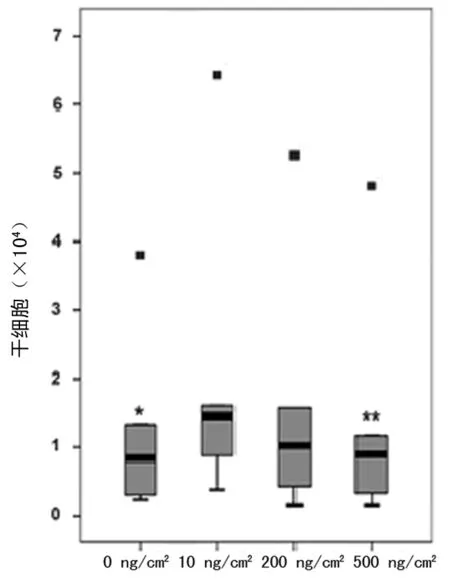
图3 不同浓度FN铺层对人毛囊干细胞体外扩增的影响
3 讨 论
为了满足组织工程构建等对种子细胞数量的要求,寻找一种可以促进人毛囊细胞体外增殖但保持良好生物学性能的培养方法显得十分重要。
以往的研究报道中较常用的是用抑制过的3T3细胞作滋养层、FAD作为培养基(其中添加很多细胞生长所需的营养物质)培养毛囊干细胞的培养方法[5]。但是由于3T3是小鼠细胞,可能混入最终获得的人毛囊干细胞,因此在伦理学和免疫排斥等方面都有不容忽视的问题。而以人成纤维细胞作为滋养层要求成纤维细胞应在有丝分裂的后期,其技术更不易掌控,很难为每次传代提供非常标准统一的滋养层条件[6-7]。
本组前一部分研究采用无血清、无滋养层的培养方法,但发现在该种培养体系过程中,CK15、FST、CK19等人毛囊干细胞标志物阳性ORS细胞会迅速减少,这可能是本组所采用的KSFM无血清培养基不能提供毛囊干细胞所需的体外生长环境[8-10]。因此,本组使用改良该种培养方法,满足人毛囊干细胞临床应用的需求。影响体外培养细胞生长有2个主要因素:一是培养皿(板)的铺层,二是培养液。因此,本组首先采用对表皮类细胞黏附及增殖较为有效的FN来改善其铺层。皮肤基底层主要由Ⅳ型胶原、FN、层粘连蛋白(laminin)等组成。其中FN作为皮肤基底膜的主要成分之一,能与细胞表面特异性受体以及细胞外基质中其他大分子结合,对细胞与细胞外基质之间的黏附以及细胞外基质有序结构的组建起重要作用[11]。FN是一种大型的糖蛋白,存在于所有脊椎动物,分子含糖4.5%~9.5%,糖链结构依组织细胞来源及分化状态而异。FN可将细胞连接到细胞外基质上。FN以可溶形式存在于血浆及各种体液中;以不溶形式存在于细胞外基质及细胞表面。前者总称血浆FN;后者总称细胞FN。每条FN肽链约含2 450个氨基酸残基,整个肽链由3种类型(Ⅰ、Ⅱ、Ⅲ)的模块(module)重复排列构成。具有5~7个有特定功能的结构域,由蛋白酶敏感的肽段连接。这些结构域中有些能与其他ECM(如胶原、蛋白聚糖)结合,使细胞外基质形成网络;有些能与细胞表面的受体结合,使细胞附着ECM。FN肽链中的一些短肽序列为细胞表面的各种FN受体识别与结合的最小结构单位。如在FN肽链中央与细胞相结合的模块中存在RGD(Arg-Gly-Asp)序列,是细胞表面某些整合素受体识别与结合的位点[12]。
大量文献报道显示FN可以促进多种细胞黏附、增殖[13-14]。由于表皮类干细胞均坐落于基底膜上,只有在发生分化后逐渐与基底膜分离,向上迁移[15]。有研究者利用这一特征将未分选的表皮角质形成细胞悬液接种于包被有Ⅳ型胶原、纤维粘连蛋白、层粘连蛋白等的培养皿上进行分选[16]。结果提示,在Ⅳ型胶原上黏附20 min后收获的细胞占全部基底层细胞的10%;纤维粘连蛋白上黏附5 min后获得的细胞占全部基底层细胞的28%;快速黏附于层粘连蛋白上的细胞克隆形成能力没有明显增加。人毛囊干细胞主要富集于人毛囊隆突部外跟鞘[17-18]。所以本组实验选择FN作为铺层,观察其是否促进ORS细胞的黏附和增殖,结果表明FN铺层比不铺层促进人毛囊ORS细胞黏附、增殖。由此认为,人FN铺层可以作为一种有效的促进人毛囊干细胞黏附、增殖的方法,可代替3T3滋养层,避免传统方法使用3T3滋养层培养人毛囊干细胞有异种细胞混入的一系列问题。
FN的常用浓度为5 μg/cm2,但是在使用该浓度时发现细胞黏附虽然较快,但是细胞形态变大,老化明显,且不呈克隆样生长。所以本实验降低了FN浓度,并且比较了4个不同数量级FN浓度对人毛囊干细胞黏附和增殖能力的影响,取得最佳FN浓度范围。但是FN的常用浓度5 μg/cm2不如10 ng/cm2适合毛囊干细胞的生长,这个原因尚有待于进一步研究。
[1]Alonso L,Fuchs E.The hair cycle[J].J Cell Sci,2006,119(Pt 3):391-393.
[2]Panagiotis M,Stelios T,Andreadis C.Hair follicle:a novel source of multipotent stem cells for tissue engineering and regenerative medicine[J].Tissue Eng Part B Rev,2013,19(4):265-278.
[3]Shan CC,Sung JL,Chih C C,et al.Therapeutic strategy for hair regeneration:hair cycle activation,niche environment modulation,wound-induced follicle neogenesis and stem cell engineering[J].Expert Opin Biol Ther,2013,13(3):377-391.
[4]Adams JC,Watt FM.Expression of beta 1,beta 3,beta 4,and beta 5 integrins by human epidermal keratinocytes and non-differentiating keratinocytes[J].J Cell Biol,1991,115(3):829-841.
[5]Hattori Y,Maitani Y.DNA/Lipid complex incorporated with fibronectin to cell adhesion enhances transfection efficiency in prostate cancer cells and xenografts[J].Biol Pharm Bull,2007,30(3):603-607.
[6]Evans AR,Euteneuer S,Chavez E,et al.Laminin and fibronectin modulate inner ear spiral ganglion neurite outgrowth in an in vitro alternate choice assay[J].Dev Neurobiol,2007,67(13):1721-1730.
[7]Limat A,Hunziker T,Boillat C,et al.Post-mitotic human dermal fibroblasts efficiently support the growth of human follicular keratinocytes[J].J Invest Dermatol,1989,92(5):758-762.
[8]Lyle S,Christofidou-Solomidou M,Liu Y,et al.The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells[J].J Cell Sci,1998,111(Pt 21):3179-3188.
[9]Ohyama M,Terunuma A,Tock CL,et al.Characterization and isolation of stem cell-enriched human hair follicle bulge cells[J].J Clin Invest,2006,116(1):249-260.
[10]Limat A,Hunziker T,Boillat C,et al.Post-mitotic human dermal fibroblasts efficiently support the growth of human follicular keratinocytes[J].J Invest Dermatol,1989,92(5):758-762.
[11]Hynes RO,Zhao Q.The evolution of cell adhesion[J].J Cell Biol,2000,150(2):89-96.
[12]Orly J,Sato G.Fibronectin mediates cytokinesis and growth of rat follicular cells in serum-free medium[J].Cell,1979,17(2):295-305.
[13]Huebsch JB,Fields GB,Triebes TG,et al.Photoreactive analog of peptide FN-C/H-V from the carboxy-terminal heparin-binding domains of fibronectin supports endothelial cell adhesion and spreading on biomaterial surfaces[J].J Biomed Mater Res,1996,31(4):555-567.
[14]Simpson KH,Bowden MG,Hook M,et al.Measurement of adhesive forces between sepidermidis and fibronectin-coated surfaces using optical tweezers[J].Lasers Surg Med,2002,31(1):45-52.
[15]Hardy MH.The secret life of the hair follicle[J].Trends Genet,1992,8(2):55-61.
[16]Adams JC,Watt FM.Expression of beta 1,beta 3,beta 4,and beta 5 integrins by human epidermal keratinocytes and non-differentiating keratinocytes[J].J Cell Biol,1991,115(3):829-841.
[17]Ohyama M.Hair follicle bulge:a fascinating reservoir of epithelial stem cells[J].J Dermatol Sci,2007,46(2):81-89.
[18]Panteleimon R,Valentina G.Stem cell dynamics in the hair follicle niche[J].Semin Cell Dev Biol,2014,30(1):34-42.
The experimental study of the most suitable for human hair follicle stem cell adhesion of fibronectin concentrations*
WUWei,DUANHui-chuan,CAOYi-lin△
(DepartmentofPlasticandReconstructiveSurgery,ShanghaiNinthPeople′sHospital,ShanghaiJiaoTongUniversitySchoolofMedicine,Shanghai200011,China)
Objective To find the most suitable for human hair follicle stem cell adhesion of fibronectin (fibronectin,FN) concentrations.Methods The fresh fibronectin diluted to the desired concentration.The experiment is divided into the following four concentrations:5 μg/mL,200 ng/mL,10 ng/mL,0 ng/mL.Using enzyme digestion isolated from human hair follicle cells,the original generation of value-added hair follicle stem cells and cloning efficiency in a dish with different concentrations of plies,statistical analysis ply concentration most suitable for human follicle stem cells cultured in vitro.Results The same number of cells seeded in the same sample,do the cloning efficiency was measured in the first eight days of primary culture do Giemsa staining results:dish plies 0 ng/cm2of cloned groups of small,small number; 10 ng/cm2Overlay dish,cloning large group and number,the smaller the dish 200 ng/cm2and 5 μg/cm2plies cloned groups a small number.Take 10 samples,respectively,four FN Overlay concentration cloning efficiency statistical analysis found that,10 ng/cm2overlay genomic clone for maximum efficiency.10 ng/cm2overlay the strongest concentration of cell proliferation,and the other three groups were statistically significant,200 ng/cm2and the rest 3 group of concentrations were not statistically different.Conclusion 10 ng/cm2concentration is the best FN overlay.
hair follicle stem cells; external root shealth; tissue engineering; fibronectin; cell culture
国家自然科学基金项目(31271046)。
吴巍,女,博士,主治医师,主要从事毛囊干细胞的实验研究。△
,E-mail:caoyilin169@126.com。
10.3969/j.issn.1672-9455.2015.12.002
A
1672-9455(2015)12-1661-04
2015-01-25
2015-04-22)
