熊果酸对顺铂致毒小鼠耳蜗瞬时感受器电位香草酸受体1表达的影响*
2015-03-16邸阳于利田原林宇涵王爱梅
邸阳 于利 田原 林宇涵 王爱梅
熊果酸对顺铂致毒小鼠耳蜗瞬时感受器电位香草酸受体1表达的影响*
邸阳1于利1田原1林宇涵1王爱梅1
目的 研究熊果酸(ursolic acid,UA)对顺铂(cisplatin,CDDP)致毒小鼠耳蜗瞬时感受器电位香草酸受体1(transient receptor potential vanilloid 1,TRPV1)表达的影响。方法 60只健康BALB/c小鼠随机分成对照组(腹腔注射等量生理盐水)、UA组(腹腔注射熊果酸80 mg/kg)、CDDP组(腹腔注射CDDP 4.5 mg/kg)和CDDP +UA组(一侧腹腔注CDDP 4.5 mg/kg,同时对侧腹腔注射熊果酸80 mg/kg),每组15只。各组动物均连续腹腔注射给药5天,每天1次,给药前及停药后24 h行ABR检测,然后应用免疫组织化学染色、显微图像分析及蛋白质印迹技术观察小鼠耳蜗中TRPV1的表达。结果 CDDP组小鼠耳蜗TRPV1表达和ABR阈移均较对照组明显增加(P<0.05),UA+CDDP组小鼠ABR阈移及TRPV1表达较CDDP组明显降低(P<0.05),且TRPV1表达变化与ABR阈移改变高度相关(|r|>0.7,P<0.05)。结论 UA可抑制CDDP所致TRPV1的高表达,有效降低CDDP的耳毒性,改善听功能。
熊果酸; 顺铂; 耳蜗; 瞬时感受器电位香草酸受体1
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20140911.0902.014.html
瞬时感受器电位香草酸受体1(transient receptor potential vanilloid 1,TRPV1)是瞬时感受器电位(transient receptor potential,TRP)通道家族成员之一,可在哺乳动物耳蜗中表达,参与耳蜗的敏感性调节,维持耳蜗内环境的动态平衡[1,2]。近年来的研究表明,耳毒性药物顺铂(cisplatin,CDDP)可诱导TRPV1在耳蜗中高表达,进而促进活性氧簇(reactive oxygen species,ROS)的过量生成并进一步引发脂质过氧化,最终导致听力损失[3]。熊果酸(ursolic acid,UA)是一种在植物界分布较广的三萜类化合物,具有抗氧化、抗炎等多种作用[4,5],临床上已用于治疗病毒性肝炎并取得较好疗效。然而,UA是否也能有效防护CDDP的耳毒性,以及其防护作用是否与TRPV1有关,目前尚不明确。因此,本研究拟通过观察UA对CDDP致毒小鼠耳蜗TRPV1表达的影响,探讨UA对CDDP耳毒性的防护作用及可能机制。
1 材料与方法
1.1 实验材料 实验动物为健康BALB/c小鼠60只,体重20~25 g,雌雄不限,耳廓反射正常,由大连医科大学实验动物中心提供;UA购自南京译朗医药科技有限公司;兔抗TRPV1多克隆抗体和辣根过氧化物酶标记羊抗兔IgG购自英国Abcam公司;预染蛋白Marker购于美国NEB公司;Smart EP&OAE听觉诱发电位-耳声发射记录系统由美国IHS公司生产;Mini-PROTEAN蛋白电泳仪和Trans-Blot SD半干转印槽由美国BIO-RAD公司生产;IBOX-600全自动凝胶成像系统由美国UVP公司生产。
1.2 实验方法
1.2.1 实验动物分组及处理 将60小鼠随机分成对照组、UA组、CDDP组和CDDP+UA组,每组15只(30耳)。CDDP组腹腔注射顺铂4.5 mg/kg[6],UA组腹腔注射熊果酸80 mg/kg,CDDP+ UA组腹腔注射顺铂4.5 mg/kg,同时在对侧腹腔注射熊果酸80 mg/kg,对照组腹腔注射等量生理盐水;四组动物均连续给药5 d,每天1次。
1.2.2 ABR测试 各组动物于给药前及停药后24 h分别测试ABR。应用听觉诱发电位-耳声发射记录系统给予短纯音(tone burst)刺激,重复率39.1次/秒,带通滤波100~1 500 Hz,叠加1 024次,扫描时程16.0 ms。声刺激强度从95 dB SPL开始,以3 d B逐次递减,以刚出现ABR波Ⅰ并至少重复两次的最小声刺激强度判定为反应阈,记录8、12和24 k Hz三个频率的ABR反应阈值;根据同一刺激频率下给药前后的反应阈差值计算ABR阈移[7]。
1.2.3 耳蜗石蜡切片标本制备 待各组动物停药并测试完ABR后,每组任取6只小鼠立即断头处死,速取听泡。充分暴露耳蜗后,显微镜下刺破圆窗和卵圆窗,蜗尖钻孔并缓慢灌流含4%多聚甲醛的0.1 mol/L PBS(p H 7.4),并将标本浸入该固定液中4℃下24 h;经PBS冲洗后放入4%EDTA中,4℃下脱钙3~5 d。标本经梯度乙醇脱水、二甲苯透明、常规石蜡包埋后,沿蜗轴正中行5μm连续切片。
1.2.4 免疫组织化学染色 耳蜗切片60℃下烘烤1 h后,常规脱蜡至水;PBS浸泡5 min,EDTA修复液高压修复2 min;3%H2O2孵育10 min后,以正常血清封闭液室温下孵育切片15 min,然后滴加抗TRPV1抗体(1:200稀释),4℃过夜;取出切片用PBS冲洗后,滴加二抗,37℃孵育15 min;PBS冲洗后滴加SABC复合物,37℃孵育15 min,PBS冲洗。DAB显色,苏木素复染,脱水,透明,封片,显微镜下观察结果并照相。对照染色切片用PBS代替一抗,其他步骤不变。TRPV1阳性反应产物呈棕黄色颗粒。
1.2.5 显微图像分析 每组随机取10张图片,应用Image-Pro Plus 6.0软件在同等条件下测量各组耳蜗外毛细胞(outer hair cell,OHC)TRPV1阳性反应产物的光密度值。光密度值越大,表示阳性反应越强烈。
1.2.6 蛋白质印迹检测 完成ABR测试后,将各组剩余9只小鼠立即断头处死,速取听泡。体视显微镜下取出双侧耳蜗组织,向标本中加入RIPA裂解液,15 min后4℃下离心10 min(12 000rpm/min);取上清并测定蛋白含量。灌胶后上样,SDS聚丙烯酰胺凝胶电泳后转膜,加入含10%牛血清白蛋白封闭液,37℃下摇床孵育1 h;加入抗TRPV1抗体(1:1 000稀释),4℃过夜;TBST(Tris-Buffered Saline and Tween 20)洗涤缓冲液冲洗后,加入辣根过氧化物酶标记二抗(1:2 000稀释),4℃下摇床孵育1 h,TBST冲洗后滴加ECL化学发光剂,即可见成像条带;采用全自动凝胶成像系统对电泳条带进行分析,读取各电泳条带的灰度值,以β-actin作为内参照物,TRPV1/β-actin比值代表TRPV1的蛋白表达水平。
1.3 统计学方法 采用SPSS 17.0统计软件进行数据分析,各组之间数据比较均采用单因素方差分析及LSD检验,另对CDDP组和CDDP+UA组TRPV1阳性反应的平均光密度值与ABR阈移的关系做直线相关检验,检验水准α=0.05。
2 结果
2.1 各组小鼠ABR阈移比较 由表1可见,CDDP组小鼠各频率ABR阈移较对照组明显增大(P<0.01),CDDP+UA组小鼠ABR阈移较CDDP组明显减小(P<0.05),UA组与对照组小鼠ABR阈移无明显差异。
2.2 各组小鼠耳蜗TRPV1表达比较
2.2.1 各组免疫组织化学染色结果 光镜下可见对照组小鼠耳蜗OHC中TRPV1的阳性染色较弱(图1a),UA组的阳性染色与对照组基本相同(图1b),而CDDP组的阳性染色较对照组明显加深(图1c),CDDP+UA组的阳性染色则较CDDP组明显减弱(图1d);显微图像分析结果显示,对照组TRPV1阳性反应的平均光密度值为0.04±0.01,而CDDP组的平均光密度值为0.41±0.07,明显高于对照组(P<0.01);CDDP+UA组TRPV1阳性反应的平均光密度值(0.22±0.02)较CDDP组明显减小(P<0.01),UA组的平均光密度值为0.05± 0.01,与对照组差异无统计学意义(P>0.05)。
表1 各组小鼠各频率ABR阈移(dB,±s,n=30耳)
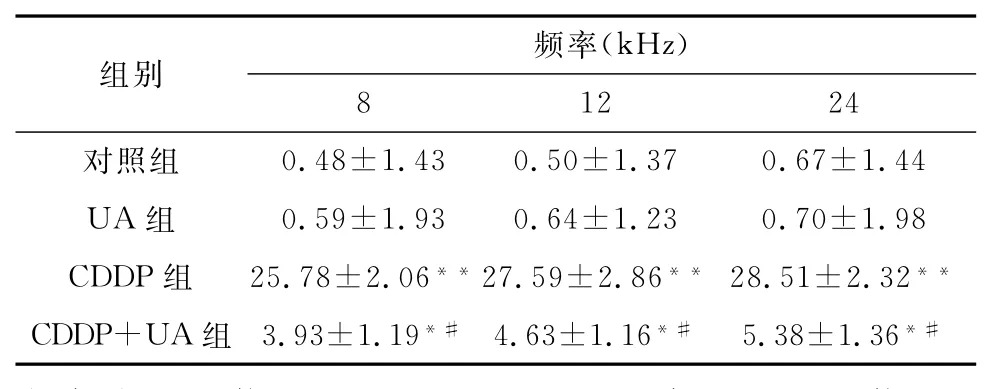
表1 各组小鼠各频率ABR阈移(dB,±s,n=30耳)
注:与对照组比较,*P<0.05,**P<0.01;与CDDP组比较,#P<0.01

图1 各组小鼠耳蜗底回OHC TRPV1的表达
2.2.2 各组蛋白质印迹检测结果 对照组和UA组小鼠耳蜗TRPV1的电泳条带较弱,而CDDP组小鼠耳蜗TRPV1的电泳条带明显深于对照组;CDDP+UA组小鼠耳蜗TRPV1的电泳条带则较CDDP组明显减弱(图2)。半定量分析结果显示,对照组TRPV1/β-actin比值为0.09±0.01,而CDDP组为0.67±0.03,明显高于对照组(P<0.05);CDDP+UA组TRPV1/β-actin比值为0.29±0.01,较CDDP组明显减小(P<0.01),UA组TRPV1/β -actin比值为0.09±0.01,与对照组相同。
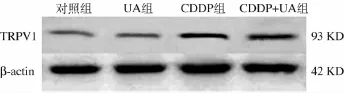
图2 各组小鼠耳蜗TRPV1电泳条带
2.3 CDDP组和CDDP+UA组小鼠TRPV1阳性反应的平均光密度值与ABR阈移的关系 直线相关检验结果显示,小鼠耳蜗TRPV1阳性反应的平均光密度值与各刺激频率下ABR阈移均显著相关(P<0.05或P<0.01),表明TRPV1表达越强,ABR阈移越大(表2)。
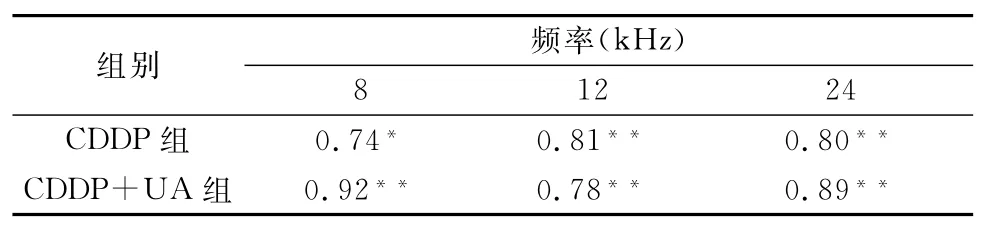
表2 CDDP组和CDDP+UA组小鼠耳蜗OHC中TRPV1阳性反应的平均光密度值与ABR阈移的相关系数
3 讨论
目前认为,顺铂所致听力损失与其诱导耳蜗细胞凋亡密切相关,而活性氧(ROS)在诱导耳蜗细胞凋亡的过程中发挥了重要作用。近年来的研究[8]表明,顺铂可诱导TRPV1在耳蜗中的高表达,进而促进ROS的过量生成并进一步引发脂质过氧化,从而产生高毒性的脂质过氧化产物4-羟基壬烯醛(4-hydroxynonenal,4-HNE),随后导致耳蜗细胞凋亡,听力损失。另有研究[3,6]显示,顺铂通过诱导TRPV1高表达,引起Ca2+内流和超载,超载的Ca2+再激活中性半胱氨酸蛋白酶(calpain),进而降解细胞骨架、膜蛋白以及各种激酶,最终导致耳蜗细胞凋亡。
TRPV1是TRPV亚家族中首个被克隆的通道蛋白,也是目前研究最多的TRP家族成员之一[9],近年来发现,TRPV1在介导耳蜗病理生理学过程等方面具有重要作用[10~12]。Mukherjea等[10]观察到鼓室内注射TRPV1激动剂辣椒素24 h后,可造成大鼠听觉暂时性阈移;Ishibashi等[11]报道经庆大霉素(gentamicin,GM)处理后的小鼠耳蜗毛细胞中TRPV1的表达明显增强;Lee等[12]也证实GM可通过TRPV1进入新生大鼠耳蜗毛细胞中,从而对耳蜗毛细胞造成损伤。由此表明,TRPV1介导了GM的耳毒性。本研究结果显示,给小鼠连续5天腹腔注射CDDP后,CDDP组小鼠耳蜗OHC中TRPV1的表达较对照组明显增强,并且与ABR阈移增大高度相关,表明TRPV1也参与了CDDP的耳毒性。
UA又名乌索酸、乌苏酸,广泛分布于熊果、陆英、山楂等60余种植物中,具有很强的抗氧化作用,近年来已受到国际医药学界的高度重视。研究表明,UA可通过抑制ROS生成、DNA断裂等机制,有效防护β-淀粉样肽对大鼠肾上腺嗜铬细胞瘤(pheochromocytoma-derived cell line,PC)12细胞的神经毒性效应[13]。Yu等[14]观察到,UA可通过抑制脂质过氧化和增强过氧化氢酶、谷胱甘肽过氧化物的活性,从而有效防护过氧化氢对耳蜗毛细胞株(house ear institue,organ of corti 1,HEI-OCI)的毒性效应;最近研究显示,UA可有效抑制TRPV1的激活,从而发挥止咳作用[15]。本研究观察到CDDP+UA组小鼠耳蜗OHC中TRPV1的阳性表达明显弱于CDDP组,同时该组小鼠ABR阈移也显著减小,并且与TRPV1表达下调高度相关;蛋白质印迹检测结果也显示CDDP+UA组小鼠耳蜗TRPV1蛋白表达水平较CDDP组明显降低,表明UA可显著抑制CDDP所致TRPV1的高表达,从而有效拮抗CDDP的耳毒性,改善听功能。
综上所述,TRPV1介导了CDDP对BALB/c小鼠的耳毒性损伤,UA可抑制CDDP所致TRPV1的高表达;UA组小鼠ABR阈移和TRPV1表达均与对照组无明显差别,表明UA安全无毒,具有良好的临床应用前景。UA可下调CDDP致毒小鼠耳蜗TRPV1表达的具体机制有待于今后更深入的研究。
1 Zheng J,Dai C,Steyger PS,et al.Vanilloid receptors in hearing:altered cochlear sensitivity by vanilloids and expression of TRPV1 in the organ of corti[J].J Neurophysiol,2003,90:444.
2 才岩,王爱梅,于利,等.瞬时受体电位通道蛋白A1和V1在正常小鼠耳蜗中的定位表达[J].中国现代医学杂志,2012,22:1.
3 Mukherjea D,Jajoo S,Whitworth C,et al.Short interfering RNA against transient receptor potential vanilloid 1 attenuates cisplatin-induced hearing loss in the rat[J].J Neurosci,2008,28:13056.
4 Tsai SJ,Yin MC.Antioxidative and anti-inflammatory protection of oleanolic acid and ursolic acid in PC12 cells[J].J Food Sci,2008,73:174.
5 Checker R,Sandur SK,Sharma D,et al.Potent anti-inflammatory activity of ursolic acid,a triterpenoid antioxidant,is mediated through suppression of NF-κB,AP-1 and NFAT[J].PLoS One,2012,7:e31 318.
6 Chang L,Wang AM.Calpain mediated cisplatin-induced ototoxicity in mice[J].Neural Regen Res,2013,8:1 995.
7 Wang AM,Hou N,Bao DY,et al.Mechanism of alpha-lipoic acid in attenuating kanamycin-induced ototoxicity[J]. Neural Regen Res,2012,7:2793.
8 Lee JE,Nakagawa T,Kim TS,et al.Role of reactive radicals in degeneration of the auditory system of mice following cisplatin treatment[J].Acta Otolaryngol,2004,124:1131.
9 Ho KW,Ward NJ,Calkins DJ.TRPV1:a stress response protein in the central nervous system[J].Am J Neurodegener Dis,2012,1:1.
10 Mukherjea D,Jajoo S,Sheehan K,et al.NOX3 NADPH oxidase couples transient receptor potential vanilloid 1 to signal transducer and activator of transcription 1-mediated inflammation and hearing loss[J].Antioxid Redox Signal,2011,14:999.
11 Ishibashi T,Takumida M,Akagi N,et al.Changes in transient receptor potential vanilloid(TRPV)1,2,3 and 4 expression in mouse inner ear following gentamicin challenge[J].Acta Otolaryngol,2009,129:116.
12 Lee JH,Park C,Kim SJ,et al.Different uptake of gentamicin through TRPV1 and TRPV4 channels determines cochlear hair cell vulnerability[J].Exp Mol Med,2013,45:e12.
13 Hong SY,Jeong WS,Jun M.Protective effects of the key compounds isolated from corni fructus againstβ-amyloidinduced neurotoxicity in PC12 Cells[J].Molecules,2012,17:10831.
14 Yu HH,Hur JM,Seo SJ,et al.Protective effect of ursolic acid from Cornus officinalis on the hydrogen peroxide-induced damage of HEI-OC1 auditory cells[J].Am J Chin Med,2009,37:735.
15 Zhang Y,Sreekrishna K,Lin Y,et al.Modulation of transient receptor potential(TRP)channels by Chinese herbal extracts[J].Phytother Res,2011,25:1666.
(2014-04-16收稿)
(本文编辑 李翠娥)
The Effects of UrsoIic Acid on CispIatin-Induced Expression of Transient Receptor PotentiaI VaniIIoid 1 in Mouse CochIea
Di Yang,Yu Li,Tian Yuan,Lin Yuhan,Wang Aimei
(Department of physioIogy,Liaoning MedicaI University,Jinzhou,121001,China)
Objective To investigate the effects of ursolic acid(UA)on cisplatin(CDDP)-induced expression of transient receptor potential vanilloid 1(TRPV1)in mouse cochlea.Methods Sixty BALB/c mice were randomly divided into 4 groups(15 mice in each group)and
introperitoneal injection once daily for 5 days:Control group(normol saline),UA group(80 mg/kg/day),CDDP group(4.5 mg/kg/day),and CDPP(4.5 mg/kg/day)plus UA group(80 mg/kg/day).The expression of TRPV1 in mouse cochlea was determined by immunohistochemistry,microscope image analysis and western blot,and auditory thresholds were evaluated by auditory brainstem response(ABR)measurement.ResuIts The expression of cochlea TRPV1 and ABR threshold shift was significantly increased in the mice treated with CDDP(P<0.05),as compared with control mice.These effects were prevented by UA treatment(all P<0.05).Furthermore,a linear relationship analysis revealed that the expression of cochlea TRPV1 was significantly correlated with ABR threshold shift(|r|>0.7,P<0.05).ConcIusion
UA effectively attenuated CDDP-induced ototoxicity and improved auditory function through inhibition of TRPV1.
Ursolic acid; Cisplatin; Cochlea; Transient receptor potential vanilloid 1
10.3969/j.issn.1006-7299.2015.01.014
时间:2014-9-11 9:02
R764.43
A
1006-7299(2015)01-0057-04
* 辽宁省科学技术计划项目(2011225015)
1 辽宁医学院生理学教研室(锦州 121001)
邸阳,男,辽宁人,讲师,硕士在读,研究方向:听觉生理与病理。
王爱梅(Email:aimeiwang88@163.com)
·听力康复·
