HBV相关慢加急性肝衰竭免疫病理发病机制研究进展*
2015-03-15李晓东综述徐东平审校
李晓东 综述,徐东平 审校
肝衰竭是由多种因素引起的严重肝脏损害,导致肝脏合成、解毒、排泄和生物转化等功能发生严重障碍或失代偿,出现以凝血机制障碍和黄疸、肝性脑病、腹水等为主要表现的一组临床症候群[1],病死率极高。在我国,引起肝衰竭的首要病因是乙型肝炎病毒(HBV)感染。HBV相关慢加急性肝衰竭(HBV-ACLF)的发生与发展主要受病毒和宿主两方面因素及其相互作用的影响,其中病毒诱发的机体免疫病理损伤在肝衰竭的发生发展中起重要作用。研究表明,在肝衰竭的发病过程中,存在着“二次打击”现象,即各种致肝损伤因素通过各自特异机制造成肝损伤,称为原发性肝损伤,为对肝脏的初次打击,肝炎病毒所致的肝损伤主要是细胞毒性T淋巴细胞(CTL)攻击细胞表面表达HBV抗原的靶细胞,导致肝细胞溶解和凋亡。由于原发性肝损伤造成的肠源性内毒素血症激活库普弗细胞,释放多种化学介质,所致的继发性肝损伤则是对肝脏的二次打击。原发性肝损伤和继发性肝损伤相互叠加,导致了大量的肝细胞死亡,发生肝功能衰竭。也有学者提出HBV导致的肝衰竭依次经受了免疫损伤、缺血缺氧性损伤和内毒素血症的“三重打击”学说[2]。这两种学说都认为以CTL为中心的免疫病理损伤是肝衰竭发生的关键因素。近年来,随着病毒学、免疫学和分子生物学等学科技术的不断发展,对于肝衰竭的发病机制取得了一些新的进展,以下主要对HBV-ACLF的免疫病理发病机制研究进展做一综述。
HBV本身并不能引起肝细胞损伤。在慢性肝病的基础上,患者在受到疲劳、肝损伤药物、酒精等触发因素刺激后,引起的宿主免疫应答强弱以及免疫调节的力度决定着HBV-ACLF的转归。病毒性肝炎引起的免疫损伤以细胞免疫为主,以体液免疫为辅。细胞免疫过程的主要环节如图1所示。ACLF是机体免疫系统对HBV的过激反应,CTL的特异性损伤、其它免疫活性细胞如NK、NKT、库普弗细胞等非特异性损伤以及大量炎症细胞因子急剧增多引起的急性系统性炎性反应是诱发ACLF的重要因素。机体免疫反应在ACLF发生和发展的各个主要环节发挥着重要作用。
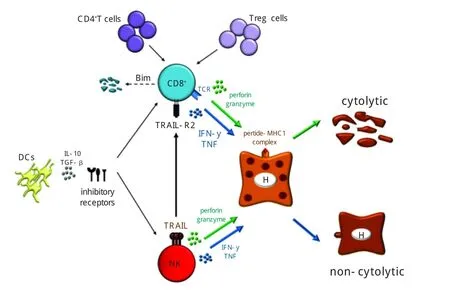
图1 参与清除病毒的机体免疫细胞和细胞因子
1 抗原递呈
树突状细胞(DC)是机体功能最强的专职抗原递呈细胞(APC),它能高效地摄取、加工处理和递呈抗原。成熟DC能有效激活CTL和Th细胞,其释放的细胞因子能够刺激NK细胞,诱导Th1细胞分泌细胞因子并促进CTL增殖。DC细胞处于启动、调控、并维持免疫应答的中心环节[3]。DC细胞可分为两大类:即肝内浆细胞样DC细胞(pDCs)和髓细胞样DC细胞(mDCs)。Zhang[4]分析了11例ACLF患者肝组织不同DC细胞的数量、表型和功能,结果显示患者肝组织内有大量pDCs和mDCs浸润,肝组织内激活的pDCs能够分泌IFN-α,随后通过Toll样受体(TLR)-9配体诱导淋巴细胞分泌IL-12和IL-10。然而,多数ACLF患者外周血pDCs数量和IFN-α分泌均显著减少,尤其是在死亡患者中这种现象更常见。上述结果提示ACLF患者外周血pDCs大量聚集到肝组织并被激活,显著加强抗原递呈作用,增强机体的免疫反应的力度,最终参与造成大量肝细胞死亡的免疫病理损伤。
单核细胞也是重要的抗原递呈细胞。在ACLF早期和晚期患者血单核细胞均可检测到人类白细胞抗原(HLA)-DR和TLR4表达。Xing研究发现[5],HBV-ACLF患者单核细胞HLA-DR表达水平明显低于慢性乙型肝炎和HBV相关肝硬化患者,而TLR-4表达水平则高于健康对照,死亡的ACLF患者HLA-DR表达水平显著高于生存患者。此外,ACLF患者单核细胞TLR-4、TNF-α和IL-12表达水平则显著高于健康对照,该结果提示单核细胞HLA-DR及其它细胞因子的表达水平与ACLF的发展和预后有密切关系。
2 效应细胞的直接杀伤
在机体清除受病毒感染的肝细胞过程中,天然免疫系统的效应细胞为NK和NKT细胞,而适应性免疫系统的效应细胞主要是 CTL[6,7]。
NK和NKT细胞在肝组织内大量富集,占肝内总淋巴细胞的三分之一,是肝细胞大量死亡的重要因素[8]。NK细胞与CTL有共同的多能分化前体,并且有相似的抗病毒机制:释放非细胞毒性因子IFN-γ和TNF-α,清除病毒,释放穿孔素和颗粒酶直接杀伤靶细胞。NKT细胞既表达T细胞受体,也有NK细胞的表面分子标志,可以识别类似MHI-I类分子的CD1分子与醣脂类的复合物[9]。Kakimi et al先利用特异性抗体消除HBV转基因小鼠体内的CD4+和CD8+T细胞,再注射NKT细胞和CD1分子,24 h后在小鼠肝组织检测到IFN-γ和IFN-α/β,同时HBV复制被抑制。随后,NK细胞被激活并募集至肝组织,分泌大量细胞因子,进一步清除病毒,提示激活的天然免疫细胞能通过分泌细胞因子控制病毒复制[10]。
CTL的主要作用是清除细胞内病原体和肿瘤细胞。激活CTL需要两种信号:首先特异性识别APC提呈的抗原多肽-MHC-1类分子复合物;其次,由APC提供共刺激信号以避免免疫无能。CTL清除病毒的效应包括非细胞毒性机制(如释放细胞因子IFN-γ和TNF-α)和细胞毒性机制(如释放细胞毒性因子穿孔素/颗粒酶和受体介导的肝细胞凋亡)。体内和体外实验显示CTL可以抑制HBV复制并且只杀伤小部分肝细胞[11]。急性感染的黑猩猩体内大多数HBV被清除发生在T细胞浸润和肝损伤之前。这些研究都证实了非细胞毒性机制的重要性。临床研究表明,早期肝衰竭患者处于免疫过激反应阶段,大量的CTL在双重刺激信号下活化并过度扩增,原有的免疫平衡机制被打破。随着病情的发展,晚期由于感染导致的内毒素血症的发生和机体微循环障碍,使得CTL凋亡增加,细胞数量逐渐减少。有研究发现,血小板通过促进CTL募集至肝细胞参与了肝损伤[12]。
在机体清除HBV的进程中,CD4+T细胞受到外来抗原刺激后,经过增殖,分化为Th1、Th2、T调节细胞和Th17等多种效应T细胞。Th1并不像CTL一样直接作用于肝细胞内的病毒清除,但通过产生IFN-γ、IL-2等介导细胞免疫应答,促进CTL增殖和分泌细胞因子。因此,CD4+T细胞可以通过分泌IL-2间接控制HBV感染,缺少CD4+T细胞会降低CTL活性[13]。
3 宿主遗传背景
众多证据显示宿主遗传背景对HBV-ACLF重症化过程有重要影响。已有的乙型肝炎相关遗传易感性研究主要针对涉及HBV免疫反应通路的几个基因,如TNF-α、TNF-β、IL-10和干扰素诱导蛋白-10(IP-10)等。Deng[14]对雌激素受体1(ESR1)的T29C进行了大样本单核苷酸多态性(SNP)分析,包括1277例慢性HBV感染者,748例HBV感染后自然恢复者和293例家族性慢性乙型肝炎患者,结果发现29T/T基因型比29C基因型病例发生持续HBV感染的可能高1.41倍,而且父代29T基因型更容易垂直传播给子代。Xu[15]分析了IP-10启动子基因的SNP位点G-201A,包括196例急性肝炎患者、193例慢性肝炎轻中度患者、188例慢性肝炎重度患者和275例健康对照,结果发现慢性肝炎重度患者G-201A基因型比例高于其它患者或健康对照。体外细胞转染实验证实201A基因型启动子活性是201G的1.43倍,患者201A mRNA的转录活性是201G的1.38倍。
4 免疫相关细胞因子
目前,已知ACLF患者外周血IFN-γ、TNF-α、IL-10、IL-4和IL-2水平均明显升高[16,17],这些细胞因子都参与了诱导肝细胞凋亡与坏死,与肝衰竭发生和发展有重要关系。干扰素诱导蛋白(IP)-10是 NK细胞的重要趋化因子,在NK细胞所介导的抗病毒免疫应答中发挥重要调节作用。Wang发现ACLF患者血清IP-10水平高于慢性肝炎和慢性无症状HBV携带者,提示IP-10可作为肝衰竭发生的预测因子[18]。高迁移率族蛋白B1(HGMB1)可以稳定核小体以辅助基因转录的正常进行,是一种重要的促炎症反应因子。在ACLF患者,HGMB1表达远高于CHB患者,并且其表达随TNF-α的刺激而不断升高,提示该蛋白在与ACLF相关的系统性炎症发生中扮演重要角色[19]。细胞因子转录抑制分子(SOCS1)的异常甲基化也与ACLF患者的免疫病理损伤密切相关[20,21]。肝衰竭患者血清IL-21水平显著高于健康对照,IL-21可以激活T细胞以清除病毒,同时释放大量炎症因子导致严重肝损伤[22]。
此外,Zou发现ACLF患者体内IFN-γ和TNF-α水平较慢性乙型肝炎患者明显升高,而抗炎性因子IL-10却没有相应的升高,这种促炎和抗炎性细胞因子表达失衡可能是ACLF发生的免疫病理机制之一[23]。
有些细胞因子对肝损伤后肝细胞的再生和修复起重要作用,如IL-6即与肝细胞的再生密切相关。在一项临床研究中,Rutherford AE et al检测了67例急性肝衰竭患者和健康对照血清凋亡相关因子,发现急性肝衰竭患者血清IL-6水平是健康对照的10倍以上。Jin在体外细胞研究中发现短期应用IL-6可以促进肝细胞的再生与修复,而长时间应用IL-6则消除了其对肝细胞的保护作用,使肝细胞更易遭受损伤。在慢性肝病阶段患者长时间承受高水平IL-6,可能阻碍了肝细胞的修复,并增加患者发生肝衰竭的可能性[24]。
5 免疫过激状态的抑制性调节
肝衰竭时机体免疫系统进入亢进状态,肝细胞被大规模杀伤,而免疫负调节系统被抑制也加剧了这一进程。目前,已知能够调节免疫反应的因素包括免疫细胞(NK细胞、Treg细胞)、免疫分子(IL10、TGF-β)和 PD-1/PD-L1受体 /配体系统等。
最新研究表明,NK细胞可以作为固有免疫和适应性免疫之间的桥梁,通过直接接触或通过细胞因子调节而影响其它免疫细胞的抗病毒作用,如 pDCs、CTL和单核细胞[25,26]。NK细胞可与CTL互相作用,抑制CTL的免疫反应,而在小鼠去除NK细胞能够增加APC的递呈能力,进而加强CTL反应,提示NK细胞也具有免疫调节作用[27]。
程序性死亡受体1(PD-1)和其配体(PD-L1)对过度激活的CTL免疫反应起负性调节作用。PD-1在T细胞活化中提供抑制性信号的共刺激分子,主要表达于活化的T细胞上,传递负性调控信号。PD-L1在T细胞、B细胞、DC、巨噬细胞、肝细胞等均可检测到。在乙型肝炎活动状态下,负向协同刺激分子如PD-1和PD-L1的高表达是机体维持内环境稳态的需要,可以避免因乙型肝炎病毒抗原诱导的免疫过度反应而造成严重的肝脏功能衰竭[28]。在慢性HBV感染过程中,PD-1表达能够抑制CD8+T细胞的免疫反应,诱导其凋亡和免疫无能。PD-1可能还负责维持和增强Treg细胞的免疫抑制作用[29]。在急性HBV感染的早期,PD-1的表达水平显著上调,而后期PD-1表达水平下降则与病毒清除密切相关。将PD-1通路屏蔽则可以增强HBV特异性CTL增生和炎症因子的分泌,从反面证实了PD-1对免疫反应的调节功能。急性肝衰竭患者外周血HBV特异性CTL PD-1表达水平降低,对CTL免疫活性的调节能力下降,能够诱发和加速肝衰竭发生[30,31]。
Treg细胞分泌TGF-β、IL-10等细胞因子,具有免疫抑制作用[32],保护宿主免于炎症性病理损害。近年来,Th17细胞和Treg细胞之间的动态平衡在感染性疾病中的作用受到越来越多的关注。两种细胞具有共同的起源,Th17细胞聚集在炎症部位,其产生的IL-17可以诱导炎症因子分泌,募集炎症细胞,加剧炎症反应[33]。两者在细胞分化上相互拮抗,但其分化均依赖TGF-β。Treg、Thl7及其分泌的细胞因子之间形成一个网络,确保机体的免疫反应处于稳定状态,这种状态的失衡可能导致HBV感染重症化。在肝衰竭起病前,机体处于免疫耐受状态,当免疫被激活时,机体会发挥自我调控功能,诱导Treg在疾病早期迅速增加,抑制肝细胞的免疫损伤[34];另一方面,持续肝脏炎症使T细胞总数减少,Treg细胞功能也受到破坏,使Treg不能有效抑制机体过度免疫反应,进一步加重了肝实质细胞的免疫损伤。一项临床研究表明,ACLF患者Treg和Th17细胞比例越高,越有利于患者的生存和良好的预后[21,35]。
6 小结
目前认为,免疫细胞动员和细胞因子大量分泌为代表的免疫系统活化是肝衰竭发病的中心环节。肝炎病毒所致的肝损伤主要是CTL攻击表达HBV抗原的靶细胞,导致大量肝细胞溶解和凋亡。免疫损伤和局部肝细胞的死亡介导了局部炎症反应,并导致微循环障碍和内毒素血症。负调节免疫系统被抑制则导致机体的促炎性免疫反应失去控制,更进一步加速了肝细胞的死亡。机体免疫系统的各个环节都在不同程度上参与了HBV-ACLF的发生和发展,更深入地了解在此过程中免疫病理机制将有助于发现新的免疫调节治疗方法。
[1]中华医学会感染病学分会肝衰竭与人工肝学组.肝衰竭诊治指南(2012年版).实用肝脏病杂志,2013,16(3):210-216.
[2]黄湛镰,高志良.肝衰竭的三重打击及治疗策略.内科急危重症杂志,2014,20(3):154-156.
[3]Atanley,E,van Drunen L,van den Hurk S.Future considerations for dendritic cell immunotherapy against chronic viral infections.Expert Rev Clin Immunol,2014,10(6):801-813.
[4]Zhang Z,Zou ZS,Fu JL,et al.Severe dendritic cell perturbation is actively involved in the pathogenesis of acute-on-chronic hepatitis B liver failure.J Hepatol,2008,49(3):396-406.
[5]Xing T,Li L,Cao H,et al.Altered immune function of monocytes in different stages of patients with acute on chronic liver failure.Clin Exp Immunol,2007,147(1):184-188.
[6]Busca A,Kumar A.Innate immune responses in hepatitis B virus(HBV) infection.Virol J,2014,11:22.
[7]Schuch A,Hoh A,Thimme R.The role of natural killer cells and CD8(+)T cells in hepatitis B virus infection.Front Immunol,2014,5:258.
[8]Shabani Z,Bagheri M,Zare-Bidaki M,et al.NK cells in hepatitis B virus infection:a potent target for immunotherapy.Arch Virol,2014,159(7):1555-1565.
[9]Conroy MJ,Mac N R,Grealy R,et al.Circulating CD56 natural killer cells and CD56 T cells that produce interferon-gamma or interleukin-10 are expanded in asymptomatic,E antigennegative patients with persistent hepatitis B virus infection.J Viral Hepat,2014,doi:10.1111/jvh.12299.[Epub ahead of print].
[10]Kakimi K,Guidotti LG,Koezuka Y,et al.Natural killer T cell activation inhibits hepatitis B virus replication in vivo.J Exp Med,2000,192(7):921-930.
[11]Phillips S,Chokshi S,Riva A,et al.CD8(+) T cell control of hepatitis B virus replication:direct comparison between cytolytic and noncytolytic functions.J Immunol,2010,184(1):287-295.
[12]Koh S,Bertoletti A.Viral hepatitis and serotonin:altering cytotoxic T-lymphocyte function in the liver.Expert Rev Vaccines,2009,8(1):29-32.
[13]Zhang Z,Zhang JY,Wang LF,et al.Immunopathogenesis and prognostic immune markers of chronic hepatitis B virus infection.J Gastroenterol Hepatol,2012,27(2):223-230.
[14]Deng G,Zhou G,Zhai Y,et al.Association of estrogen receptor alpha polymorphisms with susceptibility to chronic hepatitis B virus infection.Hepatology,2004,40(2):318-326.
[15]Xu Z,Liu Y,Liu L,et al.Association of interferon-gamma induced protein 10 promoter polymorphisms with the disease progression of hepatitis B virus infection in Chinese Han population.Plone One,2013,8(9):e72799.
[16]Mao WL,Chen Y,Chen YM,et al.Changes of serum cytokine levels in patients with acute on chronic liver failure treated by plasma exchange.J Clin Gastroenterol,2011,45(6):551-555.
[17]赵攀,毕振华,王春亚.急性肝衰竭患者血清炎性细胞因子水平分析.实用肝脏病杂志,2014,17(1):63-64.
[18]Wang K,Wu ZB,Ye YN,et al.Plasma interleukin-10:A likely predictive marker for hepatitis B virus-related acute-on-chronic liver failure.Hepat Mon,2014,14(7):e19370.
[19]Xu H,Li H,Qu Y,et al.High mobility group box 1 release from cholangiocytes in patients with acute-on-chronic liver failure.Exp Ther Med,2014,8(4):1178-1184.
[20]Zhang JJ,Fan YC,Zhang ZH,et al.Methylation of suppressor of cytokine signalling 1 gene promoter is associated with acute-on-chronic hepatitis B liver failure.J Viral Hepat,2014,doi:10.1111/jvh.12286.[Epub ahead of print].
[21]Liang XS,Li CZ,Zhou Y,et al.Changes in circulating Foxp3(+) regulatory T cells and interleukin-17-producing T helper cells during HBV-related acute-on-chronic liver failure.World J Gastroenterol,2014,20(26):8558-8571.
[22]Hu X,Ma S,Huang X,et al.Interleukin-21 is upregulated in hepatitis B-related acute-on-chronic liver failure and associated with severity of liver disease.J Viral Hepat,2011,18(7):458-467.
[23]Zou Z,Li B,Xu D,et al.Imbalanced intrahepatic cytokine expression of interferon-gamma,tumor necrosis factor-alpha,and interleukin-10 in patients with acute-on-chronic liver failure associated with hepatitis B virus infection.J Clin Gastroenterol,2009,43(2):182-190.
[24]Jin X,Zimmers TA, Perez EA,et al.Paradoxical effects of short-and long-term interleukin-6 exposure on liver injury and repair.Hepatology,2006,43(3):474-484.
[25]Lang PA,Lang KS,Xu HC,et al.Natural killer cell activation enhances immune pathology and promotes chronic infection by limiting CD8+T-cell immunity.Proc Natl Acad Sci U S A,2012,109(4):1210-1215.
[26]Waggoner SN,Cornberg M,Selin LK,et al.Natural killer cells act as rheostats modulating antiviral T cells.Nature,2012,481(7381):394-398.
[27]Cook KD,Whitmire JK.The depletion of NK cells prevents T cell exhaustion to efficiently control disseminating virus infection.J Immunol,2013,190(2):641-649.
[28]Li X,Wang Y,Chen Y.Cellular immune response in patients with chronic hepatitis B virus infection.Microb Pathog,2014,74C:59-62.
[29]Francisco LM,Salinas VH,Brown KE,et al.PD-L1 regulates the development,maintenance,and function of induced regulatory T cells.J Exp Med,2009,206(13):3015-3029.
[30]Radziewicz H,Hanson HL,Ahmed R,et al.Unraveling the role of PD-1/PD-L interactions in persistent hepatotropic infections:potential for therapeutic application.Gastroenterology,2008,134(7):2168-2171.
[31]Zhang Z,Zhang JY,Wherry EJ,et al.Dynamic programmed death 1 expression by virus-specific CD8 T cells correlates with the outcome of acute hepatitis B.Gastroenterology,2008,134(7):1938-1949,1949.e1-3.
[32]Liu W,Putnam AL,Xu YZ,et al.CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+T reg cells.J Exp Med,2006,203(7):1701-1711.
[33]Zhou L,Lopes JE,Chong MM,et al.TGF-beta-induced Foxp3 inhibits T(H)17 cell differentiation by antagonizing RORgammat function.Nature,2008,453(7192):236-240.
[34]Dong X,Gong Y,Zeng H,et al.Imbalance between circulating CD4+regulatory T and conventional T lymphocytes in patients with HBV-related acute-on-chronic liver failure.Liver Int,2013,33(10):1517-1526.
[35]Niu YH,Yin DL,Liu HL,et al.Restoring the Treg cell to Th17 cell ratio may alleviate HBV-related acute-on-chronic liver failure.World J Gastroenterol,2013,19(26):4146-4154.