感染鸭乙型肝炎病毒鸭外周血CD4+和CD8+T淋巴细胞水平变化*
2015-03-15聂云天刘伯阳
聂云天,刘伯阳,王 琪
全球乙型肝炎病毒感染者有3.5亿人,是严重危害人类健康的疾病。乙型肝炎病毒本身并不直接引起肝细胞病变。病毒感染者体内细胞复制,将病毒抗原释放到肝细胞膜上,激发机体的免疫反应,从而产生一系列临床症状。因此,免疫损伤是乙型肝炎病毒致病的主要机制。本研究建立鸭乙型肝炎病毒感染模型,分析了鸭外周血CD4+T细胞和CD8+T细胞数的变化,现将结果报告如下。
1 材料与方法
1.1 实验动物、设备与试剂 30只SPF级实验白鸭(本校动物实验中心提供),平均体质量(2.0±0.3)kg,4~6月龄。鸭乙型肝炎I型病毒血清、抗鸭淋巴细胞亚群单克隆抗体、检测乙型肝炎病毒血清指标试剂盒和检测DHBsAg试剂盒(广东健客医药有限公司)。流式细胞仪(FACS CantoⅡ,美国BD公司);AMS-300型自动生化分析仪(北京奥普森公司)。
1.2 鸭肝炎模型制备 取15只实验鸭,经颈静脉注射鸭乙型肝炎I型病毒血清100 mg/只/次,连续7日后,取实验鸭外周血1 m l,采用ELISA法检测血清鸭HBsAg、鸭HBeAg和抗-鸭HBc[1]。
1.3 外周血生化和CD4+T和CD8+T细胞数检测 在实验鸭和健康鸭,分别经颈静脉取血2 m l。依次用自动生化分析仪检测血肝功能指标;每只动物取血400μl,抗凝处理,将血分装4个试管,向各管分别加入抗CD4-藻红蛋白(PE)40 μl,再依次加入抗CD8-PE40μl、避光室温充分结合30 min后,每管加入溶血素3 m l,避光放置至透明后,3000 r/m离心5 min,弃去上清液,加入磷酸盐缓冲液(PBS)4 ml,在混合器上使试管底部的细胞与PBS溶液混匀,再3000 r/m离心5 min,最后加入PBS 0.5 mL溶液,混匀,直接上流式细胞仪检测。
1.4 统计学处理 应用SPSS 18.0统计软件,计量资料以()表示,两组间比较采用双侧组间或配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 模型制备情况 在注射病毒血清7日后,15只实验鸭血清HBsAg、鸭HBeAg和抗-鸭HBc均阳性,说明感染成功。感染组动物肝功能损害明显,血清ALT、AST水平急剧升高,与健康对照组比,差异显著(P<0.01,表1)。
2.2 外周血CD4+T和CD8+T细胞数比较 见表2。
3 讨论
HBV和DHBV均为嗜肝DNA病毒,它们都有相似的基因组和病毒结构特征,均具有通过RNA逆转录复制的特性。DHBV感染鸭模型是研究HBV基因突变、细胞表面病毒受体、病毒清除机制以及筛选新的抗病毒药物的合适动物模型[2]。DHBV感染成年鸭后血清ALT、AST、总胆红素和凝血酶原时间明显升高,同时外周血CD4+T和CD8+T淋巴细胞数有所变化,说明病毒致病成功[3]。相关研究表明,乙型肝炎的发生是机体与病毒相互作用的结果。HBV侵入肝细胞内增殖,可使受染细胞表达 HBsAg和 HBeAg等,后者可被机体免疫系统所识别,引起一系列免疫应答[4]。外周血T淋巴细胞是宿主抗病毒、抗肿瘤免疫反应中起主导作用的免疫活性细胞,构成了免疫系统的主要部分[5~6]。
表1 两组动物肝功能指标()比较

表1 两组动物肝功能指标()比较
①P<0.01;②P<0.05
例数 ALT(U/L) AST(U/L) TBIL(μmol/L) TP(g/L) PT(s)感染组 15 332.5±126.5① 177.8±244.7① 3.3±0.1② 26.1±19.9 12.9±4.0②对照组 15 23.2±28.7 20.9±7.7 1.9±0.1 26.7±12.0 7.9±1.2
表2 两组外周血CD4+T和CD8+T细胞数(%,)比较
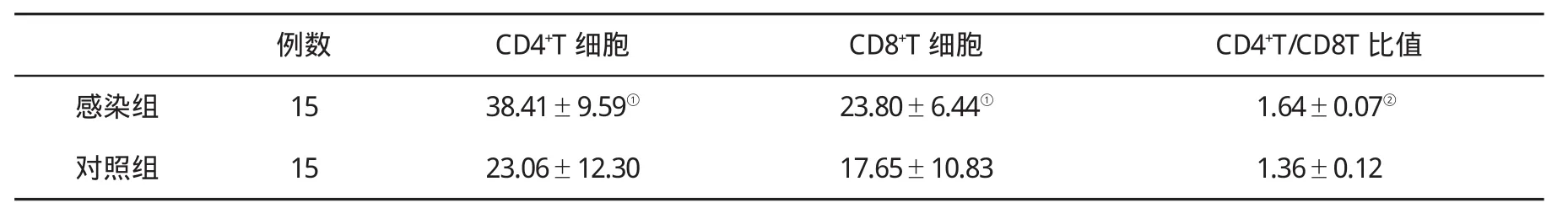
表2 两组外周血CD4+T和CD8+T细胞数(%,)比较
与对照组比,①P<0.001;②P<0.05
例数 CD4+T细胞 CD8+T细胞 CD4+T/CD8T比值感染组 15 38.41±9.59① 23.80±6.44① 1.64±0.07②对照组 15 23.06±12.30 17.65±10.83 1.36±0.12
T淋巴细胞由不同亚群组成,成熟T细胞以CD3+为代表,按表型不同可将其分为CD4+T细胞和 CD8+T细胞等亚型,其中这两者占有很大的比例。CD4+T细胞为辅助性T细胞(Th),CD4+细胞数量与免疫功能呈正相关[7,8]。CD8+细胞为细胞毒性T细胞(CTL),在CD4+淋巴细胞存在的辅助下对清除感染的肝细胞及清除病毒有重要作用,而且CD4+淋巴细胞Th1亚型通过直接对肝细胞的溶解而间接清除病毒,同时也使肝脏病变加重[9,10]。在急性HBV感染时,CD4+细胞数显著增高,CD4+除在免疫应答中起辅助和诱导作用外,还分泌细胞因子,发挥部分细胞毒作用,并启动迟发性过敏反应[11]。CD4细胞减少和功能下降会导致机体免疫功能低下,尤其是细胞免疫功能低下,使得 HBV不能被有效清除[12]。
根据实验结果可知,实验感染动物CD4+T和CD8+T细胞数均明显高于正常对照组,表明当HBV侵入机体时,HBV就会激发细胞免疫机制[13],大量的CD4+T和CD8+T细胞就会释放入血,进入被感染组织或细胞,可以快速识别病原体,并特异性杀伤靶细胞,有效遏制HBV的复制,其中有细胞毒作用的CD8+细胞发挥的杀伤靶细胞,清除病原体作用更为明显[14]。实验结果显示CD4/CD8比值明显升高,符合HBV感染机体的初期特征[15],CD4/CD8细胞比值是监测机体细胞免疫功能,反映机体免疫状态的重要指标[16]。
综上所述,要想有效遏制HBV的复制和减轻肝损伤,提高细胞免疫能力是关键,其中维持淋巴细胞稳定可以使细胞免疫更好的发挥作用。及时对乙型肝炎病毒感染者外周血T淋巴细胞亚群进行检测,可以了解其免疫功能状态,为临床观察提供实验指标。
[1]马秀丽,宋敏训.鸭病毒性肝炎病毒 VP1基因表达及其抗体检测 ELISA 方法的建立.微生物学报,2008,48(8):1110-1114.
[2]胡权,杨东亮.鸭乙型肝炎病毒感染模型的研究进展.实用肝脏病杂志,2007,10(3):201-203.
[3]伍莉,朱周福.雏鸭感染鸭病毒性肝炎的组织病理学观察.中国兽医杂志,2011,47(5):29-30.
[4]张健珍,曾春燕,张春兰,等.不同临床类型HBV感染者外周血T 淋巴细胞亚群的变化.实用肝脏病杂志,2012,15(6):508-510.
[5]王慰,任桂芳,刘玉珍,等.慢性乙型肝炎患者外周血 T淋巴细胞亚群的变化.实用肝脏病杂志,2012,15(4):346-347.
[6]吴敏娟,胥萍.乙型肝炎患者外周血 B淋巴细胞检测的意义.实用肝脏病杂志,2011,14(6):440-442.
[7]司传平,丁剑冰.医学免疫学.北京:高等教育出版社,2014:120-121.
[8]陈瑜,吴炜,李兰娟,等.重型肝炎患者乙型肝炎病毒特异性细胞毒性T淋巴细胞应答功能研究.中华肝脏病杂志,2006,14(9):658-611.
[9]张国英,黄子慧,徐卫平.组织细胞坏死性淋巴结炎患者外周血T淋巴细胞亚群和 NK细胞检测及临床意义.检验医学,2013,28(2):128-130.
[10]曹慧,谭善忠,孙薇薇,等.乙型肝炎病毒相关慢加急性肝衰竭患者外周血T淋巴细胞比例的特征及其意义.中华临床医师杂志·电子版,2013,7(19):8565-8568.
[11]万学红,卢雪峰.诊断学.北京:人民卫生出版社,2013:415-416.
[12]王辉,高建鹏,游晶.慢性乙型肝炎病毒感染者外周血T细胞亚群变化与其血清HBV DNA的水平分析.临床医药实践,2012,21(6):420-422.
[13]郭银燕,袁春蓓,俞海英,等.慢性乙型肝炎与肝衰竭患儿外周血T 淋巴细胞亚群的差异.肝脏,2014.19(7):515-517.
[14]巫翠萍,覃西,王华民,等.慢性乙型肝炎患者外周血CD4+CD25+Treg与CD4+和CD8+T淋巴细胞亚群的相关研究.实用临床免疫学,2010,26(3):273-277.
[15]于晓辉,朱自江,李晓云,等.乙型肝炎肝硬化患者外周血T淋巴细胞亚群和NK 细胞的变化及临床意义.肝脏,2014,19,(4):254-256.
[16]王晗,苑文雯,李妍,等.乙型肝炎患者外周血 T淋巴细胞亚群变化及临床意义.解放军医学院学报,2014,35(9):909-911.