441例药物性肝损伤患者临床和肝组织病理学特征分析
2015-03-15姚云洁刘鸿凌刘婉姝李亚斐辛绍杰
姚云洁,刘鸿凌,朱 冰,刘婉姝,臧 红,李 晨,李亚斐,辛绍杰
药物性肝损伤(Drug-induced liver injury,DILI)是指由药物或其代谢产物引起的肝脏炎症。近年来,由于医疗技术和科研水平的进步,越来越多的药物开始进入临床实践。虽然我国近年一直在加强药品不良反应的监测,但是随着新药品种的不断增加,药物性肝损伤有逐年递增的趋势。同时,我国中药种类繁多且成分复杂,其应用也十分普遍。由于药物性肝损伤的发病时间和临床表现与其他型肝炎相比并无特异性,药物性肝损伤的发病机制也尚未完全明确,给诊断带来了一定的困难。本文通过对441例药物性肝损伤患者的临床和肝组织病理学特征进行分析,以期为临床实践提供参考和指导。
1 资料与方法
1.1 病例来源 2010年1月至2014年5月解放军第302医院收治的药物性肝损伤患者441例,男性182例,女性259例;年龄13~88岁,平均年龄(43.1±15.0)岁。DILI诊断标准:根据详细用药情况、肝组织病理学检查及RUCAM评分标准[1-5]等进行,病理学诊断参照文献[3,6]进行。根据国际医学科学组织理事会(Council for international organizations of medical sciences,CIOMS)确立的标准进行临床分型,即分为肝细胞型、胆汁淤积型和混合型。最近,美国食品药品监督管理局(Federal Drug Agency,FDA)药物肝毒性指导委员会(Drug hepatotoxicity steering committee,DHSC)修订的上述3型分型标准如下[3,7]:(1)肝细胞型:ALT≥3×ULN,且 ALT/ALP≥5;(2)胆汁淤积型:ALP≥2×ULN,且 ALT/ALP≤2;(3)混合型:ALT>3×ULN,ALP>2×ULN,且2<ALT/ALP<5。排除各型肝炎病毒标志物阳性、存在巨细胞病毒或EB病毒感染证据者,通过询问既往病史排除先天性胆红素代谢障碍患者。
1.2 检测 采用ELISA法检测血清乙型肝炎病毒表面抗原(上海科华生物工程股份有限公司);采用ELISA法检测血清抗丙型肝炎病毒抗体(上海科华生物工程股份有限公司);采用ELISA法检测血清抗甲型肝炎病毒IgM(上海科华生物工程股份有限公司);采用ELISA法检测血清抗戊型肝炎病毒IgM(上海科华生物工程股份有限公司);采用ELISA法检测抗EB病毒 IgG(深圳市科润达生物工程有限公司);采用ELISA法检测抗巨细胞病毒IgM(深圳市科润达生物工程有限公司)。
1.3 肝活检 常规进行。
1.4 统计学方法 应用SPSS 18.0软件进行统计分析,计量资料以()表示或[中位数(四分位间距,IQR)]表示。当P<0.05时,被认为具有显著统计学差异。
2 结果
2.1 DILI患者临床特点 在所有441例纳入的患者中,发热 13例(2.94%),乏力 285例(64.63%),纳差219例(49.66%),恶心 94例(21.32%),腹胀 76例(17.23%),尿黄 209例(47.39%),瘙痒 31例(7.03%),灰白便 24例(5.44%),皮疹 16例(3.63%),脾肿大260例(58.96%);肝细胞型、淤胆型和混合型分别为178例(40.36%)、132例(29.93%)和131例(29.71%);应用引起肝损伤的相关药物持续时间为小于2周147例(33.33%),2周 ~8周 162例(36.73%),大于 8周132例(29.93%)。
2.2 DILI患者实验室指标 入院时,441例患者血清ALT水平为182(56.8~533.5)U/L,升高356例(80.7%),AST 112.8(46.0~578)U/L,升高 338例(76.6%),TBIL 27.7(13.9~114.8) mol/L,升高 288例(65.3%),DBIL 14.0(5.2~85.9) mol/L,GGT 46.0(24.0~195.0)U/L,ALP 129.0(89.0~192.5)U/L,TBA 22(7.0~147.0)mol/L;15例(3.4%)患者嗜酸性粒细胞比例大于6%。另外,有92例(20.9%)患者自身抗体阳性,其中抗核抗体阳性56例(60.87%),抗平滑肌抗体阳性4例(4.35%),抗线粒体抗体阳性7例(7.61%),抗胃壁抗体阳性5例(5.43%),其他自身抗体阳性20例(21.74%)。在自身抗体阳性患者中,应用中药的种类比较分散,有何首乌、黄药子、养血清脑颗粒、骨康胶囊、雷公藤等,西药则主要集中在降压、降脂和解热镇痛消炎药物,如阿托伐他汀、寿比山、比索洛尔、尼美舒利等。另外,还有一例为服用乐果引起的DILI患者血清抗核抗体阳性。
2.3 应用药物情况分析 在本组致病药物中,中(草)药176例(39.91%),其中以何首乌、雷公藤、消银散、黄药子、白癜风冲剂等多见;解热镇痛药54例(12.24%),对乙酰氨基酚、柳氮磺嘧啶、尼美舒利等;抗生素50例(11.34%),主要包括克林霉素、阿奇霉素、头孢类、酮康唑、喹诺酮类、阿米卡星、替硝唑、红霉素类;精神类药物19例(4.31%),主要包括去痛片、佐匹克隆、苯二氮卓类、卡马西平、哌唑嗪;抗代谢药物19例(4.31%),主要包括甲氨蝶呤、环磷酰胺、阿霉素、丙基硫氧嘧啶等;心血管类药物15例,主要包括他汀类;糖尿病相关药物14例,主要包括二甲双胍。另外,保健药物18例(4.08%)、抗结核药物12例(2.72%)、其他药物9例(1.59%)。其余 55例用药史不详。
2.4 中药与西药所致肝炎患者情况的对比 中药与西药所致药物性肝损伤在皮疹(1.1%对5.2%,P<0.05)和脾脏肿大(78.4%对46.2%,P<0.05)方面有显著性差异,其他临床症状则无显著差异(P>0.05);临床分型和炎症分级上无显著性差异(P>0.05),但两者在用药持续时间上有显著差异(P<0.05);在实验室检查方面,中药与西药所致药物性肝损伤的各项指标均无显著性差异(P>0.05,表 1)。
2.5 转归 所有患者在诊断后,立即停用可疑致肝损伤药物,给予降酶退黄等保肝对症治疗后,临床治愈(ALT、TBIL恢复到正常范围且临床症状消失)85例(19.27%),好转(ALT、TBIL下降两倍以上且临床症状减轻)331例(75.06%),无效20例(4.54%),死亡 5例(1.13%),其中2例因基础疾病合并肝衰竭死亡,3例因晚期肿瘤死亡。
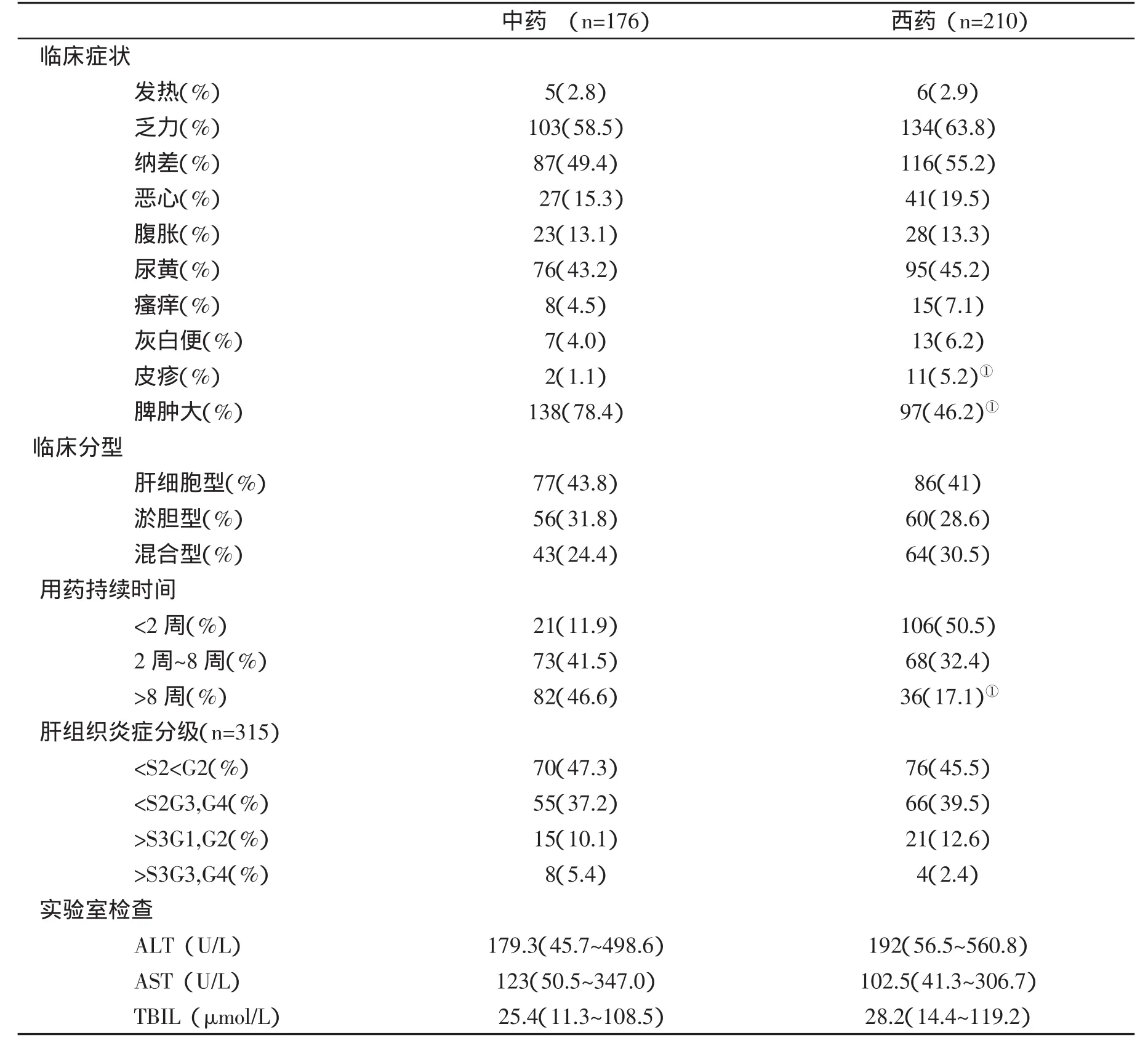
表1 中药与西药所致DILI临床特点的比较
3 讨论
药物性肝损伤在临床上比较常见。肝脏是药物在体内代谢和生物转化的主要场所,但是由于个体的异质性或其他原因,导致一些药物在肝脏代谢或生物转化时对肝脏造成一定的损伤,从而影响肝脏的功能。药物性肝损伤的发病机制主要包括药物本身的毒性、免疫过敏反应、影响肝细胞摄取和干扰胆盐或有机阴离子的转运和排除等方面[8-10]。在本研究中,中药与西药所致药物性肝损伤患者在肝组织病理表现和实验室检查方面无显著差异,可能是由于两者引起肝损伤的机制是相同的。中药与西药所致药物性肝损伤的临床症状稍有差异,可能与药物本身的性质及肝损伤的持续时间有关。
在本研究中,针对慢性疾病用药导致的药物性肝损伤,特别是中药所致药物性肝损伤比较多见,如心血管类、精神类、免疫调节药物等,其中西药所致药物性肝损伤的结果与国外的研究一致[11-14]。这一类疾病应用的药物一般对肝脏的损伤作用较慢,有累积的趋势,更应该长期监测肝功能,以防止药物性肝损伤的发生。短时间内发生的药物性肝损伤以非甾体类抗炎药和抗生素类居多,这也与国外研究一致[15,16]。总体而言,与西药相比,中药所致药物性肝损伤发病前用药时间较长,且本研究也显示中药所致药物性肝损伤患者发生脾脏肿大的比例显著高于西药组,而脾脏肿大也是肝病慢性化的重要体征之一。在441例患者中还有92例存在自身抗体阳性。美国胃肠病学会发布的DILI临床实践指南指出,米诺环素和呋喃妥因可引起自身免疫性肝病样的药物性肝损伤[3],但本研究中的92例患者均未使用过米诺环素和呋喃妥因,而且这些患者的临床症状仅出现在应用特定的药物之后,且在停药及对症处理后好转,故也考虑为药物性肝损伤,这一类患者易与自身免疫性肝炎相混淆,因而更要求医师详细客观认真地采集病史,以防误诊。
目前,虽然没有关于可引起肝损伤的药物的确切数据,但在临床上,由于中(草)药的广泛应用,使得药物性肝损伤比较常见,药物性肝损伤的发病可能与人们的观念、药物的不合理应用、药物质量、药物生产工艺、医师对药物肝毒性的认识不足以及宿主遗传因素密切相关。本研究中存在患者过量使用或长时间服用对肝功能有影响的中药(西药),从而引发各种临床症状。临床上应用这一类药物时,应当密切关注病人的肝功能变化,预防药物性肝损伤的发生。另外,药品研发机构也需要加强药物开发,特别是在中药开发过程中的药物毒理作用研究,弄清药物引起肝损伤的具体作用机制,从而为临床医师选择合理的治疗人群作参考。许多危险因素如肝脏基础病变、乙型肝炎病毒感染、酗酒及非酒精性脂肪肝等与药物性肝损伤的发生密切相关[10],而宿主基因如细胞色素P450和人类白细胞抗原(HLA)的多态性也被报道与一部分药物性肝损伤密切相关[17-20]。
虽然药物性肝损伤预后较好,但是由于临床表现缺乏特异性,特别是中药,在发病前通常有较长的服药史,容易被忽视。因此,在将来建立一个药物性肝损伤数据库,特别是针对中(草)药的药物性肝损伤数据库,对可能引起药物性肝损伤的药物进行数据统计和分析,对临床预防药物性肝损伤的发生有重要的意义。
[1]Danan G,Benichou C.Causality assessment of adverse reactions to drugs IA novel method based on the conclusions of international consensus meetings:application to drug-induced liver injuries.J Clin Epidemiol,1993,46(11):1323-1330.
[2]中华医学会消化病学分会肝胆疾病协作组.急性药物性肝损伤诊治建议(草案).中华消化杂志,2007,27(11):765-767.
[3]Chalasani NP,Hayashi PH,Bonkovsky HL,et al.ACG Clinical Guideline:the diagnosis and management of idiosyncratic druginduced liver injury.Am JGastroenterol,2014,109(7):950-966.
[4]刘蕾,张晓岚.药物性肝损伤诊断与防治进展.临床肝胆病杂志,2012,28(6):477-481.
[5]胡锡琪.药物性肝损伤组织病理学评分探讨.肝脏,2010,15:317-319.
[6]于乐成,陈成伟.ACG特异质性药物性肝损伤临床诊治指南解读. 肝脏,2014,19(8):570-574.
[7]陈成伟.药物性肝损害诊断标准的评价.诊断学理论与实践,2009,8(2):121-124.
[8]王吉耀,郭津生.药物性肝病//陈灏珠.实用内科学,12版,北京:人民卫生出版社,2005:2000-2004.
[9]Michael DL,John JP,Jayant A.Drug-induced liver injury.Mayo Clin Proc,2014,89(1):95-106.
[10]Stefan D,Hamilton JP.Drug-induced iiver injury.US Gastroenterol Hepatol Rev,2010,6:73-80.
[11]Tillmann HL,Rockey DC.Improved prediction of the need for liver transplantation in patients with drug-induced liver injury?Gastroenterology,2014,147(6):1441.
[12]Al-Halawani MZ,Thawabi M,Asslo F,et al.Losartan-induced ischemic hepatocellular hepatotoxicity:A case report and literature review.J Family Med Prim Care,2014,3(3):272-274.
[13]Nicoletti NF,Rodrigues-Junior V,Santos AA Jr,et al.Protective effects of resveratrol on hepatotoxicity induced by isoniazid and rifampicin via SIRT1 modulation.J Nat Prod,2014,77(10):2190-2195.
[14]Wu Chou AI,Lu ML,Shen WW.Hepatotoxicity induced by clozapine:a case report and review of literature.Neuropsychiatr Dis Treat,2014,10:1585-1587.
[15]Wehling M.Non-steroidal anti-inflammatory drug use in chronic pain conditions with special emphasis on the elderly and patients with relevant comorbidities:management and mitigation of risks and adverse effects.Eur J Clin Pharmacol,2014,70(10):1159-1172.
[16]Devarbhavi H,Andrade RJ.Drug-induced liver injury due to antimicrobials,central nervous system agents,and nonsteroidal antiinflammatory drugs.Semin Liver Dis,2014,34(2):246-251.
[17]Huang YS.Genetic polymorphisms of drug-metabolizing enzymes and the susceptibility to antituberculosis drug-induced liver injury.Expert Opin Drug Metab Toxicol,2007,3:1–8.
[18]Daly AK,Aithal GP,Leathart JB,et al.Genetic susceptibility to diclofenac-induced hepatotoxicity:contribution of UGT2B7,CYP2C8,and ABCC2 genotypes.Gastroenterology,2007,132:272-281.
[19]Andrade RJ,Lucena MI,Alonso A,et al.HLA class II genotype influences the type of liver injury in drug-induced idiosyncratic liver disease.Hepatology,2004,39:1603-1612.
[20]Daly AK,Donaldson PT,Bhatnagar P,et al.HLA-B*5701 genotype is a major determinant of drug-induced liver injury due to flucloxacillin.Nat Genet,2009,41:816-829.