自制简易胆道支架修复兔胆道缺损的动物实验研究*
2015-03-15宫金伟董新舒刘春富
宫金伟,刘 明,董新舒,刘春富
胆管缺损的发生主要是医源性损伤。虽然肝胆外科学者们已将其发生率降低到0.7%以下[1~3],但仍旧有高达30%的医源性胆管损伤给患者带来极为严重的后果。另外,对原发性胆管肿瘤和浸润至胆管的肿瘤术后胆道重建也是个极具挑战性的问题。术中出现胆管缺损可采用胆管端端吻合进行修复,缺损较大时可以利用胆囊管、胃壁组织等予以修复[4~6]。但是,很多胆管损伤患者早已切除可利用的组织,且胃壁组织与胆管的结构差异很大,作为修补材料并不理想。带蒂脐静脉瓣修复胆管狭窄或缺损时要求缺损要小于2.0 cm[7];另一方面,对于肠内容物的返流问题至今还没有哪一种胆肠内引流术式能解决[8,9]。因此,寻找适用于多种情况的胆管修复材料,仍然是广大肝胆外科医师们亟待解决的问题。本实验旨在探讨行支架法修复胆管缺损的可行性,为寻找适用于多种情况的胆管修复材料提供理论和实验依据。
1 材料与方法
1.1 动物和材料 成年大白兔30只,雌雄不限,体质量2.0~3.0 kg,由我院动物实验室提供。检测肝脏、胆管和新生胆管组织的HE染色试剂盒购自上海博谷生物科技有限公司,陆眠宁购自军事医学科学院军事兽医研究所,头孢哌酮钠/他唑巴坦钠购自山东省人民药业有限公司,手术器械由我院手术室提供,利用医用采血针设计制造一种简易支架作为胆道支架模型。
1.2 胆管损伤模型的建立 随机将大白兔分为A组和B两组,每组15只。术前不禁水,但禁食12 h。给予陆眠宁0.1 ml.kg-1臀部肌肉注射,麻醉。术中根据麻醉情况适当追加给药。动物取仰卧位,将四肢和头部捆绑固定,手术区备皮。常规消毒,铺巾,取剑突下正中切口,长约5~7 cm,逐层切开,进入腹腔。将肝脏向右上腹牵拉,将胃向左上腹牵拉,显露肝十二指肠韧带,沿着胆囊管与肝总管交汇处向下,在十二指肠的上方,胰头左侧找到胆总管,游离胆总管中下段适当长度后,用纤维剪刀剪去胆总管长度约为0.5 cm(A组)或1.0 cm(B组),制作胆总管缺损动物实验模型。分别在胆总管断端的两侧各缝一针用作牵引,将自制简易胆道支架放入胆总管两端,用5/0无损伤线捆绑,恢复胆总管的完整性。捆绑时力度以刚好卡住凸出环,且无胆汁溢出、支架固定无滑动为原则。用纤维手术剪刀修剪胆总管断端,以保证实验所需长度。彻底止血,冲洗后在所捆绑的支架旁放置一根腹腔引流管,并于体外固定。用1号丝线间断全层缝合腹壁,用0号丝线间断缝合皮肤和皮下组织。术后缓慢静脉推注10%葡萄糖注射液40~60 ml。动物清醒后自由进水(葡萄糖盐水+卫美佳1支),禁食24 h,24 h后自由进食,术后连续3 d给予头孢哌酮/舒巴坦钠2.0 g肌肉注射,1次/d。在术后3 d,待无液体流出时,拔除腹腔引流管,用碘伏给予切口及周围组织消毒并换药,术后7~14 d,待切口愈合良好,则给予拆线。
1.3 检测指标 取实验动物耳缘静脉血,使用日立7020血生化分析仪和日本和光(WAKO)原装进口配套试剂测定血生化指标(北京富众科技发展有限公司)。
1.4 组织病理学检查 在术后1、3、6个月分别取实验动物肝组织、新生胆管组织和新生胆管旁组织进行组织病理学检查(上海博谷生物科技有限公司)。
1.5 统计学分析 将数据输入SPSS 19.0统计学软件,计量资料以()表示,采用 t检验,P<0.05为具有统计学意义。
2 结果
2.1 术中和术后一般情况 两组均顺利完成支架法对胆道的重建。术后两组实验动物无黄疸发生。术后1只(6.67%)A组动物因胆漏死亡;1只(6.67%)B组动物因胆漏和1只(6.67%)因应激性溃疡而死亡。
2.2 血生化指标变化情况 两组血生化指标变化无显著性差异(P>0.05,表 1)。
表1 两组动物手术前后肝功能指标()变化比较
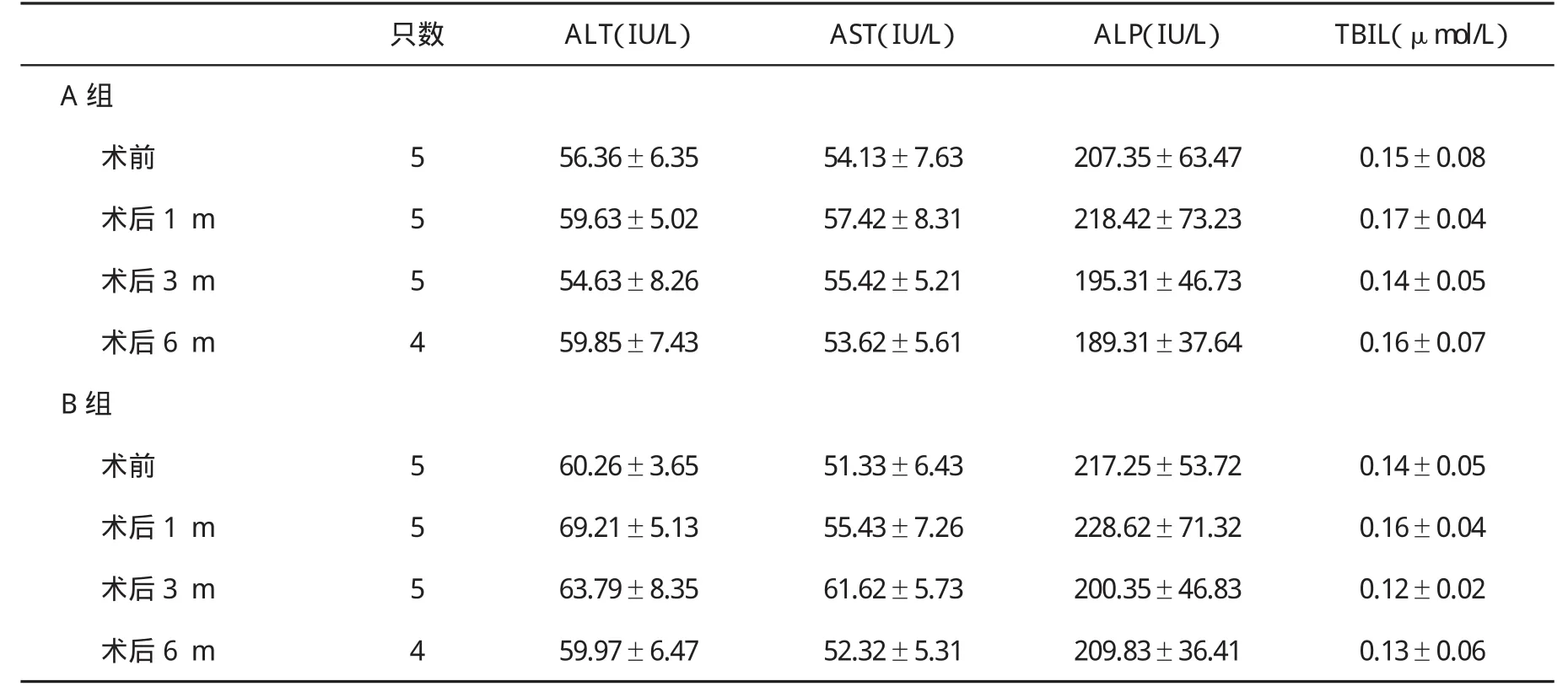
表1 两组动物手术前后肝功能指标()变化比较
术后与术前比,P>0.05
只数 ALT(IU/L) AST(IU/L) ALP(IU/L) TBIL(μmol/L)A组术前 5 56.36±6.35 54.13±7.63 207.35±63.47 0.15±0.08术后 1 m 5 59.63±5.02 57.42±8.31 218.42±73.23 0.17±0.04术后 3 m 5 54.63±8.26 55.42±5.21 195.31±46.73 0.14±0.05术后 6 m 4 59.85±7.43 53.62±5.61 189.31±37.64 0.16±0.07 B组术前 5 60.26±3.65 51.33±6.43 217.25±53.72 0.14±0.05术后 1 m 5 69.21±5.13 55.43±7.26 228.62±71.32 0.16±0.04术后 3 m 5 63.79±8.35 61.62±5.73 200.35±46.83 0.12±0.02术后 6 m 4 59.97±6.47 52.32±5.31 209.83±36.41 0.13±0.06
2.3 组织病理学表现 术后1月,在大体形态上观察,两组见有新生胆管组织覆盖在支架部位胆总管缺损处,呈充血水肿(图A);术后3月,两组新生的胆管组织水肿消退;术后6月,在外观上,两组新生胆管与正常胆管相同。术后1月,在显微镜下观察,两组胆总管缺损部位支架内层均可见不规则的新生胆管上皮细胞散在地分布在支架内新生组织中(图B),伴有杯状细胞和大量腺体形成(图C);在术后3个月,在两组支架内新生组织中均可见单层粘膜状的新生胆管上皮,并且仍有杯状细胞和腺体增生(图D);在术后6个月,两组支架内新生组织中均可见与正常胆管细胞相似的排列整齐的由新生胆管上皮细胞组成的单层粘膜(图E)。与正常胆管组织比,新生胆管组织中仅见少量腺体,未见杯状细胞。在实验观察期间,未见胆汁淤胆及炎性细胞浸润情况。
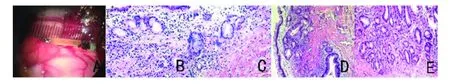
图1 胆管手术和组织病理学表现(HE,200×)
3 讨论
伴随着腹腔镜胆囊切除术的广泛开展,医源性胆道损伤的发生率一直居高不下[10,11]。胆道损伤重建后胆瘘及吻合口狭窄等问题一直以来都是肝胆外科医生们面临的严峻挑战[12~14]。以往采用的胆管空肠Roux-en-Y吻合术要求胆管缺损<2 cm,这样不仅造成Oddi括约肌功能丧失,而且也改变了胆道的正常生理解剖结构,很容易引起逆行性感染,而长期逆行性感染有可能引起吻合口癌变[15]。Tocchi et al[16]对行胆肠吻合术的1003例患者进行随访观察,发现癌变率高达5.58%。以前为了保证吻合口无张力,常需要将胰腺头部、十二指肠及肝周围韧带进行充分游离。同时,为了避免胆管周围血供被中断,对断端胆管的游离长度也有一定的限制,否则,术后发生胆漏及胆管狭窄的概率很高。因此,为了解决吻合口产生张力、保持胆管周围血供及胆道正常解剖生理功能等问题,我们设计了一种保留了Oddi括约肌功的简易支架法对胆管损伤进行修复,并取得了满意的效果。
我们建立的支架法采用的是不需要缝合的捆绑技术,这种技术与国内相关文献报道的胆肠吻合无缝合技术原理相同[17,18],其产生的压力方向与胆管断面相平行,而不像可降解吻合环和加压吻合铁夹等技术使压力方向与胆管断面相垂直而容易产生张力。
本研究方法成败的关键在于新生的组织能否替代损伤后的胆管。Cushieri et al[19]以猪为实验对象,采用静脉代替修复缺损平均3 cm的胆管,发现在胆管上皮生长的8~12周内胆管两端的缝合线逐渐靠拢,移植的静脉仅剩下0.5~0.7 cm,并于术后4个月,移植静脉段被新生胆管完全替代。Hartung et al[20]在狗建立4 cm的胆道缺损模型,采用聚四氟乙烯材料进行修复,证明在移植28天内移植的材料被新生胆管上皮细胞完全覆盖。本研究结果基本与上述研究相吻合。在术后1个月,两组动物缺损处均可见新生胆管细胞再生,并在术后6个月新生胆管在外观上与正常胆管相同。镜下,两组支架内新生组织中均可见与正常胆管细胞相似的排列整齐的由新生胆管上皮细胞组成的单层粘膜。与正常胆管组织不同的是,新生胆管组织中仅见少量腺体,缺乏杯状细胞。我们认为可能是由于支架的刺激导致新生胆管发生化生而出现杯状细胞。腺体的大量增生一方面是新生组织生长活跃的表现,另一方面可能是支架刺激的结果。在术后相当长的时间内,上述现象可能消失。在术后1、3、6月两组动物血生化指标恢复正常。肝组织未见胆汁瘀滞及炎性细胞浸润,说明该方法引流效果好,不会对肝脏组织带来损害。
应用支架法修复缺损的胆管安全可行,并对胆管血供也有一定的保护作用,胆管断端连接处也实现了无张力,具有促进新生胆管形成的作用,真正达到了胆道重建的目的。我们希望可降解胆道修复材料早日问世,并将支架应用于临床。
[1]Lau WY,Lai EC,Lau SH.Management of bile duct injury after laparoscopic cholecystectomy:a review.ANZ J Surg,2010,80(2):75-81.
[2]Sinha S,Hofman D,Stoker DL,et al.Epidemiological study of provision of cholecystectomy in England from 2000 to 2009:retrospective analysis of Hospital Episode Statistics.Surg Endosc,2013,27(1):162-175.
[3]Downing SR,Datoo G,Oyetunji TA,et a1.Asian race/ethnicity as a risk factor for bile duct injury during cholecystectomy.Arch Surg,2010,145(8):785-787.
[4]Truant S,Boleslawski E,Lebuffe G,et a1.Hepatic resection for post-cholecystectomy bile duct Injuries:a literature review.HPB(Oxford),2010,12(5):334-341.
[5]Lubikowski J,Chmumwicz T,Post M,et a1.Liver transplantation as an ultimate step in the management of iatrogenic bile duct injury complicated by secondary biliary ciIrhosis.Ann Transplant,2012,17(2):38-44.
[6]Gao JB,Bai LS,Hu ZJ,et a1.Role of Kasai procedure in surgery of hilar bile duct strictures.World J Gastroenterol,2011,17(37):423l-4234.
[7]Watanabe M,Tsuchiya M,Tamura A,et al.Use of an opened umbilical vein patch for the reconstruction of the injured biliary tract.Hepatobiliary Pancreat Surg,2007,14(3):270-275.
[8]Jiang H,Chu WJ,Wang W,et al.An experinaental study on repair of bile duct defect with autologous peritoneal duct.J Hepatopancreatobiliary Surg,2010,22(5):366-370.
[9]Mercado M A,Dominguez L.Classification and management of bile duct injuries.World JGastrointestl Surg,2011,20(4):43-48.
[10]Fatima J,Barton JG,Grotz T E,et al.Is there a role for endoscopic therapy as a definitive treatment for post-lapa-roscopic bile duct injuries.J Am Coll Surg,2010,211(4):495-502.
[11]Harrison VL,Dolan JP,Pham TH,et a1.Bile duct injury after laparoscopic cholecystectomy in hospitals with and without surgical residency programs:is there a difkrence Surg Endosc,2011,25(6):1969-1974.
[12]Wu YV,Linehan DC.Bile duet injuries in the era of laparoscopic choIecystectomies.Surg Clin North Am,2010,90(4):767-802.
[13]Selmi C,Affronti A,Ferrari L,et al.Immune-mediated bile duct injury:The case of primary biliary cirrhosis.World J Gastrointest Pathophysiol,2010,35(4):118-128.
[14]Kianicka B,Díte P,Piskac P,et al.Endoscopic approach in diagnosis and treatment of biliary complications after laparoscopic cholecystectomy.Hepatogastroenterology,2011,58(106):275-280.
[15]1nui H,Kwon AH,Kamiyama Y.Managing bile duct injury during and after laparoscopic cholecystectomy.J Hepatobiliary Pancreat Surg,1998,5(4):445-449.
[16]Tocchi A,Mazzoni G,Liotta G,et al.Late development of bile duct cancer in patients who had biliary-enteric drainage for benign disease:a follow-up study of more than l,000 patienis.Ann Surg,2001,234(2):210-214.
[17]Peng SY,Wang JW,Lau WY,et al.Conventional versus binding pancreatic ojejunostomy after pancreatieoduodeneetomy:a prospective randomized trial.Ann Surg,2007,245(5):692-698.
[18]Cai XJ,Lin H,Yu H,et al.Novel sutureless cholangiojejunostomy:initialexperience with 11cases.Am J Surg,2008,195(2):273-276.
[19]Cushieri A,Baker PR,Anderson RJL,et al.Total and subtotal replacement of the common bile duet:effect of transhepatic silicon tube stenting.Gut,1983,24(8):756-760.
[20]Hartung H,Wu rehner R,Baba N,et al.Histologieal,laboratory,and X-ay findings after repair of the common bile duct with a Teflon graft.World J Surg,1978,2(5):639-644.