刀豆蛋白A诱导的急性肝损伤小鼠血浆细胞外组蛋白的变化及意义*
2015-03-15朴正福陈德喜
温 韬,刘 焱,任 锋,朴正福,陈德喜
组蛋白是真核生物染色质的基本结构蛋白,主要包括H1、H2A、H2B、H3和H4等类型,其中后4种组蛋白组成八聚体结构,与外周环绕的双螺旋DNA片段结合成组蛋白-DNA复合物,称为核小体(Nucleosome)[1,2]。细胞凋亡或坏死时染色质发生降解,可释放组蛋白入外周血,即为细胞外组蛋白(Extracellular histones)[2~6]。新近研究发现,细胞外组蛋白是一种危险信号分子或炎性介质,在启动和加重炎症性损伤反应中起重要作用。细胞外组蛋白不仅可作为反映疾病严重程度的特异性标志物,还可望成为分子标靶用于临床干预治疗,是当前一个研究热点[4~9]。本研究通过给予小鼠尾静脉注射刀豆蛋白A(Concanavalin A,ConA)制备免疫性肝损伤模型,观察动物血浆细胞外组蛋白水平变化及其与肝功能、炎症因子等指标的关系,并通过给予特异性抗组蛋白中和抗体处理,观察对肝损伤的保护作用,以深入研究免疫性肝损伤的发病机制及可能的干预措施,以为临床和科研工作提供重要线索。
1 材料与方法
1.1 实验动物与试剂 选择8~10周龄健康雄性C57BL/6(B6)小鼠,体质量 20~26 g,由我校实验医学动物部提供。在室温18~22℃、光照周期12 h/12 h环境中饲养3 d后实验。实验前12 h和实验期间禁食,自由饮水。ConA购自美国Sigma公司;羊抗小鼠组蛋白H4多克隆抗体购自美国Cell Signaling公司;检测细胞外组蛋白ELISA试剂盒(Cell Death Detection Kit)为德国Roche公司产品;特异性抗组蛋白H4中和抗体由美国Oklahoma医学研究中心徐俊博士惠赠。Luminex检测系列细胞因子试剂盒为美国Affymetrix eBioscience产品。
1.2 免疫性肝损伤模型的制备 随机将24只小鼠分为正常对照组(4只)和实验组(20只)。再按不同时间点将实验组动物分为3、9、16和24 h 4个亚组,每组5只动物。实验组小鼠经尾静脉单次注射ConA(35 mg.kg-1),观察小鼠行为学改变,并在3 h、9 h、16 h和24 h取血和肝组织待测。另设干预组动物6只,在以ConA处理小鼠的同时,经腹腔注射特异性抗组蛋白H4中和抗体(25 mg.kg-1),16 h后取血和肝组织观察对肝损伤的影响。取小鼠眼眶内眦静脉血,加EDTA抗凝后于3000 g离心10 min,分离血浆,于-80℃冻存待测;取小鼠肝组织于10%甲醛溶液固定24 h以上,石蜡包埋,制备组织切片。同时以石蜡包埋的肝组织标本制备5 m切片,行HE染色,光学显微镜下观察组织损伤情况。
1.3 小鼠肝功能指标测定 使用日立7180型全自动生化分析仪测定血浆丙氨酸氨基转移酶(ALT)水平。
1.4 小鼠血浆细胞外组蛋白水平测定 核小体由组蛋白和DNA组成。我们首先采用ELISA法测定血浆核小体水平,以反映总的组蛋白水平。具体操作严格按说明书进行,以OD值表示组蛋白水平。根据文献报道,在5种组蛋白亚型中H4是起关键作用的核心蛋白[2,3]。因此,我们采用 Western blot法重点测定染毒小鼠血浆组蛋白H4水平。方法简述如下:取小鼠血浆100μl,用4×上样缓冲液直接裂解血浆,煮沸后经十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳、转膜、封闭,然后以羊抗鼠H4多克隆抗体(1:1000)进行孵育,用含吐温-20磷酸盐缓冲盐溶液(PBST)漂洗,以辣根过氧化物酶标记的驴抗羊IgG(美国Santa Cruze公司,1:2000)进行二抗反应。最后,在暗室中以增强化学发光液(Enhanced chemiluminescence,ECL,美国Pierce公司)进行显色、曝光。
1.5 细胞因子水平测定 采用Luminex法测定染毒小鼠血浆IL-1、IL-6、IL-10和TNF-α水平。
1.6 统计学分析 应用SPSS 13.0统计软件,计量资料以()表示,进行单因素方差分析,采用 Log-rank检验分析小鼠生存率,P<0.05表示差异有统计学意义。
2 结果
2.1 肝损伤情况 正常对照组小鼠血浆ALT水平为(35.5±3.1)IU/L,ConA染毒小鼠血浆ALT水平明显升高,在3 h、9 h、16 h和24 h时分别为(106.5±25.5) IU/L、(769.1±138.2) IU/L、(1340.2±205.9)IU/L和(1304.7±300.7) IU/L,差异显著(P<0.01,图1),表明小鼠染毒后出现了严重的肝损伤。正常小鼠肝体积正常,呈鲜红色,表面光滑、边缘整齐。组织切片显示肝细胞、汇管区、胆管上皮细胞等形态结构完整,未见变性、坏死;ConA染毒小鼠3 h肝组织出现了部分肝细胞变性、坏死,12~24 h肝损伤明显加重。肝组织病理学显示,大量肝细胞肿胀变性,肝小叶内有不同程度的细胞凋亡和坏死,汇管区可见大量炎性细胞浸润(图2)。
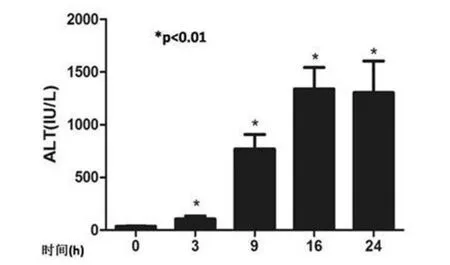
图1 小鼠ConA染毒后血浆ALT水平呈时间依赖方式升高
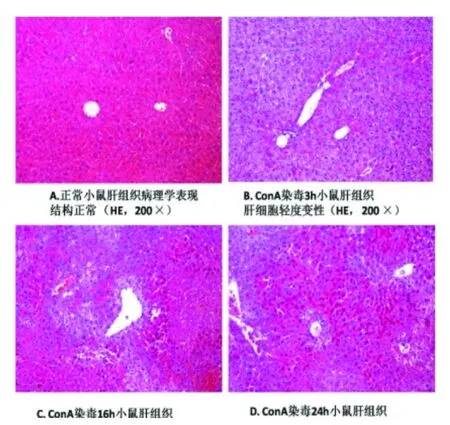
图2 ConA染毒小鼠的肝脏病理学表现
2.2 血浆细胞外组蛋白水平变化 正常小鼠血浆核小体水平(OD值)为(0.206±0.024),而ConA染毒小鼠血浆核小体水平显著升高;在染毒3 h、9 h、16 h和24 h时血浆细胞外组蛋白水平分别为(1.199±0.1087)、(2.467±0.197)、(2.655±0.2295)和(2.631±0.3014),与对照组比,差异非常显著(P<0.001,图3),并与肝损伤的严重程度相一致。Western blot测定结果显示,在正常小鼠血浆中未能检测到组蛋白H4,而ConA染毒小数3 h后细胞外组蛋白H4水平显著升高,并持续存在24 h以上(图4),以上结果表明细胞外组蛋白水平与肝损伤发生发展密切相关。
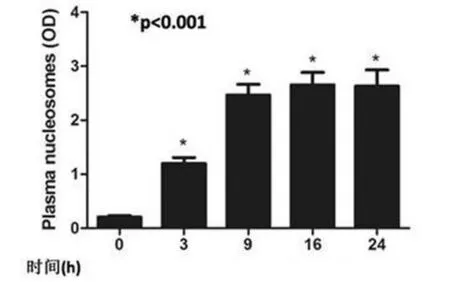
图3 ConA染毒小鼠血浆核小体水平呈时间依赖方式升高

图4 ConA染毒小鼠血浆中细胞外组蛋白
2.3 特异性抗组蛋白中和抗体的干预作用 为了验证细胞外组蛋白在ConA所致急性肝损伤中的具体作用,我们以相同剂量的ConA处理小鼠,并给予特异性抗组蛋白H4中和抗体进行干预。结果可见,经抗组蛋白H4中和抗体干预的小鼠死亡率明显下降(图5),小鼠的肝损伤亦得到明显改善,表现为干预组小鼠在染毒16 h时血浆ALT水平显著低于染毒组,组织病理学检查显示肝细胞坏死的区域减少,提示细胞外组蛋白是一种重要的促炎介质,能显著加重肝损伤,甚至导致动物死亡。
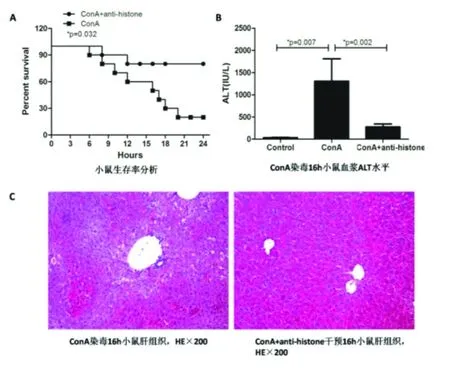
图5 特异性抗组蛋白中和抗体干预小鼠血清ALT和肝组织学变化
2.4 小鼠血浆细胞因子水平变化 为了深入探讨抗组蛋白中和抗体保护作用的机制,我们测定了小鼠血浆系列细胞因子水平,结果发现染毒小鼠血浆IL-1、IL-6、IL-10和TNF-α水平均明显高于正常组;抗组蛋白H4中和抗体处理小鼠血浆细胞因子水平明显下降,其中IL-6和TNF-α水平显著低于染毒组,差异有统计学意义(表1),提示特异性抗细胞外组蛋白中和抗体保护肝损伤作用是通过抑制炎症因子的释放来实现的。
表1 各组小鼠血浆细胞因子水平(pg/m l,)变化

表1 各组小鼠血浆细胞因子水平(pg/m l,)变化
与正常组比,①P<0.05;与模型组比,②P<0.05
正常组模型组抗组蛋白只 4 5 6 IL-1 IL-6 IL-10 TNF-α 2.25±0.56 3.40±1.13 1.19±0.08 0.86±0.0712.64±3.75① 238.10±48.56① 4.43±0.33① 16.52±2.43①6.98±2.52 16.98±3.67② 3.29±0.22 3.25±0.67②
3 讨论
当细胞发生凋亡或坏死时,可释放大量危险信号分子或活性物质,这类物质被称为损伤相关分子模式(Damage associated molecular pattern,DAMP)分子,在体内经Toll样受体(TLR)或Nod样受体(NLR)信号通路激活天然免疫细胞,诱导免疫应答[10~14]。目前,已经发现数十种DAMP分子,主要包括高迁移率族蛋白1(HMGB1)、热休克蛋白、肝素、抗菌肽/防御素、线粒体DNA等[15,16]。DAMP分子不仅可作为生物标志物反映细胞损害程度,而且是传递细胞损伤或应激信息,启动和促进一系列炎症级联反应的核心介质,参与多种疾病的发生[11~13]。细胞外组蛋白是新近发现的一种DAMP分子,在启动和加重肝脏炎症性损伤反应中起重要作用[8,17]。细胞外组蛋白不仅可作为分子标志物显示疾病的严重程度,还能促进下游细胞因子如TNF-α等大量释放以介导免疫性损伤反应[2~6]。Wen et al研究发现,在D-氨基半乳糖/脂多糖联用诱导的小鼠急性肝衰竭时,细胞外组蛋白水平显著升高,并可进一步激活炎症信号通路,促进炎性因子释放,加重组织细胞损伤。给予特异性抗组蛋白抗体中和循环中的游离组蛋白能有效降低致死率,减轻炎症反应[3]。Huang et al在缺血再灌注肝损伤(非感染性炎症反应)小鼠模型探讨了细胞外蛋白的变化规律和作用机制,发现细胞外组蛋白在体内主要经TLR信号通路激活天然免疫细胞,诱导免疫应答反应,而给予特异性抗组蛋白中和抗体亦能显著减轻肝脏炎症反应[4]。
在本研究中,我们通过给予特异性抗组蛋白H4中和抗体,实验结果显示,给予小鼠尾静脉注射ConA能诱导典型的肝损伤,而给予抗组蛋白中和抗体干预后,染毒小鼠肝损伤得到显著改善。有文献报道,细胞外组蛋白释放后可激活Kupffer细胞等天然免疫细胞,分泌大量炎性因子促进和加重炎症反应[3,5,18~20]。我们的研究亦证实,抗组蛋白中和抗体能有效降低小鼠血炎症因子水平,从而发挥抗炎作用。以上结果表明,细胞外组蛋白不仅可作为急性肝损伤发病的生物标志物,用于判断疾病的严重程度和预后,而且还是一种重要的炎性反应介质,切断组蛋白从细胞内向细胞外的释放途径或以组蛋白为靶点进行干预,可望能从更深层面控制肝脏炎症的发生和发展,而成为一种阻止肝损伤发展的新策略。
[1]Bannister AJ,Kouzarides T.Regulation of chromatin by histone modifications.Cell Res,2011,21:381-395.
[2]Xu J,Zhang XM,Pelayo R,et al.Extracellular histones are major mediators of death in sepsis.Nat Med,2009,15:1318-1321.
[3]Wen Z,Liu Y,Li F,et al.Circulating histones exacerbate inflammation in mice with acute liver failure.J Cell Biochem,2013,114:2384-2391.
[4]Huang H,Evankovich J,Yan W,et al.Endogenous histones function as alarmins in sterile inflammatory liver injury through Toll-like Receptor 9.Hepatology,2011,54:999-1008.
[5]Xu J,Zhang XM,Monestier M,et al.Extracellular histones are mediators of death through TLR2 and TLR4 in mouse fatal liver injury.J Immunol,2011,187:2626-2631.
[6]温韬,陈德喜.细胞外组蛋白与重型肝炎发病的关系研究进展.中华临床医师杂志:电子版,2012,6:7754-7756.
[7]Abrams ST,Zhang N,Manson J,et al.Circulating histones are mediators of trauma-associated lung injury.Am J Respir Crit Care Med,2013,187:160-169.
[8]Allam R,Kumar SV,Darisipudi MN,et al.Extracellular histones in tissue injury and inflammation.JMol Med,2014,92:465-472.
[9]Chen R,Kang R,Fan XG,et al.Release and activity of histone in diseases.Cell Death Dis,2014,5:e1370.
[10]Akira S,Uematsu S,Takeuchi O.Pathogen recognition and innate immunity.Cell,2006,124:783-801.
[11]Chen GY,Nunez G.Sterile inflammation:sensing and reacting to damage.Nat Rev Immunol,2010,10:826-837.
[12]Zhang Q,Raoof M,Chen Y,et al.Circulating mitochondrial DAMPs cause inflammatory responses to injury.Nature,2010,464:104-107.
[13]Henson PM.Dampening inflammation.Nat Immunol,2005,6:1179-1181.
[14]Davis BK,Wen H,Ting JP.The inflammasome NLRs in immunity,inflammation,and associated diseases.Annu Rev Immunol,2011,29:707-735.
[15]Evankovich J,Cho SW,Zhang R,et al.High mobility group box 1 release from hepatocytes during ischmia and reperfusion injury is mediated by decreased histone deacetylase activity.J Biol Chem,2010,285:39888-39897.
[16]Craig DG,Lee P,Pryde EA,et al.Circulating apoptotic and necrotic cell death markers in patients with acute liver injury.Liver Int,2011,31:1127-1136.
[17]蒋训,高蕾,余卫平.胞外组蛋白,一种新发现的内源性损伤相关分子模式分子.安徽医科大学学报,2013,48:1421-1424.
[18]于慧杰,盛国光.三种品系小鼠对伴刀豆球蛋白A所致急性肝损伤的耐受性比较研究.实用肝脏病杂志,2014,17:168-171.
[19]Jaeschke H,Gujral JS,Bajt MT.Apoptosis and necrosis in liver disease.Liver Int,2004,24:85-89.
[20]Pisetsky DS. Immune activation by histones:plusses and minuses in inflammation.Eur J Immunol,2013,43:3163-3166.