红景天苷对原代培养脂肪变性大鼠肝细胞细胞色素P4502E1蛋白表达的抑制作用*
2015-03-15关莉莉
田 丽,尹 玲,关莉莉,戴 宁
非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)是一种无过量饮酒史、以肝实质细胞脂肪变性和脂肪堆积为特征的临床病理综合征。随病程的进展,其疾病谱包括单纯性脂肪肝、非酒精性脂肪性肝炎、肝硬化甚至肝细胞癌。NAFLD与肥胖、胰岛素抵抗、高血压以及高脂血症密切相关,并被认为是代谢综合征在肝脏的表现[1,2]。近年来,由于我国国民生活水平的快速提高、生活方式的巨大转变,NAFLD的发病率呈现快速增长的态势,在经济发达城市,NAFLD在一般人群中的发病率已达15%~30%[3]。因此,积极探索NAFLD的综合防治措施具有十分重要的意义。我们前期的研究结果表明,藏药红景天的主要药理成分红景天苷(Salidroside,SDS)能有效抑制高脂高胆固醇饮食诱导的NAFLD大鼠肝组织氧应激[4]。本研究进一步从细胞水平研究了SDS对原代培养大鼠肝细胞脂肪变性的防治机理,现将结果报告如下。
1 材料与方法
1.1 动物、药品与试剂 清洁级雄性SD大鼠10只,体质量150~180 g,由本校实验动物中心提供。SDS粉剂由陕西森弗高科实业有限公司提供(纯度﹥98%),D-Hanks液、DMEM高糖培养基、胎牛血清购自美国Gibco公司;二甲亚砜(DMSO)购自上海生工公司;I型和Ⅳ型胶原酶、台盼蓝染料、棕榈酸(Palmitic acid,PA)购自美国Sigma公司;鼠尾胶原蛋白I型购自杭州生友生物公司;BCA蛋白浓度测定试剂盒、RIPA裂解液由碧云天公司提供;兔抗鼠细胞色素 P4502E1(Cytochrome P4502E1,CYP2E1)多克隆抗体购自Abcam公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG购自上海康成生物工程有限公司;ECL化学发光试剂盒购自美国Pierce公司。
1.2 大鼠肝细胞的分离与原代培养 给予3%戊巴比妥钠(0.2 ml/100 g)腹腔注射麻醉大鼠,在超净台内打开腹腔,游离门静脉,使用18 G留置针穿刺插入门静脉,固定,灌注37℃预热的D-Hanks液,待肝脏充分膨胀后,立即剪断下腔静脉,继续灌注直至肝脏变为土黄色,改为灌注37℃预热的含0.05%Ⅳ型胶原酶的DMEM溶液20 min。完整分离全部肝脏,剪碎肝组织,置于预冷(4℃)的含胶原酶的DMEM溶液中消化10 min,以100目不锈钢滤网过滤,获得细胞悬液,离心收集细胞(4℃,500 r/m,2 min,重复 3次),PBS清洗2次,台盼蓝染色检测细胞活率,倒置显微镜下观察细胞形态,调整细胞数至2×106/ml,接种于鼠尾胶原蛋白I型包被过的培养皿(60 mm),以含10%胎牛血清的DMEM高糖培养液于37℃、5%C02培养箱内培养6 h,更换培养液,洗去未贴壁细胞,此后每24 h更换一次培养液。选取培养48 h的大鼠原代肝细胞,更换新鲜培养液,将一定数量的肝细胞接种于24孔培养板,100μl培养液/孔,待细胞完全贴壁后分3组:正常对照组(未添加任何实验药物)、0.25 mmol/L棕榈酸模型组、0.25 mmol/L棕榈酸+红景天苷组(终浓度150μg/ml,加药与造模同步进行),每组设4个复孔,培养24 h。
1.3 检测方法 取细胞上清液,采用全自动生化检测仪检测ALT和AST水平;采用ELISA法测定丙二醛(MDA)含量(南京建成生物工程研究所);收集细胞,加入RIPA裂解液裂解细胞,3000 r/m离心,取上清,以BCA蛋白浓度试剂盒检测蛋白含量;按照试剂盒说明书操作测定甘油三酯(TG)含量(南京建成生物工程研究所提供)。
1.4 细胞内脂滴检测 收集细胞,PBS清洗3次,4%甲醛溶液固定30 min,油红O(南京建成生物工程研究所)避光染色30 min,PBS清洗30 s,光镜下观察。
1.5 细胞CYP2E1蛋白表达的检测 采用Western blot法,收集细胞,以RIPA细胞裂解液、抽提细胞总蛋白,取蛋白样品50μg行SDS凝胶电泳,以湿法电转至PVDF膜上,5%脱脂牛奶封闭2 h,加入抗CYP2E1(1:1000) 4℃孵育过夜,室温复温 30 min,TBS清洗 2次,加入 HRP标记的二抗(1:5000),室温孵育1 h,TBS漂洗,GAPDH为内参,将膜用化学发光试剂孵育1 min,于X光胶片上曝光,常规显影、定影。
1.6 统计学分析 应用SPSS 13.0统计软件,计量资料以()表示,组间比较采用多重方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 原代培养大鼠肝细胞产量及形态变化 采用改良原位两步灌流法及多次低速离心分离原代大鼠肝细胞,每只大鼠可以获得1.50×108~1.80×108个肝细胞。经台盼蓝染色示肝细胞存活率>90%。倒置显微镜下观察肝细胞,在培养4 h,肝细胞基本贴壁,细胞呈卵圆形,胞体变大变平,呈散在分布,可见双核或单核肝细胞;24 h后见肝细胞形状变得不规则,有向外延伸的趋势,胞体明显增大平展,相邻的细胞开始建立连接;48 h后见肝细胞呈不规则多角形,相邻肝细胞相互连接更加紧密,形成条索状或岛状结构,见图1。
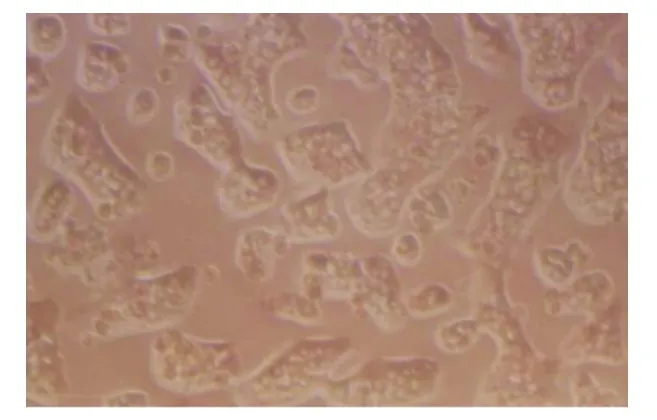
图1 培养48 h原代大鼠肝细胞(200×)
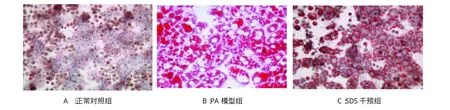
图2 培养肝细胞内脂滴沉积的变化(油红O染色,100×)
2.2 各组肝细胞脂滴沉积的变化 在光镜下,油红O染色30 min显示,正常对照组肝细胞内可见极少量脂滴沉积;PA模型组肝细胞内可见大量脂滴沉积;红景天苷干预组可见肝细胞内脂滴沉积明显减少,见图2。
2.3 培养上清ALT、AST、TG和MDA含量的变化 结果显示,与正常对照组比,PA诱导的脂肪变性肝细胞培养上清ALT、AST、TG和MDA含量均显著升高;与模型组比,红景天苷(150μg/ml)处理细胞培养上清ALT、AST、TG和MDA含量明显降低,见表1。
表1 3组细胞培养上清ALT、AST、TG和MDA含量(,n=4)的变化
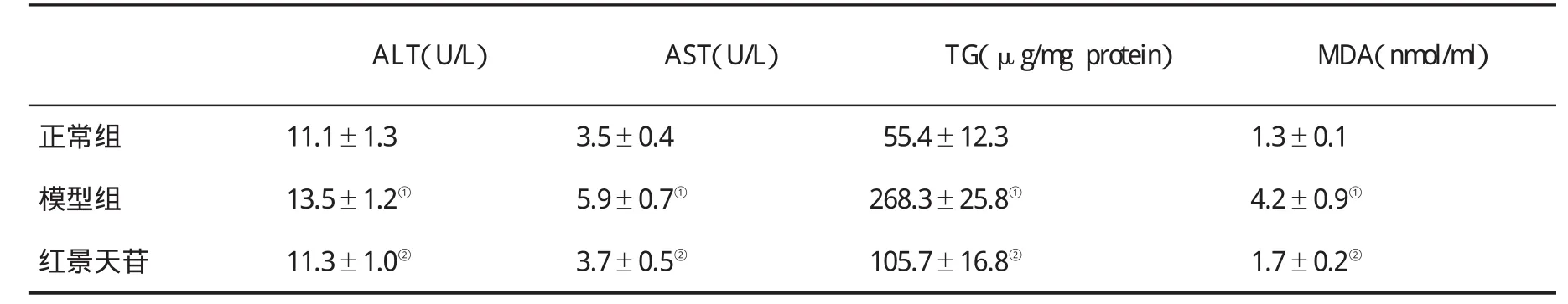
表1 3组细胞培养上清ALT、AST、TG和MDA含量(,n=4)的变化
与正常组比,①P<0.05;与模型组比,②P<0.05
ALT(U/L) AST(U/L) TG(μg/mg protein) MDA(nmol/m l)正常组 11.1±1.3 3.5±0.4 55.4±12.3 1.3±0.1模型组 13.5±1.2① 5.9±0.7① 268.3±25.8① 4.2±0.9①红景天苷 11.3±1.0② 3.7±0.5② 105.7±16.8② 1.7±0.2②
2.4 肝细胞CYP2E1蛋白表达的变化 结果显示,脂肪变性的肝细胞CYP2E1蛋白表达上调,而红景天苷(150μg/ml)处理细胞CYP2E1蛋白表达水平显著下调,见图3。
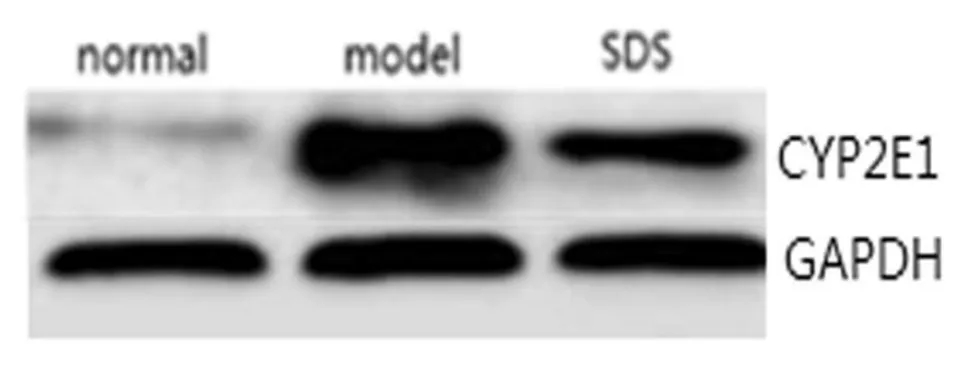
图3 各组细胞CYP2E1蛋白表达的变化 经Western blot法检测发现,红景天苷处理肝细胞蛋白表达下调
3 讨论
肝脏是体内脂质代谢的主要场所,肝内脂质过度或异常沉积是NAFLD的重要病理特征[5,6]。游离脂肪酸作为NAFLD发展中一个早期且至关重要的因素,与NAFLD的发病机制有密切的关系[7,8]。棕榈酸是分布最广的饱和脂肪酸。研究表明,棕榈酸可以诱导大鼠和小鼠原代培养肝细胞出现脂肪变性,同时肝细胞分泌炎性因子如IL-8和炎性小体增加[9,10]。我们在以0.25 mmol/L棕榈酸诱导大鼠原代培养肝细胞出现脂肪变的同时,发现反映肝细胞受损的指标ALT、AST水平和脂质过氧化产物MAD含量均明显升高,而红景天苷则可逆转肝细胞脂肪变性,使受损的肝细胞得到某种恢复。
NAFLD的发病过程经历“二次打击”过程。胰岛素抵抗(IR)是NAFLD发病的首次打击,也是始动中心环节[11~13],由于IR,胰岛素抑制脂肪酶活性下降,外周脂肪组织分解增多,导致血中游离脂肪酸(FFA)生成过多;其次,内脏型肥胖也增加了脂肪的分解速率,同样使FFA的生成增加;高脂饮食摄入的增多也可增加FFA的生成。大量的FFA通过门静脉系统进入肝脏,使肝细胞摄入过多的FFA,FFA或者经过线粒体β氧化或者经过甘油酯化而形成甘油三酯,导致肝细胞中的中性脂质堆积[14]。脂肪肝的形成降低肝细胞的解毒功能,使肝细胞对额外打击(如活性氧自由基等)的敏感性上升,更易产生严重的肝组织损伤。第二次打击则以氧化应激/脂质过氧化损伤为中心,导致单纯性脂肪肝进一步发展为脂肪性肝炎、肝纤维化甚至肝硬化[15,17]。其中,肝细胞色素P450系统是NAFLD肝细胞产生氧应激的一个重要来源。肝细胞色素P450系统是位于胞浆滑面内质网上的一组混合功能氧化酶系,与进入体内的外源性的物质代谢有关,人类确定的P450系统有20多种,其中CYP2E1是细胞色素P450系统的主要成分,从解毒功能的角度来看,CYP2E1比其它同工酶更为重要。给予CYP2E1基因缺失型小鼠高脂饮食,不但肝组织脂肪变明显减轻,而且肝组织也没有出现脂肪性肝炎的病理学改变[18]。CYP2E1转基因脂肪肝小鼠肝内CYP2E1过表达与肝损伤有密切的相关性,肝脂质过氧化标记物MDA和蛋白质氧化的标记物蛋白羰基含量相应升高,而抗氧化物如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物还原酶(GPx)活性则下降[19]。抑制肝组织CYP2E1表达,则能相应地减轻脂肪肝程度[20]。
我们的研究结果表明,红景天苷能抑制肝细胞CYP2E1的表达,同时肝细胞氧化应激水平下降,这或许是其防治NAFLD肝细胞脂肪变的主要机制之一。
[1]Castano D,Larequi E,Belza I,et al.Cardiotrophin-1 eliminates hepatic steatosis in obese mice by mechanisms involving AMPK activation.J Hepatol,2014,60(5):1017-1025.
[2]Parekh S,Anania FA.Abnormal lipid and glucose metabolism in obesity:implications for nonalcoholic fatty liver disease.Gastroenterology,2007,132(6):2191-207.
[3]范建高,潘勤.加强高脂血症脂肪肝的基础和临床研究.实用肝脏病杂志,2011,14(4):241-242.
[4]戴宁,邹原,王慧芳,等.红景天苷对非酒精性脂肪性肝炎大鼠肝组织氧应激的抑制作用.中国病理生理杂志,2013,29(9):1704-1707.
[5]Wang LJ,Zhang HW,Zhou JY,et al.Betaine attenuates hepatic steatosis by reducing methylation of the MTTP promoter and elevating genomic methylation in mice fed a high-fat diet.J Nutr Biochem,2014,25(3):329-336.
[6]Koo SH.Nonalcoholic fatty liver disease:molecular mechanisms for the hepatic steatosis.Clin Mol Hepatol,2013,19(3):210-215.
[7]Wang JW,Wan XJ,Zhu HT,et al.Lipotoxic effect of p21 on free fatty acid-induced steatosis in L02 cells.Plos One,2014,9(4):e96124.
[8]Ricchi M,Odoardi MR,Carulli L,et al.Differential effect of oleicand palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes.J Gastroenterol Hepatol,2009,24(3):830-840.
[9]Joshi-Barve S,Barve SS,Amancherla K,et al.Palmitic acid induces production of proinflammatory cytokine interleukin-8 from hepatocytes.Hepatology,2007,46(3):823-830.
[10]隋永恒,连敏,华静.体内外高脂对肝脏NLRP3炎性小体相关基因表达的影响. 中华肝脏病杂志,2014,19(1):12-16.
[11]Bell LN,Wang JX,Muralidharan S,et al.Relationship between adipose tissue insulin resistance and liver histology in nonalcoholic steatohepatitis:A pioglitazone versus vitamin E versus placebo for the treatment of nondiabetic patients with nonalcoholic steatohepatitis trial follow-up study. Hepatology,2012,56(3):1311-1318.
[12]Bril F,Lomonaco R,Orsak B,et al.Relationship between disease severity,hyperinsulinemia,and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology,2014,59(6):2178-2187.
[13]Lomonaco R,Ortiz-Lopez C,Orsak B,et al.Effect of adipose tissue insulin resistance on metabolic parameters and liver histology in obese patients with nonalcoholic fatty liver disease.Hepatology,2012,55(5):1389-1397.
[14]Egnatchik RA,Leamy AK,Noguchi Y,et al.Palmitate-induced activation of mitochondrial metabolism promotes oxidative stress and apoptosis in H4IIEC3 rat hepatocytes.Metabolism,2014,63(2):283-295.
[15]Koek GH,Liedorp PR,Bast A.The role of oxidative stress in non-alcoholic steatohepatitis.Clin Chim Acta,2011,412 (15-16):1297-305.
[16]Jin SH,Yang JY,Shin BY,et al.Resveratrol inhibits LXRαdependent hepatic lipogenesis through novel antioxidant Sestrin2gene induction.Toxicol Appl Pharmacol,2013,271(7):95-105.
[17]段晓燕,张诤,潘勤,等.鼠尾草酸对肥胖性脂肪性肝炎大鼠血清生化指标和肝组织学变化的影响.实用肝脏病杂志,2012,15(4):295-298.
[18]Abdelmegeed MA,Banerjee A,Yoo SH,et al.Critical role of cytochrome P4502E1(CYP2E1) in the development of high fat-induced non-alcoholic steatohepatitis.J Hepatol,2012,57(4):860-866.
[19]Kathirvel E,Chen P,Morgan K,et al.Oxidative stress and regulation of anti-oxidant enzymes in cytochrome P4502E1 transgenic mouse model of non-alcoholic fatty liver.J Gasrtoenterol Hepatol,2010,25(6):1136-1143.
[20]纳青青,谢华.三七总甙对非酒精性脂肪肝大鼠肝组织细胞色素P4502E1 表达的影响. 实用肝脏病杂志,2008,11(4):233-235.