浅谈二元弱酸酸式盐溶液中离子浓度大小的问题
2015-03-13朱卫华
朱卫华
(无锡市第一中学 江苏 无锡 214031)
高中化学研究盐类水解时,碳酸氢钠溶液中离子浓度大小是要涉及的问题。老师们通常会有以下的错误认识:HCO3-电离产生等量的CO32-和H+,H2O 也会电离出H+,因此想当然得出结论:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)[1-2]。姜广勇根据0.1mol·L-1的NaHCO3溶液pH=8.3,通过平衡常数计算得出结论c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)[3],但没有给出合理的解释;王文林用质子传递反应解释了此结论[4],但中学生较难理解。那么,能否简单易懂地得到结论,其它二元弱酸酸式盐溶液中离子浓度的大小是否也存在类似的关系呢?
由于二元弱酸酸式盐可能显酸性或碱性,本文分两种类型来讨论研究,试图找到其中的规律。
一、显碱性的二元弱酸酸式盐
多数二元弱酸酸式盐的酸式根离子水解强于电离,c(OH-)>c(H+),溶液呈碱性,比如NaHCO3、NaHS等,我们以0.1mol·L-1的NaHCO3溶液为例,分析其中离子浓度的大小并合理解释。
室温下,0.1mol·L-1的NaHCO3溶液中存在如下三个平衡:
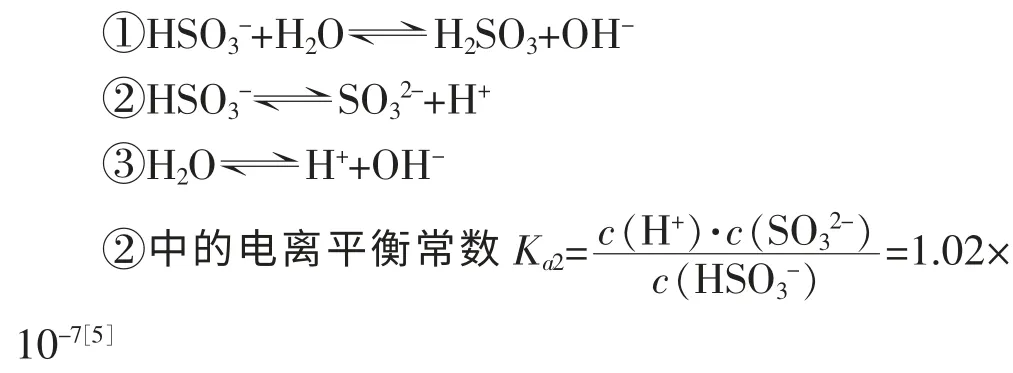
①HCO3-+H2O⇌H2CO3+OH-
②HCO3-⇌CO32-+H+
③H2O⇌H++OH-
已知0.1mol·L-1的NaHCO3溶液pH=8.3[6],即c(H+)=10-8.3mol·L-1=5.01×10-9mol·L-1,
则c(OH-)=2.00×10-6mol·L-1,c(HCO3-)≈0.1mol·L-1。将数据代入Ka2表达式中, 求出c(CO32-)=1.12×10-3mol·L-1,所以NaHCO3溶液中c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
我们可以这样来理解,HCO3-的水解大于电离,水解的本质就是结合H+,而Ka2>Kw,即HCO3-给出H+的能力大于H2O 电离出H+的能力,HCO3-必然会结合HCO3-电离出的H+, 因此虽然HCO3-会电离出等量的CO32-和H+,但部分H+会被水解的HCO3-结合,最终造成溶液中c(CO32-)>c(H+)。
至于c(CO32-)与c(OH-)的大小,表面上看只能通过计算结果来比较,其实也存在简单的判断方法。
由Ka2的表达式,可以得出:
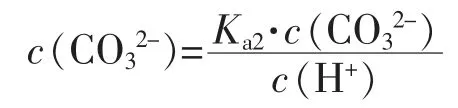
若c(CO32-)>c(OH-),则Ka2·c(HCO3-)>c(H+)·c(OH-),即Ka2·c(HCO3-)>Kw,对于0.1mol·L-1的NaHCO3溶液,显然此式成立。只有在很稀的NaHCO3溶液,c(NaHCO3)<1.78×10-4mol·L-1时,才会有Ka2·c(HCO3-)<Kw,造成c(CO32-)<c(OH-)。
同样道理,氢硫酸的Ka2=1.1×10-12>Kw,NaHS 溶液中的HS-水解会结合HS-电离出的H+, 造成NaHS 溶液中c(S2-)>c(H+)。若不是很稀的NaHS 溶液,当c(NaHS)>9.09×10-3mol·L-1时,Ka2·c(HS-)>Kw,则c(S2-)>c(OH-),此时NaHS 溶液中c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)。
其它显碱性的二元弱酸酸式盐中,离子浓度也存在类似的规律。
二、显酸性的二元弱酸酸式盐
有一些二元弱酸酸式盐的酸式根离子电离强于水解,c(H+)>c(OH-),溶液呈酸性,比如NaHSO3、NaHC2O4等,我们以0.1mol·L-1的NaHSO3溶液为例,分析其中离子浓度的大小并合理解释。
首先我们来计算0.1mol·L-1NaHSO3溶液的c(H+),NaHSO3溶液中存在质子守恒:
c(H+)+c(H2SO3)=c(SO32-)+c(OH-)
已知H2SO3[5]的Ka1=1.54×10-2mol·L-1,Ka2=1.02×10-7mol·L-1,根据H2SO3的Ka1和Ka2表达式,得到
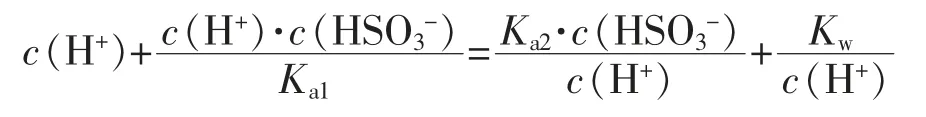
HSO3-电离和水解比较小,c(HSO3-)≈0.1mol·L-1,整理得到
由于0.1Ka2>>Kw
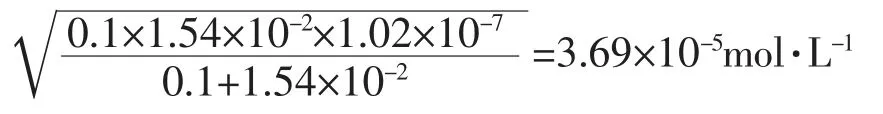
室温下,0.1mol·L-1的NaHSO3溶液中存在如下三个平衡:
c(H+)=3.69×10-5mol·L-1,则c(OH-)=2.71×10-10mol·L-1,c(HSO3-)≈0.1 mol·L-1。将数据代入Ka2表达式中,求出c(SO32-)=2.76×10-4mol·L-1,所以NaHSO3溶液中c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)。
我们也可以这样来理解,HSO3-的电离大于水解,溶液中的c(H+)>c(OH-),虽然HSO3-会电离出等量的SO32-和H+, 但Ka2>Kw,HSO3-给出H+的能力大于H2O电离出H+的能力, 部分H+会被水解的HSO3-结合,因此溶液中c(SO32-)>c(H+)。
有没有可能c(H+)>c(SO32-)呢? 李鹏飞[7]计算出,当c(NaHSO3)<4.71×10-5mol·L-1时,c(SO32-)>c(H+)。因此不是很稀的NaHSO3溶液中,c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)。
同样道理,其它比如NaHC2O4等显酸性的二元弱酸酸式盐中,离子浓度也存在类似的规律。
三、结论
对于不是很稀的二元弱酸的酸式盐NaHA, 我们基本可以得出结论:显碱性的二元弱酸酸式盐,c(Na+)>c(HA-)>c(A2-)>c(OH-)>c(H+);而显酸性的二元弱酸酸式盐,c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)。
对于很稀的二元弱酸酸式盐,就只能通过平衡常数计算比较大小了。
[1]树领.电解质溶液教学中常见疑难点的探究[J].化学教学,2013,(6):74
[2]许文.浅议溶液中微粒浓度大小的比较 [J].化学教学,2013,(9):72
[3]姜广勇.NaHCO3溶液中微粒浓度的定量计算[J].化学教学,2014,(4):72-73
[4]王文林.酸式盐溶液中的质子传递反应 [J].化学教学,2011,(8):69-70
[5]普通高中课程标准实验教科书.化学反应原理[M].南京:江苏教育出版社:100
[6]北京师范大学等.无机化学(上册)[M].北京:江苏教育出版社,1986:130-131
[7]李鹏飞.NaHSO3溶液中H+浓度真 的大于SO32-浓度吗?[J].化学教学,2011,(8):71-72
