基于“阅读—探讨—应用—反思”课堂教学模式的教学设计和反思
——以“化学反应速率”为例
2015-12-05蒋静
蒋静
(江苏省苏州中学 江苏苏州 215007)
基于“阅读—探讨—应用—反思”课堂教学模式的教学设计和反思
——以“化学反应速率”为例
蒋静
(江苏省苏州中学 江苏苏州 215007)
基于“阅读—探讨—应用—反思”的课堂教学模式,以化学反应速率的概念和影响因素为内容,来转变学生学习方式,促进学生以“自主、探究、合作”为主要方式的个性化学习,促进学生的全面发展和个性发展。
阅读;探讨;应用;反思;教学设计
现行课程标准强调要转变学生的学习方式,倡导主动学习、探究学习、合作学习。如何转变学生学习方式?只有教师教学方法的改变,才能引领学生学习方式的改变。教师如何组织课堂教学,才能引导、帮助和促进学生改变学习方式?笔者认为,针对当前的课堂教学,“阅读—探讨—应用—反思”这一模式能较好地突出学生的主体地位,促进学生发展。
笔者以苏教版化学2中第二单元 “化学反应速率”内容为例,应用“阅读—探讨—应用—反思”课堂教学模式开展教学,对该模式有了进一步的理解和认识,试从以下两个方面来阐述。
一、教学设计
1.设计思想
阅读:教师根据教学内容,创设一种现实情境,提供精心设计的材料(可书面材料,也可感性材料),激发学生阅读兴趣,让学生在阅读中梳理知识,同时发现自己要探究的问题或不懂的问题。通过个体独立学习来培养自主学习能力,培养独立发现问题能力。
探讨:在个人独立学习的基础上,引导学生探究和讨论。在课堂中,对教师提出的问题或自己发现的问题与同学、教师展开讨论,或查阅资料或动手实验解决问题。在交往中培养学生协作、探究的能力。
应用:把学生探究的结论、总结的规律应用于新情境的过程。这个过程可以检验结论规律的正确性,也可以拓展思维,起到举一反三、以点带面的作用。
反思:将知识方法系统化结构化的过程,也是学生建构知识系统的必要过程。将知识方法系统化结构化的过程,有利于学生对所学新知有一个全面系统的了解和认识。通过反思,还可以发现学习中存在的问题和不足,有利于推进下一个学习进程。
2.教材分析
“化学反应速率”的知识在苏教版中分散在必修《化学2》和选修《化学反应原理》两个模块中。在必修《化学2》中只需要学生建立化学反应速率的概念,初步认识影响化学反应速率的影响因素,并能应用其解释生活生产中某些现象,为接下来选修模块中定量测量化学反应速率,实验定量测定反应速率影响因素,并从微观进行解释打下基础。
3.学情分析
初中教材中,学生已知金属与酸反应的快慢、铁丝与氧气和空气分别反应的难易程度等,这为学生学习化学反应速率的概念建立了感性认识。物理学科中,学生已能熟练掌握和应用“速度”这一物理量,为类比学习“化学反应速率”概念打下基础。
4.教学目标
知识与技能:能用化学反应速率描述化学反应的快慢,初步学会化学反应速率的简单计算,知道影响化学反应速率的因素。
过程与方法:能够设计简单的实验方法探究影响化学反应速率的因素,引导学生在实验中学会猜想、设计、验证与归纳,体会化学学习与研究的思维方法。
情感态度与价值观:能体会到实验是化学学习的重要手段,培养科学探究意识和实事求是的科学精神。
5.教学重点
反应速率的定义与计算。
影响化学反应速率的外界因素。
二、教学过程
[视频播放]焰火表演
[教师引导]表演场面十分壮观,其中每一发焰火发生燃烧反应的快慢控制十分重要。那如何判断反应的快慢呢?
[演示实验]镁、铁分别与盐酸的反应
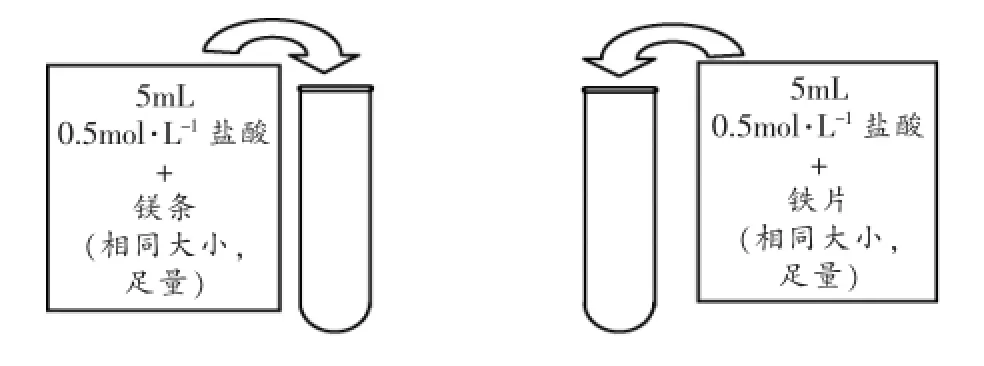
[学生活动]学生观察现象,并得出结论。
镁与盐酸反应快。判断依据是单位时间内产生气体的量的多少。
[教师引导]气体的测量比较困难,有没有其他物理量的变化也可以用来判断反应快慢呢?
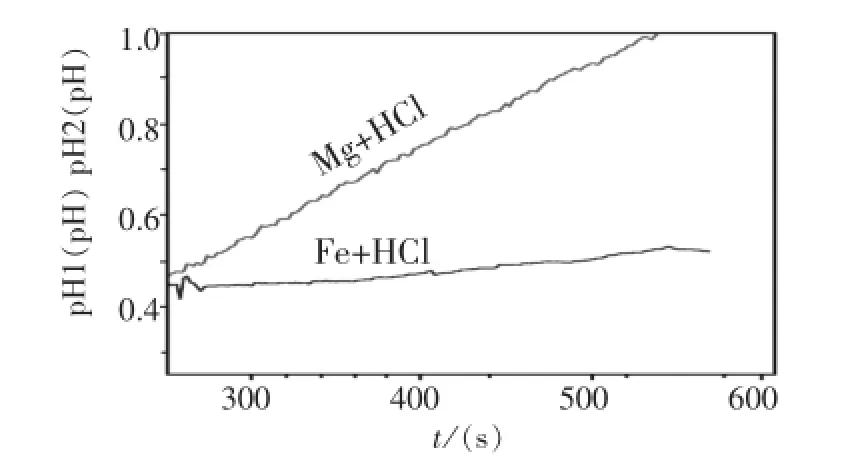
[演示实验]用pH传感器测量上述实验的pH变化。
[学生活动]学生观察定量结果,并得出结论。
镁与盐酸反应快。判断依据是单位时间内溶液pH变化的多少,也就是单位时间内溶液中H+浓度变化的多少。
[教师讲述]这就是通常衡量化学反应速率大小的物理量。请打开课本,看课本定义。
[师生活动]归纳总结知识
[板 书]一、化学反应速率
1.定义:
2.数学表达式:
[知识应用]反应4NH3+5O2⇌4NO+6H2O在2L的密闭容器中进行,NO的物质的量随时间变化如图所示,则此反应开始至2min,反应速率用NO来表示为多少?用O2来表示又是多少?
[学生活动]解答并总结规律。
[师生总结]
1.反应速率是指一段时间内的平均反应速率。

2.同一个化学反应中,可以用不同的物质表示反应速率,其数值之比等于化学方程式中相应的化学计量数之比。 因此,必须指明用哪种物质表示反应速率。
[知识应用]反应A(g)+3B(g)=2C(g)+2D(g)在4种不同情况下反应速率分别为:
①υ(A)=0.15 mol/(L·s) ②υ(B)=0.6 mol/(L·s)0
③υ(C)=0.4 mol/(L·s) ④υ(D)=0.45 mol/(L·s)
反应进行快慢顺序为________________。
[学生活动]解答。
[过 渡]由此可见,我们可以用化学反应速率定量判断反应速率的快慢,生活中的化学反应有快有慢。下列过程哪些速率大,哪些速率小?你希望上述过程是快些还是慢些?
[投影图片]定向爆破、火箭发射、钢铁生锈、食物腐烂。
[学生活动]学生回答。
[教师引导]那反应速率快慢又受哪些因素影响呢?
[学生活动]学生阅读课本,并总结。
[教师引导]这些因素会如何影响化学反应速率呢?请同学们利用以下药品,选择1~2个你认为可能会影响化学反应速率的因素,设计实验探究该因素如何影响反应速率。
药品:4%H2O2、12%H2O2、FeCl3溶液、0.5mol·L-1盐酸、冷水、热水、二氧化锰粉末、CaCO3(粉末)、CaCO3(块状)(已知FeCl3溶液一定程度能加快H2O2分解)
[学生活动]设计实验、验证结果、归纳结论。

影响因素 影响结果浓度 增大反应物浓度,反应速率加快温度 升高温度,反应速率加快催化剂 使用催化剂,反应速率加快压强 对于有气体参加的反应,增大压强,反应速率加快接触面积 增大接触面积,反应速率加快
[教师引导]1.固体、纯液体的浓度视为常数,故改变固体或纯液体的量不改变反应速率。
2.决定反应速率最根本的内因是反应物的性质。
[板 书]3、影响因素
[知识应用]根据已学知识,解释下列现象:
★食物储存在冰箱中不易变质。
★工业合成氨要在高压下进行。
★红热的铁丝在纯氧中燃烧更剧烈。
[学生活动]学生回答。
[知识应用]已知发生如下反应时,
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2+8H2O
KMnO4的反应速率随时间变化如图所示:
如何解释反应开始时速率较慢,后来速率迅速加快?

[学生活动]提出猜想:MnSO4可能起催化剂作用。

设计实验
[教师演示,检验猜想]
[学生活动]交流讨论,得出结论。
现象:第二组褪色速率更快。结论:Mn2+可能起催化剂作用。
[课堂总结]本课研究了反应速率的定义、计算及影响因素。人类研究反应速率,其目的是为了控制反应速率。而控制反应速率,对于提高生产效率、减少浪费、美化生活都有着重要的意义。期待大家在今后的学习工作中,能在控制反应速率方面做出自己的贡献。
三、教学反思
1.教学环节分析
课堂分两条线采用了 “阅读—探讨—应用—反思”的教学模式,分别是化学反应速率的概念学习和反应速率影响因素的学习。
在化学反应速率的概念引入中,先后用烟火表演的视频和镁、铁与盐酸反应的实验现象这些感性材料的展示,来使学生产生企盼渴知的心理,激发学生的兴趣。学生在视频观看、实验现象的观察中来提出问题、思考问题——如何判断化学反应的快慢?然后通过学生相互的讨论,教师的引导,实验的探索、教材的阅读,得出化学反应速率的定义:单位时间内反应物浓度的减少或生成物浓度的增加。然后,把学生总结的规律,获得的结论及时加以应用。在知识应用环节的两个计算中,引导学生进行反思:发现用不同反应物生成物表示同一反应在同一段时间的速率时,数值不完全相同,从而完善化学反应速率表示的特点。
在反应速率影响因素的学习过程中,直接通过教材的阅读,学生思考、总结、归纳,初步罗列影响因素。然后提供相关试剂,由学生自主设计实验方案,动手操作,验证实验结果。然后将结论应用于日常的生活生产,进而反思在实际生活生产中各个因素其实并不是单一影响化学反应速率的,而是综合影响的结果。
课堂上,学生通过自主阅读获得的结论,自主实验验证,极大的引发了学生的探究欲望,激活学生的思维。在教学过程中每一组学生都设计了多个方案,实验过程中不停质疑,相互争论,充分反映了学生思维的灵动和投入。用不着教师去重复一个一个的知识点,通过学生的自主探究便发现和建构了知识链。
事实证明,“阅读—探讨—应用—反思”的教学模式是有利于转变学生的学习方法的。教学环节中的阅读和反思,有利于培养学生学习过程中的自主意识,培养学生在学习过程中的自主判断,自主选择和自主承担的能力。探讨和应用环节,有利于促进学生之间和师生之间的互动和交流,在这一过程中学生不仅能够交流自己的思想和观点,还能从同伴的思考中吸取经验,获得启示,分享学习经验,培养学生合作的品质。本教学模式较好地将自主学习、合作学习、探究学习等学习方式融为一体。
2.现代数据采集技术和传统实验有机结合
数据采集技术具有方便、精确、细微化等优势。可提高实验的探索性,使信息技术从学习对象转变为学习工具。本节课就利用了pH传感器来采集镁、铁与盐酸反应过程中pH值随时间的变化来展示反应的快慢,提高了演示实验效果和水平,为化学实验提供了一种新的计算机辅助教学模式。但传统的化学实验也有其不可替代的优势,它往往操作简单,现象明显,性质稳定,更容易上手,也更能培养学生的动手能力,所以本节课的学生实验全部进行传统实验。有机结合现代和传统的实验手段,能开拓学生的视野,大大扩展学生思考设计实验方案的空间,进而促使学生的自主学习。
[1] 严建波,毛明.“阅读-探讨-应用-反思”化学课堂教学模式研究[J].化学教与学,2012,(12):5-7
[2] 朱征.“影响化学反应速率的因素”教学设计[J].化学教学,2010,(9):37-39
1008-0546(2015)08-0065-03
G633.8
B
10.3969/j.issn.1008-0546.2015.08.024
