离子浓度大小比较的教学策略及教学题组设计
2015-03-13管建华
管建华
(江苏省如东高级中学 江苏 如东 226400)
一、教学背景
离子浓度大小比较问题是高考的“热点”之一。决定离子浓度大小的因素很多,比如溶解度、物质的量浓度、电离、水解程度、化学反应等。该类题考查知识点多,灵活性、综合性较强,有较好的区分度,可有效地考查考生对强弱电解质、电离平衡、水的电离、溶液的pH、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。在教学过程中, 如果教师不能提纲挈领,抓住解决问题的关键,学生就会如雾里看花,错误率高。所以,离子浓度大小比较问题一直是教学的重点和难点。
二、教学策略
1.构建思维基点
(1)电离理论
①强电解质完全电离,弱电解质部分电离,弱电解质电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在。例如NH3·H2O 溶液中微粒浓度大小关系是c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
②多元弱酸的电离是分步的,其主要是第一级电离(第一步电离程度远大于第二步)。如在H2CO3溶液中:H2CO3、HCO3-、CO32-、H+的浓度大小关系是c(H2CO3)>c(H+)>c(HCO3-)>c(CO32-)。
(2)水解理论
①弱电解质离子的水解损失是微量的(相互促进水解除外),但由于水的电离,故水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质溶液的浓度。如NH4Cl 溶液中:NH4+、Cl-、NH3·H2O、H+的浓度大小关系是c(Cl-)>c(NH4+)>c(H+)>c(NH3·H2O)。
②多元弱酸酸根离子的水解是分步进行的,其主要是第一步水解, 如在Na2CO3溶液中:CO32-、HCO3-、H2CO3、OH-的浓度大小关系应是c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)。
2.把握三种守恒
(1)电荷守恒规律
电解质溶液中,无论存在多少种离子,溶液都是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数。如Na2CO3溶液中存在着Na+、H+、HCO3-、CO32-、OH-,存在如下关系:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)。
(2)物料守恒规律
电解质溶液中,由于某些离子能够水解,离子种类增多,但元素总是守恒的。如Na2CO3溶液中CO32-、HCO3-都能水解, 故C 元素以CO32-、HCO3-、H2CO3三种形式存在,它们之间有如下守恒关系:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]。
(3)质子守恒规律

由图可得Na2CO3水溶液中质子守恒式可表示为:c(H3O+)+2c(H2CO3)+c(HCO3-)=c(OH-)或c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)。质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到。试题中出现的特殊守恒关系的判断往往借助电荷守恒与物料守恒的推导。
3.掌握分析方法

三、教学题组设计
新行为主义心理学创始人斯金纳认为,教学成功的关键就是精确地分析强化效果并设计特定的强化关联。其程序教学法要求:把教学材料科学的分解成循序渐进而又有机相互联系的程序性小问题,以便学生总是能积极反应,及时反馈学习成果。笔者对高考及模考试题进行系统解构,纵观全局,对离子浓度大小比较问题进行关联整理、分析比较,按照一定的逻辑顺序,设计如下分类教学题组。
1.单一溶质溶液中离子浓度大小的比较
对于单一溶质溶液中离子浓度大小判断,首先确定是酸、碱或者盐溶液,如果是酸、碱溶液,只需要考虑酸、碱的电离及水的电离;如果是盐溶液,首先考虑盐完全电离(绝大多数盐是强电解质),然后再考虑弱离子的水解,如果是酸式盐,还要考虑酸式根离子的电离和水解。
[例题1](2004年江苏高考第17 题)草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1KHC2O4溶液中,下列关系正确的是 ( )
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
C.c(C2O42-)>c(H2C2O4)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
[解析]A.根据电荷守恒c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),A 错误;B.根据物料守恒c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1 mol·L-1,B 项错误;C.因为草酸氢钾呈酸性,所以HC2O4-电离程度大于水解程度,故c(C2O42-)>c(H2C2O4),C 项正确;D.依据物料守恒,D 项正确。
值得注意的是,弱酸酸式盐溶液中离子浓度大小比较往往有分歧,如NaHCO3溶液,常见的观点有两种:1.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);2.c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),观点1认为水电离产生了H+,所以c(H+)>c(CO32-),事实上因为HCO3-水解大于电离,溶液显碱性,溶液中H+被OH-中和,故一般情况下c(CO32-)>c(H+),以上结论也可由H2CO3的一级、二级电离平衡常数推导得出,所以观点2 更符合事实。建议在中学教学中此类问题应该回避,不能误导学生。
2.不同溶液中同一离子浓度大小的比较
首先要分析不同溶液中溶质是强电解质还是弱电解质,相同浓度的溶液中,通常强电解质电离出离子浓度大于弱电解质,然后同类型进行比较,再观察不同溶液中其它离子对该离子浓度大小的影响,是促进电离(或水解),还是抑制电离(或水解)。
[例题2]在相同物质的量浓度的下列溶液中:
①NH4Cl ②NH4HSO4
③CH3COONH4④NH3·H2O
c(NH4+)由大到小的顺序为__________。若再补充等浓度的两种溶液⑤(NH4)2SO4⑥(NH4)2Fe(SO4)2结果为_________________________。
[解析]NH4Cl、NH4HSO4和CH3COONH4均为强电解质溶液完全电离,而NH3·H2O 为弱电解质,少部分电离出NH4+,所以④中c(NH4+)最小。①②③中存在NH4+的水解平衡:NH4++H2O⇌NH3·H2O+H+, ②中H+抑制NH4+的水解,所以②中c(NH4+)较大;③中CH3COO-与NH4+相互促进水解,所以③中c(NH4+)相对较小,答案为②①③④。
(NH4)2SO4和(NH4)2Fe(SO4)2的组成中所含NH4+数目为①②③的两倍,所以其同浓度盐溶液中c(NH4+)大于①②③中c(NH4+)。(NH4)2Fe(SO4)2中的两种阳离子NH4+和Fe2+相互抑制水解,从而(NH4)2Fe(SO4)2中c(NH4+)大于⑤中c(NH4+),答案为⑥⑤②①③④。
3.两种溶液混合后不同离子浓度大小的比较
首先要分析混合过程中是否发生化学反应,若发生反应,则要进行过量判断, 然后考虑物质在水溶液中的电离及可能存在的电离平衡、水解平衡以及抑制水解等问题,同时要注意混合后溶液体积的变化。
(1)酸碱中和型
①恰好中和型:给定的酸碱是等物质的量的反应(注意与常温下酸碱pH 之和等于14 的情况区别),反应结束后一定是生成正盐和水,故可把此类问题转化成是正盐溶液中离子浓度比较问题来解决。
②pH 等于7 型:酸碱中和反应(注意与恰好中和型区别)结束后一定是c(H+)=c(OH-),故分析此类问题从两方面入手:考虑从电荷守恒入手求得其它离子等量关系;判断pH 等于7 时,酸碱到底谁过量。
③反应过量型: 先判断反应后混合溶液的组成,再考虑溶质(产物及过量物质)电离或水解的情况。
[例题3](2014年广东高考第12 题)常温下,0.2mol·L-1的一元酸HA 与等浓度的NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如下图所示,下列说法正确的是 ( )

A.HA 为强酸
B.该混合液pH=7
C.图中X 表示HA,Y 表示OH-,Z 表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
[解析]A.一元酸HA 与等浓度的NaOH 溶液等体积混合后,两者恰反应,溶液中只有溶质NaA 且浓度为0.1 mol·L-1(注意混合后溶液体积变为两倍)。由图中A-离子浓度小于0.1mol·L-1,说明A-离子发生了水解,从而可知HA 是弱酸,故A 错误;B.水解显碱性pH>7,B 错误;C.溶液中除Na+,其它离子大小为c(A-)>c(OH-)>c(HA)>c(H+)可知C 错误;D.由物料守恒知D 正确。
[例题4](2015年泰州二模第15 题) 常温下,一元酸HA 溶液和NaOH 溶液等体积混合(忽略体积变化),实验数据如下表:
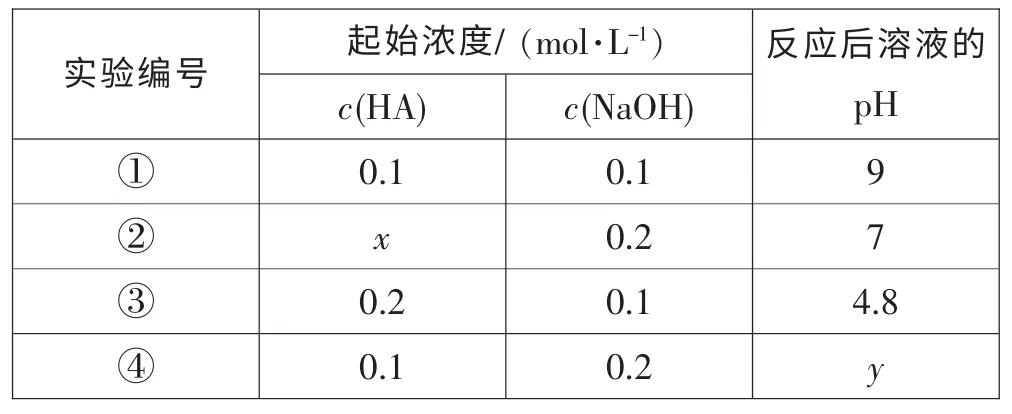
实验编号 起始浓度/ (mol·L-1) 反应后溶液的pH c(HA) c(NaOH)①0.1 0.1 9②x 0.2 7 0.2 0.1 4.8④0.1 0.2 y③
下列判断正确的是 ( )
B.实验②反应后的溶液中:c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-)
C.实验③反应后的溶液中:c(HA)+c(H+)=c(OH-)+c(A-)
D.实验④反应后的溶液中:c(OH-)-c(H+)-c(HA)=0.05 mol·L-1
[解析]A.①中刚好生成NaA,A-水解方程式为A-+H2O⇌HA+OH-,c(HA)≈c(OH-)=Kw/c(H+)=Kw/10-9mol·L-1,A 正确;B.由③知,反应后溶液为c(HA)∶c(NaA)=1∶1,溶液的pH=4.8,显酸性,所以HA 的电离大于A-的水解,则有c(A-)>c(Na+)>c(HA),而②中c(HA)小于0.2 mol·L-1,则c(HA)<c(NaA),所以c(Na+)>c (HA),B 错误;C.电荷守恒有:c (Na+)+c (H+)=c(OH-)+c(A-),而c(Na+)>c(HA),所以c(HA)+c(H+)<c(OH-)+c(A-),C 错误;D.反应后的溶液为c(NaOH)∶c(NaA)=1∶1,由物料守恒:c(Na+)=2c(A-)+2c(HA),结合电荷守恒方程式,消去c(Na+),得c(A-)+2c(HA)+c(H+)=c(OH-),由A 元素的物料守恒:c(A-)+c(HA)=0.1/2=0.05 mol·L-1,再消去c(A-),得c(OH-)-c(H+)-c(HA)=c(A-)+c(HA)=0.05 mol·L-1,D 正确。
(2)盐与酸(碱、盐)混合型
先判断反应后混合溶液的组成,再考虑溶质(产物及过量物质)电离或水解的情况。当酸(碱)的电离大于盐溶液中弱离子水解时,此时主要考虑电离对离子浓度造成的影响;反之可认为主要考虑离子水解对离子浓度造成的影响。
[例题5](2014年江苏高考第14 题)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.1mol/LCH3COONa 与0.1mol/LHCl 溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-)
B.0.1mol/LNH4Cl 与0.1mol/L 氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合
D.0.1mol/LNa2C2O4与0.1mol/LHCl 溶液等体积混合(H2C2O4为二元弱酸):
2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
[解 析]A.0.1mol/L CH3COONa 与0.1mol/L HCl等体积恰好反应混合生成醋酸和氯化钠,醋酸电离溶液显酸性,则c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),A正确;B.0.1mol/L NH4Cl 与0.1mol/L 氨水等体积混合(pH>7),这说明溶液显碱性,因此氨水的电离程度大于铵根的水解程度,则c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-),B 错 误;C.0.1mol/L Na2CO3与0.1mol/L NaHCO3溶液等体积混合,根据物料守恒可知正 确;D.0.1mol/L Na2C2O4与0.1mol/L HCl 溶液等体积混合(H2C2O4为二元弱酸),二者恰好反应生成草酸氢钠和氯化钠,则根据电荷守恒可知溶液中2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),D 不正确,答案为AC。
[例 题6](2012年 江苏高考第15题)25℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 值的关系如图所示。下列有关离子浓度关系叙述正确的是 ( )
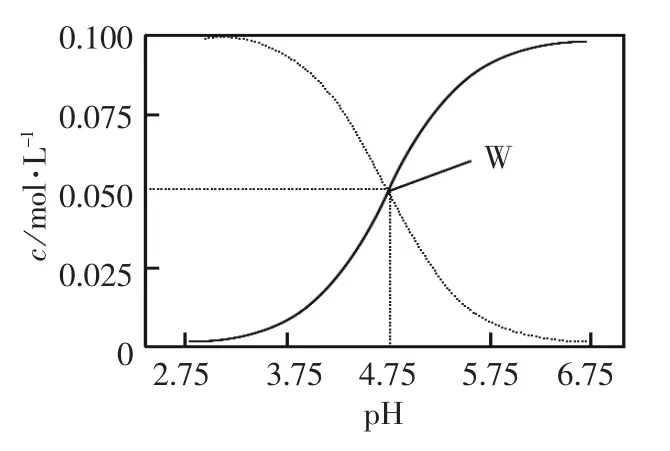
A.pH=5.5 溶液中:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点表示溶液中:
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.pH=3.5 溶液中:
c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W 点所表示溶液中通入0.05mol HCl 气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
[解析]A.pH=5.5 比4.75 大, 从曲线来看CH3COOH的电离在增大,CH3COO-的水解在减小,不可能出c(CH3COOH)>c(CH3COO-);B.W 点表示溶液中,根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)正确;C.pH=3.5 溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-)再把题干中的c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1代入即可;D.向W 点所表示溶液中通入0.05mol HCl 气体,原有平衡被打破,建立起了新的平衡。溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);物料守恒关系为2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1,不可能得出上述结论。所以综合上述B、C 正确。
四、教学反思
中学化学中有较多识记类知识,比如元素化合物知识,可以凭借记忆、经验思维解决问题。而离子浓度大小比较属于基本理论范畴,解决此类问题需要较强的逻辑思维能力,要立足三个思维基点:电离、水解和守恒(电荷守恒、物料守恒及质子守恒),分清电离、水解的主次关系,仔细审题,注意题干中的关键信息,同时要灵活运用多种解题方法,如:淘汰法、定理问题定性比(先判断碱酸性)、整体思维法等。反思该教学题组设计,目标明确、重点突出、分类合理、模型简明、内涵完整,学生在课堂上能作出积极回应,取得较好的教学效果。
[1]梁双霞.离子浓度大小比较的技巧与方法[J].中学生数理化(高考版),2012,(Z2):59-60
[2]王领军.溶液中离子浓度大小比较[J].化学教育,2006,(9):53-54
