水疱性口炎病毒糖蛋白的原核表达及间接ELIS A 诊断技术的试验
2015-03-11郭金玉张鹤晓高志强林祥超臧京帅王麒文牛建蕊张乐萃
郭金玉,张鹤晓,高志强,林祥超,臧京帅,王麒文,牛建蕊,张乐萃
(1.青岛农业大学动物科技学院,山东 青岛266109 ;2.北京出入境检验检疫局,北京 朝阳100026;3.北京森康生物技术开发有限公司,北京 怀柔101400)
水疱性口炎(vesicular stomatitis,VS)是由水疱性口炎病毒(VSV)所引起的、人畜共患的高度接触性传染病[1]。VSV有囊膜、是单股、负链不分节段的RNA病毒,属于弹状病毒科水疱性病毒属的成员,也被称为伪口蹄疫。VSV 主要分为两个血清型,其代表株分别为印第安纳株(VSV-IND)和新泽西株(VSVNJ)[2]。马、牛和多种动物都可发生感染,临床以蹄和口部产生水疱性损伤和溃烂为特征,引起动物产奶量、产肉量下降,对畜牧业的发展构成了极大的威胁。也可偶发于人,感染后出现急性热,类似流感和登革热的症状[3],严重影响人类的卫生健康。世界动物卫生组织(OIE)将其列为申报的传染病,但在我国进出境动物检疫对象中被列为二类病,属于外来病。在美国东南部的一些州如新墨西哥、亚利桑那、犹他州和科罗拉多州大约每隔10 年散在发生VS[4]。2004 年到2007 年美国西南部的9 个州发生751 起新泽西血清型的VS 疫情,给养殖业带来巨大的经济损失[5]。
在VSV 流行的地区,动物体内抗VSV-IND 抗体一般表现阳性, 但临床病例却多由VSV-NJ 引起[2]。目前,检测VSV-NJ 的补体结合试验和病毒中和试验方法比较复杂,耗时长。因此,本试验拟建立间接ELISA 快速有效的检测VSV-NJ 抗体,为进一步开发诊断试剂盒奠定基础。
1 材料与方法
1.1 主要试剂和仪器 HRP 标记的rec Protein G、IPTG(异丙基-β-D 硫代半乳糖苷)、TMB、CBS(碳酸盐缓冲液),由本实验室配制。
85-2 数显恒温磁力搅拌器、紫外分光光度计(Amersh am Biosciences 公司);酶标仪(BIO-RAD公司);3K15 高速低温离心机(Sigma 公司);紫外凝胶成像仪(BIO-RAD 公司);洗板机(BIO-RAD公司)。
1.2 重组质粒、宿主菌及血清 表达载体pET-32a-NJ-G666 由本实验室构建和保存;大肠杆菌(E.coli)Rosetta、出口马阴性血清,本实验室保存;VSV-NJ 阳性血清,用VSV-NJ 灭活病毒免疫阴性马制备。
1.3 水疱性口炎病毒糖蛋白的诱导表达 将重组质粒转化至Rosetta 宿主菌,挑取单菌落进行扩增培养后,次日按1∶100 的比例把重组表达菌株接种氨苄抗性LB 液体培养基中,37 ℃振荡培养至OD600nm 值为0.6 左右,加IPTG 进行诱导表达。分别对表达后的上清、沉淀进行SDS- PAGE检测,显示目的蛋白为包涵体。
1.4 包涵体的洗涤与溶解 用含低浓度尿素的Tris缓冲液洗涤包涵体,除去包涵体上粘附的杂质。最后用含高浓度尿素的Tris 缓冲液溶解包涵体。
1.5 包涵体的纯化与复性 将包涵体蛋白用His·Bind 试剂盒进行亲和层析纯化。
蛋白纯化后装于透析袋内,放置4 ℃透析复性。复性液梯度依次用含6、4、2、0 mol/L 的尿素Tris 缓冲液,每次透析时间为12 h。用PEG 对蛋白溶液进行浓缩,离心后收集上清进行免疫印迹检测。
1.6 VSV-NJ 型间接ELISA 检测方法的建立
1.6.1 间接ELISA 最佳反应条件的确定
1.6.1.1 抗原和血清工作浓度的确定 在96 孔ELISA 反应板上使用棋盘滴定的方法测抗原和血清的最佳工作浓度。
1.6.1.2 酶标蛋白G 最佳工作浓度的测定 将酶标抗体作1∶2 000、1∶1 000、1∶500 稀释,抗原和血清按最佳稀释度稀释,测其OD450nm 值。
1.6.1.3 封闭液和封闭时间的确定 封闭时分别用PBST 稀释的5%脱脂奶粉、1%BSA、1%卵清蛋白封闭2 h,据其OD450nm值显示,含1%BSA 的PBST 封闭效果较好。然后用pH9.6 碳酸盐缓冲液(CBS)稀释的1%BSA放置4 ℃封闭24 h、放置37 ℃封闭24 h(需在湿盒中进行),比较封闭效果。
1.6.2 间接ELISA 方法阴阳性的判断 用抗原最佳包被浓度包被酶标板,检测30 份阴性出口马血清,以测出的OD450nm 平均值(-X)+3 标准差(SD)作为判定阴阳性血清的临界值。
1.6.3 特异性试验 间接ELISA 方法检测东部马脑脊髓炎、马西尼罗病毒的阳性血清、印第安纳型水疱性口炎阳性血清,并用新泽西型水疱性口炎的阳性血清作为对照做特异性试验。
1.6.4 重复性试验 选取4 份不同的水疱性口炎病毒的血清样品,使用同一酶标板,检测板内重复性;使用不同酶标板检测板间重复性。用酶标仪测OD450nm,分别计算两者的变异系数(CV%)。1.7 间接ELISA 测血清效价与中和试验结果分析比较
1.7.1 VSV-NJ 病毒的制备及TCID50的测定 将生长状态良好的marc145(猴胚胎肾上皮细胞)倾去培养基,接种1∶100 稀释的VSV-NJ 型病毒0.5 mL,37 ℃吸附1 h 后补维持液到5 mL,在37 ℃、5% CO2条件下进行培养并持续观察。待大部分细胞出现细胞病变时,反复冻融3 次后收集培养液,用Reed-Muench 法测定该病毒的TCID50。
1.7.2 血清中和效价的测定 将待检的38 份血清于56 ℃水浴中灭活30 min 后,在96 孔细胞培养板板内用稀释液从1∶2 倍比稀释至1∶256,加入50 μL 工作浓度为100 TCID50病毒液,37 ℃中和1 h 后加处理好的细胞50 μL,并做正常细胞对照、阴阳性对照和病毒回归试验。病毒回归试验做4个 滴 度 分 别 为100TCID50、10TCID50、1TCID50、0.1 TCID50,每个滴度重复4 孔。
1.7.3 间接ELISA 测血清效价 按照建立的间接ELISA 方法,将同样的38 份血清以1∶20、1∶40,依次作倍比系列稀释,测定血清的ELISA 效价。
1.7.4 两种方法的分析比较 将38 份血清的中和效价结果与ELISA 效价相比较,探索其相关性。
2 结果
2.1 水疱性口炎糖蛋白的诱导表达及优化 经测试,确定水疱性口炎糖蛋白的最佳诱导达条件为:将菌液按比例加入含氨苄抗性的LB 后放于37 ℃培养,当OD600nm 值达0.6 左右,加入终浓度为0.6 mmol/L 的IPTG 在30 ℃诱导4 h,电泳结果显示,在30 kDa 处出现包涵体蛋白(图1)。

图1 S D S -PA G E 分析
2.2 包涵体的洗涤与溶解 洗涤后的包涵体蛋白在含6 mol/L 的尿素Tris 缓冲液中溶解,少部分溶于8 mol/L 尿素中。
2.3 包涵体的纯化与复性 将包涵体蛋白用His·Bind 试剂盒纯化后,得到较纯的重组蛋白(图2)。免疫印迹表明重组蛋白有良好的反应原性。

图2 重组蛋白纯化结果
2.4 间接ELISA 方法的建立
2.4.1 间接ELISA 最佳反应条件的确定
2.4.1.1 抗原和血清工作浓度的确定 经摸索优化试验条件,确定抗原最佳包被浓度为0.56 μg/mL,在37 ℃1 h 后4 ℃包被过夜、血清最佳工作浓度为1∶40 时效果最好。
2.4.1.2 酶标蛋白G 最佳工作浓度的测定 经间接ELISA 测定,酶标蛋白G 做1∶500 稀释时,阳性对照OD450nm 值与阴性对照OD450nm(P/N)值之比较大。
2.4.1.3 封闭液和封闭时间的选择 按照已优化好的条件进行间接ELISA 检测,重复3 次,通过比较封闭效果,可看出封闭液用pH 9.6 CBS 稀释的1% BSA 37℃封闭24 h(需在湿盒中进行),封闭效果最好。封闭结果见表1。

表1 封闭液和封闭时间的选择
2.5.1 间接ELISA 方法阴阳性的判断结果 经计算得出,30 份阴性出口马血清OD450nm 值的=0.16,SD=0.047。临界值为0.301。血清检测结果见图3。

图3 30份阴性血清O D 450nm值
2.5.2 特异性试验 间接ELISA 检测结果显示,重组蛋白与VSV-NJ 阳性血清发生特异性反应,与其他血清不存在特异性反应(表2)。

表2 特异性试验
2.5.3 重复性试验 对4 份血清样品进行间接ELISA 检测,结果显示OD450nm 值的板内变异系数(CV%)最大为5.64%,板间变异系数(CV%)最大为7.60%,均小于10%。表明建立的间接ELISA 方法具有良好的重复性。
2.6 间接ELISA 测血清效价与中和试验结果分析比较。
2.6.1 VSV-NJ 病毒的TCID50的测定 对制备的VSV-NJ 型病毒进行TCID50测定,该批病毒TCID50为10-5.34/0.05 mL。
2.6.2 两种方法测血清效价及分析比较 中和试验结果显示,病毒回归试验成立,正常对照细胞生长良好。38 份血清中,病毒中和试验检测31 份为阴性,7 份阳性。间接ELISA 检测结果与中和试验相符。其中,7 份阳性血清的中和效价和ELISA 效价结果见表2。
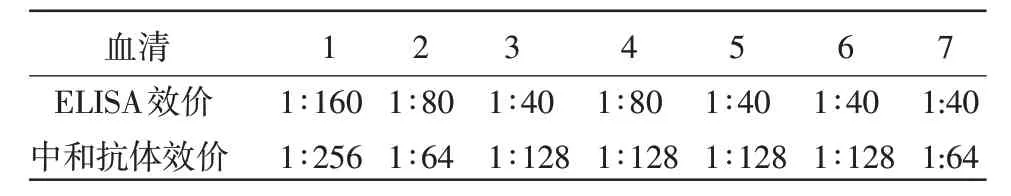
表2 VS V-ELIS A 效价和中和抗体效价的比较
中和试验和间接ELISA 共同检测38 份马血清,通过结果可以看出,这两种方法检测血清样品的阴阳性一致。
3 讨论
VSV 基因结构简单,是重要的模型病毒,被广泛用于囊膜病毒的入侵、装配以及释放等诸多方面的研究[6]。本试验在大肠杆菌中表达的重组蛋白为非分泌型蛋白,它以包涵体的形式聚集在胞浆内。通过对包涵体进行纯化和复性后包被96孔酶标板,建立了一种间接ELISA 方法用于VSVNJ 抗体的检测。试验结果表明,该方法具有良好的特异性和重复性,为水疱性口炎的血清学诊断提供了一种操作简便、快速有效的方法。。
本试验建立的间接ELISA 方法在选用封闭液时,结果显示,用PBST 稀释的1% BSA 封闭2 h 效果较好,阳性血清OD450nm 值为1.02、阴性为0.18左右。通过对封闭液进一步探索发现,用pH9.6碳酸盐缓冲液稀释的1% BSA 放置4 ℃和37 ℃封闭24 h 后,阳性血清OD450nm 值分别上升到1.5、3.0 左右,而其阴性值均无明显变化。原因可能有两点:在间接ELISA 中,抗体跟目的蛋白的结合是非常特异的,结合能力很强,而封闭则是用无关的蛋白质填充酶标板上未结合抗原的部位,从而排斥在ELISA 其后的步骤中干扰物质的再吸附,显著降低非特异反应的发生,让抗体的特异性结合更加充分,使阳性信号变强,这就是封闭时间延长阳性信号变强的一个原因;还有一个原因跟蛋白的性质有关,在本试验中封闭时间过长,使VSV-NJ 糖蛋白的活性升高,因此阳性值升高。通过和其他蛋白进行比较,这种封闭方法并不能使其他蛋白的阳性值发生明显变化,也就是不能使其他蛋白的活性升高,只适用于VSV-NJ 糖蛋白。
间接ELISA 通过和中和试验结果分析比较,两者在检测血清的阴、阳性上没有差别。并且间接ELISA 用时更短,操作上也比较简单,其结果具有高度的可靠性。
[1] 蒋秋燕,刘向松,林洪,等.水泡性口炎病毒的鉴别诊断技术[J].食品与药品,2005.
[2] 温志远,葛金英,胡森,等.表达增强绿色荧光蛋白重组水疱性口炎病毒印第安纳株的构建[J].中国预防兽医学报,2007,12.
[3] Letchworth G J,Rodriguez L L,Barrera J D C.Vesicular stomatitis [J].Vet J,1999,157(3):239-260.
[4] Rodriguez L L.Emergence and re- emergence of vesicular stomatitis in the United States [J].Virus Research,2002,85(2):211-219.
[5] Perez A M,Pauszek S J,Jimenez D,et al.Spatial and phylogenetic analysis of vesicular stomatitis virus[J].Preventive Veter- inary Medicine,2009,10(2):1- 7.
[6] Harrison Stephen C.Viral mem- brane fusion[J].Nature Structural Molecular Biology,2008,15(7):690- 698.
