哈尔滨地区猪源大肠杆菌PM Q R 基因流行性检测
2015-03-11王宏栋徐国锋矫薇薇张秀英
王宏栋,徐国锋,矫薇薇,张秀英
(东北农业大学动物医学学院,黑龙江 哈尔滨150030)
在过去相当长的一段时间里,人们一直认为细菌对氟喹诺酮类耐药机制主要是由染色体耐药决定区[1](quinolone resistance determining regions,QRDRs)突变造成的,并通过自我复制垂直传递给子代,但是这却不能解释临床上耐药性在不同细菌平行传播的现象。随着研究的深入,1998 年Martínez-Martínez[2]等人首次在美国分离到了携带多重耐药质粒pMG252 的肺炎克雷伯氏菌,并报道了质粒介导的喹诺酮类药物耐药性,截止到目前为止,已有3 大类PMQR 基因(qnr、aac(6′)-Ib-cr、qepA)在世界范围内报道[2-5]。
为了解质粒介导氟喹诺酮类耐药基因在哈尔滨地区猪源大肠杆菌中的流行情况,本文通过设计特异性引物对哈尔滨地区分离得到的猪源大肠杆菌进行PMQR 基因的检测与分析,旨在了解质粒介导氟喹诺酮类耐药基因的流行情况,重点研究同一临床分离株是否同时携带不同的PMQR 基因,从而指导临床合理应用氟喹诺酮类药物,为抑制其耐药性的产生与传播奠定基础。
1 材料
菌株:大肠杆菌质控菌株ATCC25922,购自中国兽医药品监察所;大肠杆菌临床分离株分离自哈尔滨市周边规模化养猪场猪肛拭子(放置冰盒)。试剂:麦康凯培养基、伊红美蓝培养基等实验用培养基以及肠杆菌科生化鉴定管等,均购自杭州天和微生物试剂有限公司;2×Tap PCR Mix、DL-2 000DNA Marker,购自TaKaRa 公司。药品:庆大霉素(CN)、阿米卡星(AMK)、恩诺沙星(ENR)、环丙沙星(CIP)、头孢曲松(CRO)、头孢曲松-舒巴坦(CRO-SCF)、多西环素(DOX)、氟苯尼考(FLO),均购自北京天坛药物生物技术开发公司。
2 方法
2.1 分离和纯化 从哈尔滨周边地区采集得到的肛拭子进行增菌培养,根据Domínguez 等[5]介绍方法,将菌液接种到麦康凯琼脂培养基中,挑取符合大肠杆菌形态的粉红色圆形单菌落于伊红美蓝琼脂培养基进行纯化培养,挑取黑色具金属光泽单菌落于LB 琼脂平板上37 ℃过夜培养,挑取单菌落于LB 液体培养基中进行增菌培养。
2.2 鉴定 取少量上述疑似大肠杆菌菌液进行革兰染色,镜检,将符合大肠杆菌形态的菌体采用生化鉴定管(包括葡萄糖、赖氨酸、鸟氨酸等10 项生化试验)进行鉴定,大肠埃希菌ATCC25922做阳性对照。
2.3 药物最小抑菌浓度(MIC) 采用美国临床实验室标准化委员会(CLSI)所推荐的微量肉汤稀释法进行,并根据CLSI 标准进行药物敏感性判断。
2.4 质粒介导的喹诺酮类药物耐药(PMQR)基因的检测
2.4.1 模板质粒的提取 依照离心柱型质粒小量提取试剂盒说明书进行大肠杆菌模板质粒的提取,并将其置于-20 ℃冰箱保存备用。
2.4.2 引物的设计与扩增 根据GenBank 已知序列和参考文献[6]设计9 对特异性引物,由英潍捷基(上海)贸易有限公司合成。PCR 反应体系为菌液质粒为模板(1 μL),2×Tap PCR Mix 为10 μL,ddH2O 为7 μL,上下游引物各1 μL。PMQR基因的反应条件为95 ℃预变形5 min,95 ℃变形30 s,58 ℃退火30 s,72 ℃延伸45 s,共30 个循环,72 ℃延伸7 min,4 ℃保存,PCR 产物用1%琼脂糖凝胶电泳观察结果。将阳性扩增产物,选取部分送英潍捷基(上海)贸易有限公司进行测序,利用NCBI blast 程序在GenBankTM中对目的基因序列进行同源检索分析。aac(6′)-Ib 测序结果利用DNASTAR 与已知野生型aac-(6′)-Ib 的氨基酸序列进行比对,看其氨基酸是否存在102 位(Trp-Arg)和109 位(Asp-Tyr)的突变。
3 试验结果
3.1 分离、纯化与鉴定 78 份样本中共分离纯化出67 株疑似大肠杆菌,在麦康凯培养基上呈粉红色,在伊红美兰培养基上呈深紫色、金属光泽,显微镜下菌体呈两端钝圆革兰染色阴性,经过生化鉴定管确定为大肠杆菌。
3.2 药敏试验结果 8 种被测药物的药敏试验结果和多重耐药情况分别见图1 和图2。
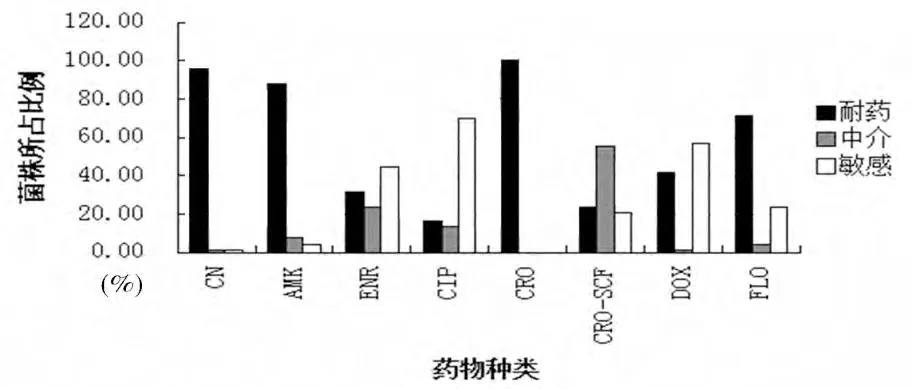
图1 67株猪源大肠杆菌对8种抗菌药的耐药率
3.3 PMQR 基因的PCR 检测 PMQR 基因型分型结果见表1,PCR 电泳图见图3-8,在67 株受试大肠杆菌中,62(92.54%)株至少携带一种的PMQR 基因,oqxAB 检出率最高(47 株、70.15%),其次是qnrS(43株、64.18%)、aac(6′)-Ib-cr(15 株、22.39%)、qnrB(9株、13.43%)、qepA(8株、11.94%),qnrA、qnrC、qnrD在本次研究中并未检出。
4 讨论
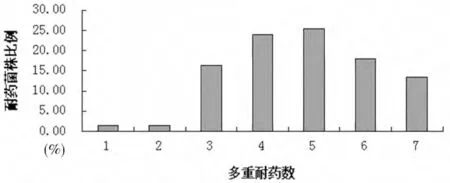
图2 67株猪源大肠杆菌的多重耐药率
4.1 耐药性分析 本研究所调查的67 株大肠杆菌对8 种临床常用抗菌药物均存在一定的耐药性,且多呈现多重耐药,3耐及3耐以上的菌株占到97.01%,这与本课题组前期研究报道[7]的猪源大肠杆菌多重耐药率达100%是相一致的。受试菌株对氟苯尼考的耐药率已经达到了71.64%,对多西环素耐药率为41.8%,结果与其他文献[8]的报道相似;对头孢曲松的耐药率为100%,高于国内其他报道[9];对氟喹诺酮类药物恩诺沙星(31.34%)、环丙沙星(16.42%)的耐药率与分离自我国健康动物的大肠杆菌耐药率[11]相类似,但低于国内患病动物的相关报道[10],分析耐药率与其他研究报道差异的原因可能是不同的地区,猪场临床用药习惯的差异造成的。

图3 acc(6′)Ib基因PC R 结果
图4 oqxB 基因PC R 结果

图5 oqxA 基因PC R 结果

图6 qepA 基因PC R 结果

图7 qnrS 基因PC R 结果

图8 qnrB 基因PC R 结果
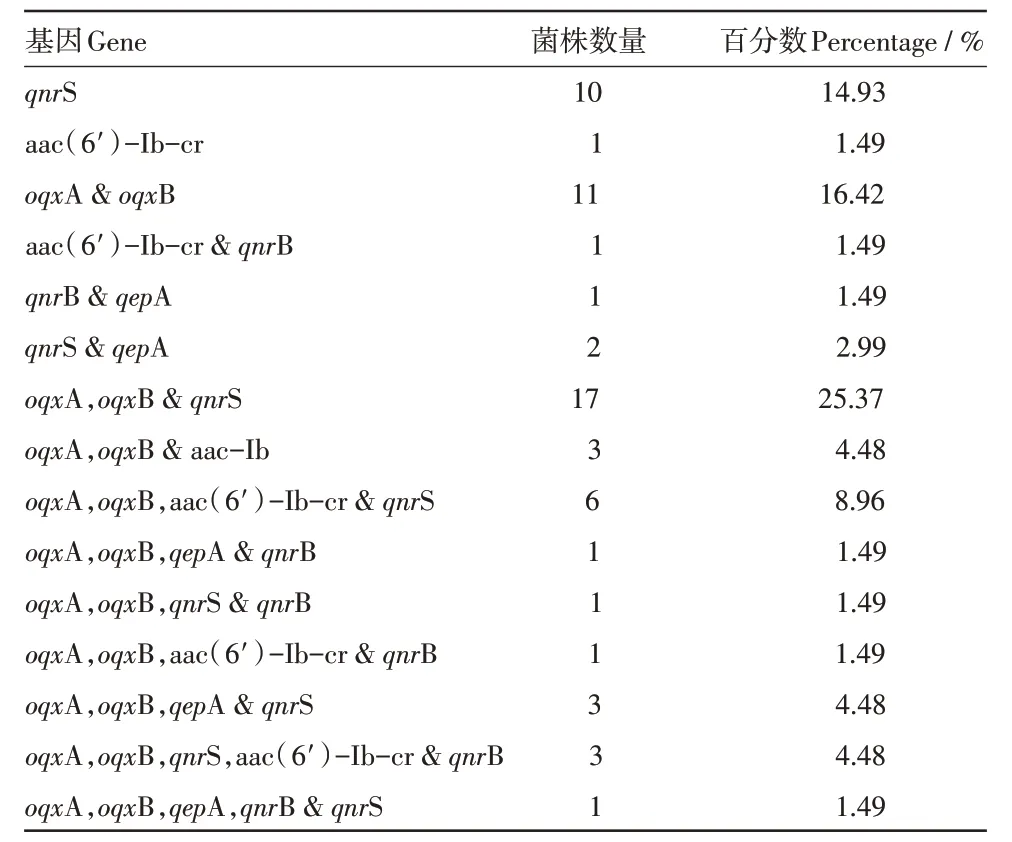
表1 PM Q R 阳性菌株基因型分型
4.2 PMQR 基因调查情况 自1998 年世界上首次报道从阿拉巴马州分离的肺炎克雷伯菌含有qnrA基因以来,世界范围内的PMQR 基因的流行病学就逐渐发展起来。本研究调查了从哈尔滨周边地区规模化养猪场分离得到的67 株猪源大肠杆菌中PMQR 基因的流行情况,发现92.54%至少含有一种PMQR 基因,各个PMQR 基因的检出率也明显高于国内其他文献报道[12],这也揭示了随着氟喹诺酮类药物的使用,PMQR 基因的流行率有升高的趋势,其中oqxA 和oqxB 检出率最高(70.15%),qnr 各亚型中,qnrS 最常见,这一结果与国内其他文献报道是一致的[13],然而之所以对氟喹诺酮类药物恩诺沙星(31.34%)、环丙沙星(16.42%)的耐药率低于国内患病动物的相关报道[10],分析原因可能是所调查的猪场近年来未使用这两种抗菌药物,PMQR 基因处于低水平表达,未达到具有临床意义的氟喹诺酮类药物耐药。
5 结论
本研究对哈尔滨地区猪源大肠埃希菌的耐药性进行了测定,结果显示耐药性严重,且多呈现多重耐药;通过PCR 方法,可以发现PMQR 基因的检出率已达到很高的程度。哈尔滨地区猪源大肠埃希菌对临床常用药物的耐药性不断增强,已成为严重的公共卫生问题。虽然qnr、qepA、aac(6′)-Ib-cr 仅介导低水平的氟喹诺酮类药物耐药性,但是较高检出率以及共同存在,也将有助于选择出高水平的氟喹诺酮类药物耐药性,因此非常有必要进行大肠杆菌耐药性分析以及质粒介导氟喹诺酮类药物耐药基因的检测,检测耐药情况和PMQR 基因的流行情况,将有助于指导临床合理用药,延缓或抑制耐药性的发生,也为耐药质粒的消除提供广阔的思路。
[1] Yoshida H,Bogaki M,Nakamure M.Quinolone resistance-determining region in the DNA gyrase gyrA gene of Escherichia coli[J].Antimicrob Agents Chemother,1990,34(6):1271-1272.
[2] Martínez-Martínez L,Jacoby G A.Quinolone resistance from a transferable plasmid [J].Lancet,1998,351(9105):797-799.
[3] Yamane K,Achino J W,Suzuki S,et al.Newplasmid-mediated fluoroquinolone efflux pump,QepA,found in an Escherichia coli clinical isolate[J].Antimicrobial agents and chemotherapy,2007,51(9):3354-3360.
[4] Robicsek A,Strahilevitz J,JacobyGA,et al.Fluoroquinolone modifying enzyme:a new adaptation of a common aminoglycoside acetyltransferase[J].Nat Med,2006,12:83-88.
[5] Domínguez E,Zarazaga M,Sáenz Y,et al.Mechanisms of antibiotic resistance in Escherichia coliisolates obtained from healthy children in Spain[J].Microbial Drug Resistance,2002(8):321-327.
[6] Wang M,Guo Q,Xu X,et al.New plasmidmediated quinolone resistance gene,qnrC,found in a clinical isolate of Proteus mirabilis.Antimicrob Agents Chemother,(2009)53:1892-1897.
[7] 张秀英,王磊杰,徐国锋,等.哈尔滨地区猪源多重耐药大肠杆菌接合性质粒和整合子检测[J].东北农业大学学报,2013,44(9):40-45.
[8] Jiang H X,Lu D H,Chen Z L,et al.High prevalence and widespread distribution of multi-resistant Escherichia coli isolates in pigs and poultry in China[J].Vet J,2011,187(1):99-103.
[9] 王冠玉,谭艾娟,吕世明,等.贵州猪鸡源大肠杆菌质粒介导喹诺酮类耐药基因调查.中国兽医杂志,2014,50(4):76-79.
[10] 朱恒乾,廖晓萍,陈朝惠,等.宠物源大肠杆菌质粒介导喹诺酮类耐药基因流行性检测[J].中国农业科学,2010,43(16):3447-3454.
[11] 张悦,王杨,张美君,等.动物源肠杆菌分离株质粒介导的喹诺酮类耐药基因的检测.中国兽医杂志,2012,48(8):15-17.
[12] 岳磊,蒋红霞,刘健华,等.鸡源肠杆菌质粒介导喹诺酮类耐药基因检测.中国农业科学,2009,8:2966-2971.
[13] Zhao J,Chen Z,Chen s,et al.Prevalence and dissemination of oqxAB in Escherichia coli isolates from animals,farmworkers,and the environment[J].Antimicrob Agents Chemother,2010b,54(10):4219-4244.
