鸡传染性贫血病毒vp3 基因在真核细胞中的表达与功能分析
2015-03-11黄超华张全红王永强李晓齐郑世军
黄超华,张全红,陈 坤,王永强,曹 红,李晓齐,郑世军
(1.中国农业大学动物医学院,北京 海淀100193 ;2.蛇口出入境检验检疫局,广东 深圳518054;3.国家知识产权局专利局专利审查协作北京中心,北京 海淀100190)
鸡传染性贫血病毒(CIAV)作为鸡传染性贫血(CIA)的病原,主要引起感染鸡再生障碍性贫血和雏鸡的免疫抑制,继而引发其他病原发生继发感染。该病毒在世界范围内广泛分布,对养鸡业是一种潜在的巨大威胁。
鸡传染性贫血病毒(CIAV)属于圆环病毒科。Noteborn 等人于1991 年对CIAV 的全基因组进行了分析,发现其长度为2.3 kb,含3 个开放阅读框架(ORF),分别编码VP1、VP2、VP3 等3 种病毒蛋白[1]。VP3 作为CIAV 的非结构蛋白,是CIAV最主要的致病因子,能够诱导感染雏鸡骨髓造血细胞及胸腺的前T 细胞凋亡[2],从而导致雏鸡出现严重的出血、贫血及免疫抑制。同时,研究证实,VP3 能选择性地诱导人转化细胞和肿瘤细胞凋亡,而对正常二倍体细胞无毒害作用[3]。因为这种特性,VP3 成为抗肿瘤药物的研究热点,被命名为“Apoptin”。研究表明,VP3 诱导的肿瘤细胞凋亡不需要肿瘤抑制因子p53 的介导[4],但依赖于caspase 的参与,尤其是caspase-3 的活化[5]。除此之外,人们通过各种技术手段找到了一些可能参与Apoptin 凋亡过程的蛋白,如孙敬国[6]等发现,ABP280、NMI、UPH 和MYB 等 结 合 蛋 白 可 以 与Apoptin 结合;Cheng[7]等也筛选到了几种与Apoptin相互作用的蛋白,其中包括APAPI 和Hippi 等。这些蛋白都可能参与了Apoptin 诱导的细胞凋亡过程。但是,Apoptin 诱导细胞凋亡的具体途径仍不清楚,需要进一步的研究。本研究成功克隆到CIAV vp3 基因并成功构建出真核表达载体pEGFP-VP3。后者可以在293 T 和BHK-21 细胞中瞬时表达VP3 蛋白,并能诱导细胞死亡,为深入研究CIAV 的致病机理奠定了基础。
1 材料与方法
1.1 CIAV 病毒毒株与细胞 CIAV 病毒Cux-1 标准株由北京市农林科学院杨兵副研究员提供,293 T 和BHK-21 细胞由本实验室保存。
1.2 主要试剂 Taq plus DNA 聚合酶、质粒小量提取试剂盒、DNA 回收试剂盒,购自北京鼎国昌盛生物技术有限责任公司;感受态细胞E.coli DH5α、DNA Marker,购自北京天为时代生物公司;限制性内切酶、pMD18-T simple 连接试剂盒,购自宝生物工程(大连)有限公司;X-gal、IPTG 为Sigma 公司产品;质粒大量提取试剂盒、真核细胞转染试剂盒和化学发光检测试剂盒,购自北京威格拉斯公司;真核表达载体pEGFP-N1 由本实验室保存。
此外,就该诗来说,华兹华斯并未满足于母国曾对苏格兰的殖民压迫,他甚至认为未来还有同样的事情发生。这不仅表明诗人对日不落帝国可以永远保持主体地位的渴望,同时也暗含其对苏格兰永恒他者地位的期许。无独有偶,诗人的帝国憧憬在《紫杉树》中也有较好的展示:
1.6 重组真核表达载体pEGFP-vp3 的构建 将筛选出的上述阳性重组质粒和真核表达载体pEGFP-N1 分别用Xho I 和BamH I 进行双酶切,电泳回收和纯化DNA 片段后进行连接和转化,筛选阳性菌落,并进行酶切和PCR 鉴定。
以pCMV-Myc-vp3 转染293 细胞24 h 收获细胞蛋白,进行Western Blot 检测。HSC70 蛋白作为细胞的内参对照蛋白。
此 外,以pCMV-Myc-vp3 转 染293 T 细 胞 后24 h,VP3-Myc 融合蛋白明显表达(图4),进一步证实VP3 在细胞中成功表达。
1.3 引物设计 参考GenBank 中CIAV 病毒Cux-1标准株的基因组序列,应用Primer5.0软件设计引物,分别在上下游引物中加入Xho I 和BamH I 两个酶切位点,预期扩增长度为377 bp。引物由上海生工生物工程技术服务有限公司合成。上游引物:5′-CTC GAG ATC TCA AAT GAA CGC TC-3′;下游引物:5′-GGA TCC CGC AGT CTT ATA CGC C-3′。
连接锅炉至文丘里冷却器[3](可利用原惰气系统辅助冷却器,需核算换热量是否满足)工艺管路。改在完成后,锅炉产生尾气,进入冷却器冷却,通过增压风机增压后进入大舱做为覆盖气。增加两路电动控制阀用于在热介质锅炉尾气流程下游发生故障时进行阀门切换,以保证锅炉尾气可以顺利排放至大气,稳定锅炉运行。具体工艺如图1。
1.7 重组真核表达质粒pEGFP-vp3 在真核细胞中的瞬时表达 将鉴定为阳性的质粒,进行扩大培养,并根据质粒提取试剂盒的说明,大量提取重组真核表达质粒pEGFP-vp3。随后,按照真核细胞转染试剂盒提供的步骤将重组真核表达质粒pEGFP-vp3 转染BHK-21 和293T 细胞中。转染24 h 后,在荧光显微镜下观察绿色荧光;同时提取细胞总RNA,进行RT-PCR。从而确定重组真核表达质粒pEGFP-vp3 的瞬时表达情况。在pCMV-Myc-vp3 转染细胞24 h 后,收取细胞通过常规Western Blot,检测VP3 蛋白表达情况,HSC 70作为内参考对照细胞蛋白。
2.2 pEGFP-vp3 瞬时表达的RT-PCR 结果 转染后24 h,提取转染细胞的总RNA,并进行RTPCR。从结果可以看到均能从转染pEGFP-vp3 的293T 细胞和BHK-21 细胞的RNA 中扩增出特异的DNA 条带,大小为377 bp 左右,与预期的VP3基因一致(见图2)。其中198 bp β-actin 为参照。这说明转染了pEGFP-vp3 的293T 细胞和BHK-21细胞均能转录出vp3 的mRNA。
2 结果
2.1 CIAV vp3 基因的扩增和克隆与真核表达载体的构建 以提取的CIAV DNA 为模板,利用CIAV vp3 特异引物进行PCR 扩增,其产物经1%琼脂糖凝胶电泳显示大小约为377 bp,与预期大小一致(见图1 A)。将vp3 PCR 产物插入克隆载体pMD18-T simple vector,并对重组克隆质粒pMD-vp3 进行PCR 和酶切鉴定和测序,发现与GenBank 发表的鸡传染性贫血病毒Cux-1 标准株的vp3 基因同源性在99.8%以上,说明克隆片段为vp3 基因序列。将提取的重组真核表达质粒pEGFP-vp3 进行PCR 和酶切鉴定:扩增出4 700 bp 和377 bp 的两条带(见图1B)。结果表明,目的片段vp3 基因已成功地插入到真核表达载体pEGFPN1 上。同样,pCMV-Myc-vp3 也构建成功。

图1 vp3基因的克隆和真核表达载体pEG FP-vp3的构建
1.8 台盼蓝染色实试验 采用台盼蓝染色法检测细胞活力。设计3 组实验,分别为空白对照组(control 组)、空载体对照组(pEGFP-N1 组)和pEGFP-vp3 组。分别于转染后24 h、48 h、72 h、96 h、120 h 收集293T 细胞,并制备成密度为105个/mL 的细胞悬液,1∶1 加入0.4%台盼蓝染色液,作用3 min,立即在普通光学显微镜下用血细胞计数板进行细胞计数。细胞核蓝染的,为死亡细胞,结果以细胞死亡率(细胞死亡率=死亡细胞数/死亡细胞+活细胞数)表示。结果组间差异用t-检验进行统计学分析,P<0.05 为差异显著。

图2 pEG FP-vp3瞬时表达的R T-PC R 结果
2.3 pEGFP-vp3 瞬时表达的荧光观察以及Western Blot 检测 转染24 h,在倒置荧光显微镜下观察绿色荧光。结果显示,转染pEGFP-vp3 的293T细胞和BHK-21 细胞均能产生清晰的荧光。将转染了pEGFP-vp3 的细胞与转染了pEGFP-N1 空载体的细胞进行比较,可以发现转染pEGFP-vp3 的细胞的荧光聚集成颗粒状且固定在一定区域,而后者的荧光则弥散在整个细胞的细胞质和细胞核中(见图3)。这可能与VP3 蛋白的特性相关,在细胞中表达的VP3 蛋白常常以细小的颗粒存在,有时还形成相对较大的球状颗粒。这说明真核表达载体pEGFP-vp3 可以表达融合绿色荧光蛋白的VP3 蛋白。
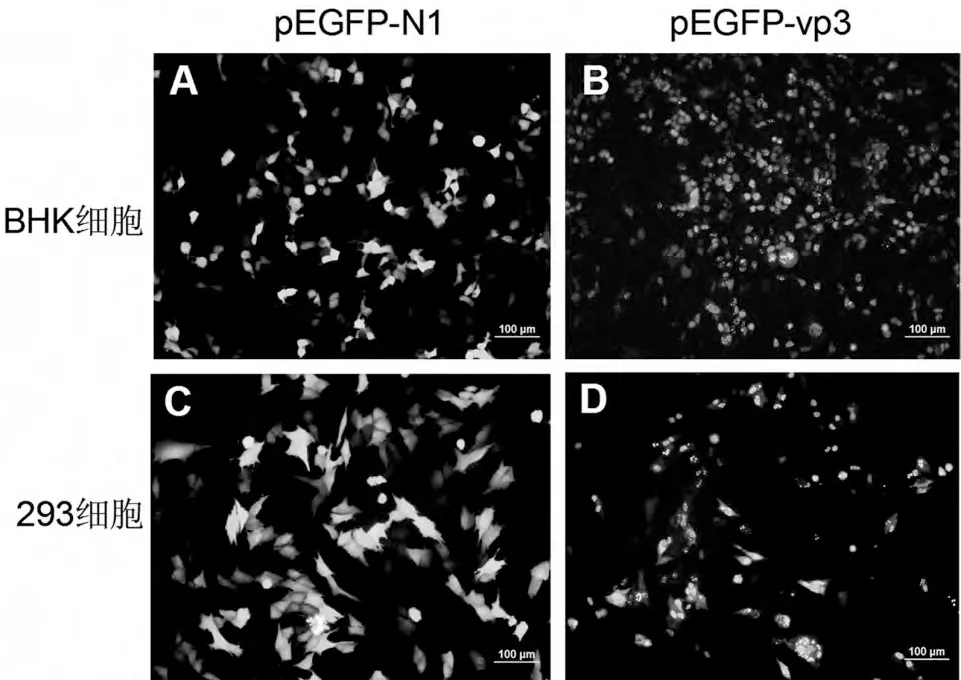
图3 pEG FP-vp3瞬时表达的荧光观察结果 (200×)
1.5 扩增产物的克隆和测序 按照连接试剂盒说明书,将回收PCR 产物与pMD18-T simple vector 进行连接,1 h 后转化感受态E.coli.DH5α,涂布于含氨苄青霉素(100 IU/mL)和X-gal IPTG 的LB培养板,于37 ℃培养过夜,挑取白色菌落后过夜培养,提取质粒,将酶切和PCR 鉴定为阳性的重组质粒进行序列测定。
2.3 不同分期的宫颈癌组织中Ki-67、p16及p53表达情况的比较 16例宫颈癌患者中,Ⅰ期10例,Ⅱ期6例。宫颈癌Ⅰ期与Ⅱ期患者Ki-67、p16及p53表达阳性率的比较,存在明显差异(P<0.05)。见表3。

图4 W esternBlot检测VP3-myc融合蛋白表达
1.4 CIAV vp3 基因的PCR 扩增 以提取的CIAV基因组DNA 为模板,利用上述引物扩增CIAV vp3基因。反应总体积为50 μL,其中上下游引物各0.5 μmol/L,dNTP 为0.2 mmol/L,模板100 ng,Taq plus 酶1 U,10×反应缓冲液5 μL,加灭菌三蒸水补足至50 μL。反应程序:95 ℃4 min,94 ℃45 s,57 ℃50 s,72 ℃1 min,循环30 次,72 ℃延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测后用DNA 回收试剂盒回收和纯化。
2.4 VP3 蛋白对细胞活性的影响 为了确定VP3蛋白是否仍具有凋亡功能,将pEGFP-vp3 转染至293T 细胞中,观察其对293T 细胞活性的影响。结果显示,与空白对照组和空载体转染对照组(pEGFP-N1 组)比较,转染后64 h、96 h、120 h 的细胞凋亡率分别为9.47%、13.17%和14.23%(见图5)。与对照组相比,pEGFP-vp3 转染组的细胞凋亡现象明显(P<0.05)。
南京体育学院民间体育课程的教学目标不是很明确,对于培养出什么样的专业人才还是很模糊,在课程大纲的设定中没有自己的特色,课时的分配还算合理,但不能满足学生的需求。

图5 VP3诱导细胞死亡作用
3 讨论
CIAV VP3 蛋白,即“凋亡素”(Apoptin),被认为是真正意义上可以选择性诱导肿瘤细胞凋亡、而不损伤正常细胞的蛋白之一,有可能发展成为一种很有前途的肿瘤基因治疗药物。这种独特的选择性凋亡效应,与VP3 蛋白在细胞中的定位存在一定联系。VP3 蛋白表达后迅速进入肿瘤或转化细胞的细胞核内,而一直只存在于正常细胞的细胞质内[8]。这种选择性的细胞定位与VP3 蛋白C 端的两个核定位信号(NLS1 和NLS2)密切相关,同时也与VP3 蛋白第108 位的苏氨酸残基(T108)的磷酸化相关[9]。即在肿瘤细胞中,VP3 蛋白的T108 处于磷酸化状态;而在正常细胞中,VP3 蛋白的T108 氨基酸处于去磷酸化状态。去掉VP3 蛋白中的核运输信号或者突变T108 氨基酸都会影响VP3 的凋亡作用,甚至使其丧失凋亡作用。本研究成功克隆到CIAV vp3 基因,并与GenBank 中 提 供Cux-1 株 的vp3 序 列 比 对,发 现VP3 在碱基水平只发生了一个碱基的突变,并没有造成其氨基酸水平的突变,也就是说VP3 蛋白中对其凋亡作用起关键作用的区域和位点都未发生突变,说明VP3 蛋白仍可能具有其原有的凋亡功能。台盼蓝染色试验进一步证实VP3 蛋白仍具有一定的凋亡功能。
2) 跨站防误闭锁:实现变电站与变电站之间的闭锁功能,杜绝多变电站同时操作时,线路带电情况下合出线侧接地刀闸的安全隐患。
VP3 蛋白诱导肿瘤细胞凋亡的过程不需要p35 的介导,同时也不会因Bcl-2 的过量表达而受到抑制,因此可以诱导p35 缺失的肿瘤细胞凋亡,其应用前景广泛。目前,研究者发现VP3 选择性地诱导肿瘤细胞凋亡涉及到众多蛋白,但其具体通路仍不清楚。本研究成功构建表达鸡传染性贫血病毒vp3 基因的真核表达载体pEGFP-vp3,将该载体转染至真核细胞中可以表达与绿色荧光蛋白(GFP)融合表达的VP3 蛋白,因此可以进一步研究VP3 的细胞定位与VP3 的凋亡效应之间的关系,并且也有利于研究VP3 与细胞凋亡相关蛋白之间的关系。为进一步研究VP3 的功能奠定了良好的基础。
[1] Noteborn M H M,De Bore G F,van Roozelaar D J,et al.Characterization of cloned chicken anemia virus DNA that contains all elements for the infectious replication cycle[J].J virol,1991,65:3131-3139.
[2] Jeurissen S H M,Wagenaar F,Pol J M A,et al.Chicken anemia virus causes apoptosis of thymocytes after in vivo infection and of cell lines after in vitro infection[J].J Virol,1992,66:7383-7388.
[3] Danen Van Ooschot A A,Fischer D F,Grimbergen J M,et al.Apoptin induces apoptosis in human transformed and malignant cells but not nomal cells[J].Proc Natl Acad Sci USA,1997,94(11):5843-5847.
[4] Zhuang S M,Shvarts A,Van Ormonct H,et al.Apoptin, a protein derived from chicken anemia virus induces a p53-Independent apoptosis in human osteeSarconta cells[J].Cancer Res,1995,55(3):486-489.
[5] Danen Van Oorschot A A,van Der E B,Noteborn H M,et al.The chicken anemia virus-derived protein apoptin requires activation of caspases for induction of apoptosis in human tumor cells[J].J Virol,2000,74(15):7072-7078.
[6] 孙国敬,童新,孟祥兵,等.从人白细胞cDNA 文库中筛选凋亡素相互作用蛋白[J].生物化学与生物物理学报,2002,34(5):695-698.
[7] Cheng C M,Huang S P,Chang Y F,et al.The viral death protein Apoptin interacts with Hippi,the protein interactor of Huntingtininteracting protein[J].Biochem Biophys Res Commun,2003,305(2):359-364.
[8] Danen-Van Oorschot A A,Zhang Y H,Lelived S R,et al.Importance of nuclear localization of apoptin for tumor-specific induction of apoptosis[J].J Biol Chem,2003,278(30):27729-27736.
[9] Rohn J,Zhang Y H,Aalbers R I,et al.A tumor specific kinase activity regulates the viral death protein apoptin [J].Biol Chem,2002,277(52):50820-50827.
