膜分离法纯化浓缩的猪细小病毒灭活疫苗效果研究
2015-03-11武桂梅王振辉何玉友李鹏郑洪娟
武桂梅,王振辉*,何玉友,李鹏,郑洪娟
(1.吉林农业科技学院,吉林132101; 2.吉林正业生物制品股份有限公司,吉林132101)
膜分离法纯化浓缩的猪细小病毒灭活疫苗效果研究
武桂梅1,王振辉1*,何玉友2,李鹏1,郑洪娟2
(1.吉林农业科技学院,吉林132101; 2.吉林正业生物制品股份有限公司,吉林132101)
为了研究纯化浓缩的猪细小病毒灭活疫苗的免疫效果,应用微滤/超滤管式陶瓷膜分离系统对猪细小病毒细胞收获液进行纯化浓缩,使浓缩液病毒平均含量由104.7TCID50/mL提高到106.5TCID50/mL;将纯化浓缩的病毒液经检验合格后,进行甲醛灭活,与注射用矿物白油佐剂制成油包水灭活疫苗;按照猪细小病毒灭活疫苗的质量标准,对制备的灭活疫苗进行检验与免疫效果试验。结果显示:纯化浓缩的猪细小病毒液杂蛋白去除率平均达到71.6%左右;制备的三组灭活疫苗检验均合格;免疫至63 d时,免疫猪体内抗猪细小病毒抗体(HI)水平分别为:纯化浓缩的灭活疫苗平均高达9.62 log2稀释倍数,常规疫苗平均为8.78 log2稀释倍数,差异显著(P<0.05)。试验表明:疫苗病毒细胞收获液进行膜纯化技术处理后,免疫效果显著优于未经纯化的常规灭活疫苗。
猪细小病毒;纯化浓缩;灭活疫苗;免疫效果
猪细小病毒(Porcine parvovirus, PPV)是引起母猪繁殖障碍的重要病原之一,可导致母猪流产、早产、产死胎、木乃伊胎、弱仔及母猪不育和新生仔猪大量死亡,疫苗接种是控制PPV感染的最有效措施[1]。张超范等研究猪细小病毒灭活疫苗发现病毒含量与疫苗的免疫效果密切相关,且最大程度降低犊牛血清含量来减少灭活疫苗的副反应[2-3]。目前,国内兽医生物制品行业制备动物疫苗的病毒细胞收获液基本是未经纯化的,含有大量与免疫无关的非特异蛋白质等杂质,这些杂质无疑会导致一些畜禽个体免疫麻痹或失败[4]。国内关于猪细小病毒灭活疫苗免疫效果的研究较多,但有关对猪细小病毒进行纯化浓缩的研究很少。为了探索纯化浓缩的病毒灭活疫苗免疫效果,应用膜分离技术[5]对某生物制品厂提供的病毒含量低的猪细小病毒细胞收获液进行杂蛋白滤除,并制成油乳剂灭活疫苗进行了免疫效果试验。
1 材料和方法
1.1 微滤/超滤管式陶瓷膜分离系统 型号:SY-MU-2-500,管式陶瓷膜元件孔径1.0 μm、0.80 μm、0.60 μm、0.22 μm,管式有机膜元件(改良纤维素)5K, 由吉林农业科技学院生物制药实验室提供。
1.2 猪细小病毒细胞收获液 吉林正业生物制品股份有限公司提供120000 mL(病毒含量为104.7TCID50/mL),国内三家兽医生物制品厂生产的未纯化的常规猪细小病毒灭活疫苗(各500头份,编号:对照01、对照02与对照03)。
1.3 细胞与试剂 仔猪肾传代细胞(IBRS-2),猪细小病毒标准阳性血清(批号20110901)、猪细小病毒标准阴性血清(批号20110707)均由吉林正业生物制品股份有限公司提供。
1.4 试验动物 4日龄同窝乳鼠、350~400 g的豚鼠均由吉林正业生物制品股份有限公司提供;2月龄仔猪(猪瘟中和抗体阴性、猪细小病毒HI抗体效价≤3 Log2)由吉林农业科技学院实习猪场提供。
1.5 不同膜组合对猪细小病毒收获液的纯化与浓缩 分三组进行:1组(1.0 μm、5K、0.22 μm)陶瓷膜过滤;2组(0.80 μm、5 K、0.22 μm)陶瓷膜过滤;3组(0.60 μm、5K、0.22 μm)陶瓷膜过滤。先分别用1.0 μm、0.80 μm、0.60 μm陶瓷膜过滤杂蛋白,再用5K陶瓷膜浓缩病毒,最后用0.22 μm除菌处理。每组膜纯化浓缩处理40 000 mL未处理的猪细小病毒灭活液,
1.6 病毒含量测定、杂蛋白去除率、病毒灭活与无菌检验
1.6.1 病毒含量测定 用DMEM培养液将纯化浓缩前后的猪细小病毒细胞收获液作10倍系列稀释,取10-3、10-4、10-5、10-6、10-75个稀释度,分别接种于已生长良好的单层IBRS-2细胞的96孔细胞微量培养板,每个滴度接种5孔,每孔100 μL,置37 ℃含5%CO2培养箱中培养24~120 h,每日观察并记录细胞病变,按Reed-Muench法计算病毒的半数感染量(TCID50/mL)。
1.6.2 杂蛋白去除率、病毒灭活与无菌检验 三组纯化浓缩前后的猪细小病毒液分别用紫外分光光度计检测总蛋白含量,计算杂蛋白去除率[6];病毒灭活检验,将纯化浓缩灭活的病毒原液分别接种于已生长良好的单层IBRS-2细胞的96孔细胞微量培养板,每个样品接种10孔,每孔100 μL,置37 ℃含5%CO2培养箱中培养24~120 h,每日观察并记录细胞病变;纯化后灭活病毒液分别用硫乙醇酸盐培养基(TG)、酪胨琼脂培养基(GA)、葡萄糖蛋白胨水培养基(GP)按《中华人民共和国兽药典》[7]的方法进行无菌检验。
1.7 纯化浓缩的猪细小病毒灭活疫苗制备 三组纯化浓缩的灭活病毒液各取1500 mL制备5000 mL灭活疫苗。其中油相制备、水相制备、乳化、黏度检验、分装按文献方法[5]进行制备。
1.8 纯化浓缩的猪细小病毒灭活疫苗检验 按《中华人民共和国兽药典》[7]进行黏度、无菌检验、安全检验、效力检验。
1.9 纯化浓缩的猪细小病毒灭活疫苗免疫试验
1.9.1 仔猪分组与免疫 根据试验内容,选用2月龄断奶仔猪60头(母原抗体平均≤4 Log2),随机平均分为6组。第1、2、3组每头仔猪对应接种三组纯化浓缩的猪细小病毒灭活疫苗2 mL;第4、5、6组为未纯化的灭活疫苗免疫对照组,每头仔猪接种常规猪细小病毒灭活疫苗2 mL。
1.9.2 抗体中和效价测定 分别于免疫后第0、7、14、21、28、35、42、49、63 d对6组试验猪耳静脉无菌采血,分离血清灭活后,分别用猪细小病毒标准阳性血清、猪细小病毒标准阴性血清、标准的猪细小病毒病毒抗原,用1%健康豚鼠的红细胞悬液进行HI血凝抑制试验[8-9],测定抗体HI效价。
2 结果与分析
2.1 病毒含量、杂蛋白去除率、病毒灭活与无菌检验 结果见表1。由于三组微孔陶瓷膜的孔径分别是1.0 μm、0.8 μm、0.6 μm,所以三组纯化浓缩病毒含量显著提高,平均病毒含量达到106.5TCID50/mL;病毒收获量由高到低,蛋白质去除率由低到高,三组平均杂蛋白去除率为71.6%。三组纯化浓缩的病毒液浓缩倍数均高达10以上,灭活与无菌检验均合格。
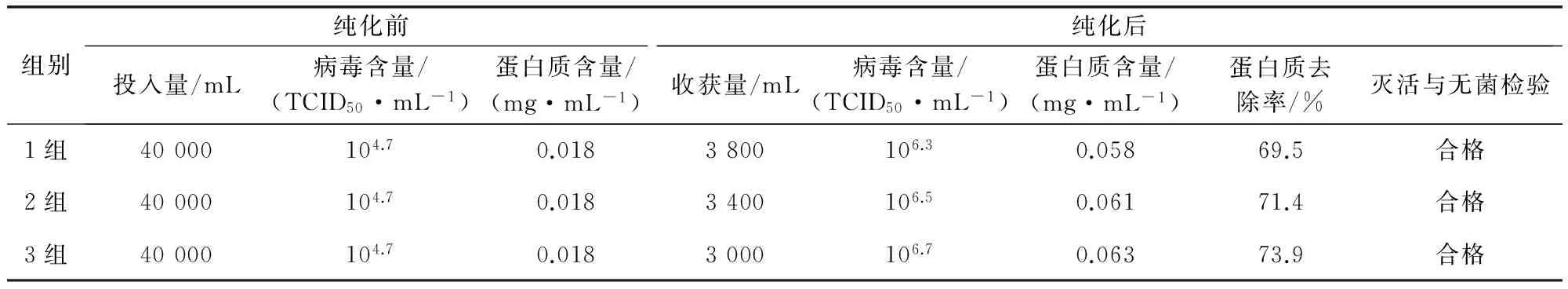
表1 病毒含量、杂蛋白去除率、灭活与无菌检验结果
蛋白去除率=(纯化前蛋白质含量×纯化前投入量-纯化后蛋白质含量×纯化后收获量)÷(纯化前蛋白质含量×纯化前投入量)×100%
2.2 纯化浓缩的灭活疫苗检验 结果见表2。三组灭活疫苗由于纯化浓缩平均去除杂蛋白达到71.6%,大大减少杂蛋白对安全检验、效力检验的影响,达到检验一次通过率,全部合格。
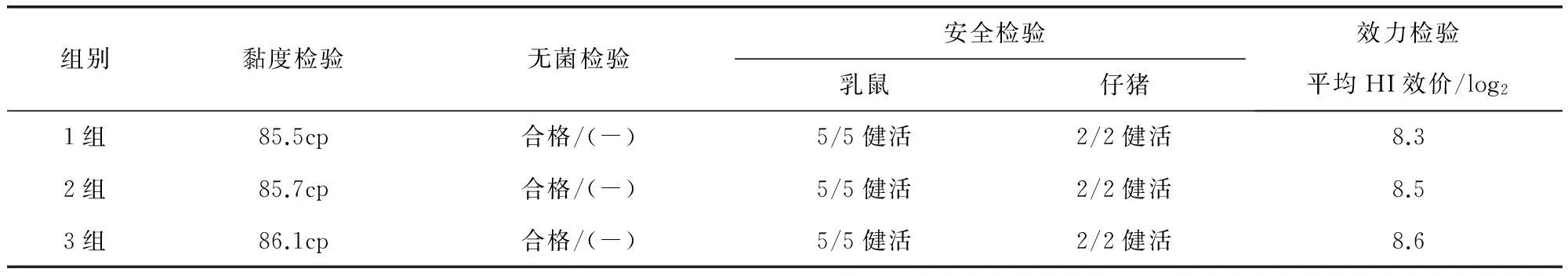
表2 纯化浓缩的猪细小病毒灭活疫苗检验结果
2.3 纯化浓缩的灭活疫苗与未纯化的灭活疫苗免疫猪血清HI检测 结果见表3。免疫28 d时,纯化浓缩的灭活疫苗和未纯化的对照灭活疫苗血清抗体平均升至最高,纯化的三组灭活疫苗血清抗体消长差异不显著(P>0.05),抗体效价平均为10.80 log2稀释倍数;未纯化的对照三组灭活疫苗血清抗体消长差异不显著(P>0.05),平均为9.90 log2稀释倍数;纯化的灭活疫苗比未纯化的对照灭活疫苗血清抗体消长差异显著(P<0.05)。免疫63 d时,纯化的三组灭活疫苗血清抗体平均消长差异不显著(P>0.05),平均为9.62 log2稀释倍数;而未纯化的对照灭活疫苗血清抗体消长差异不显著(P>0.05),平均为8.78 log2稀释倍数;纯化的灭活疫苗比对照灭活疫苗血清抗体消长差异极显著(P<0.05)。
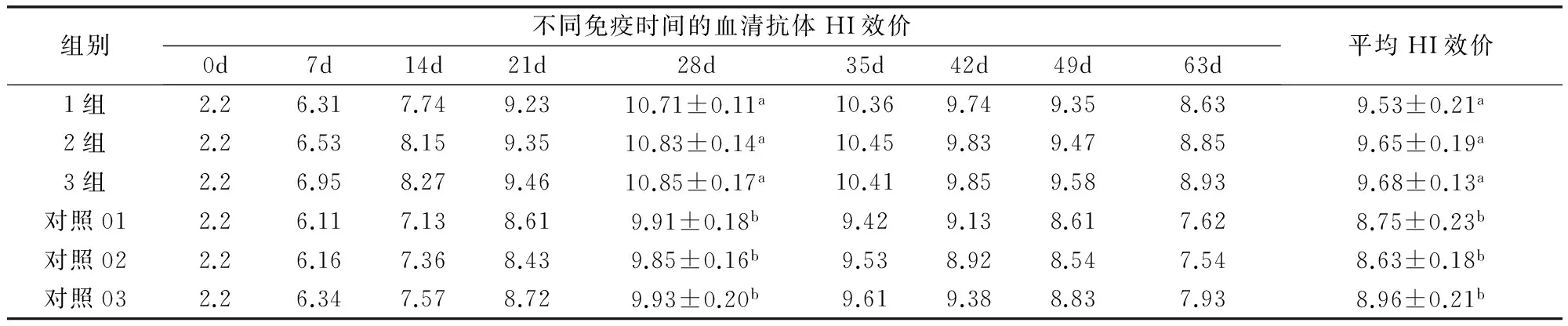
表3 不同免疫时间纯化组与未纯化组灭活疫苗猪血清HI抗体监测结果 log2
同列肩标不同小写字母表示差异显著(P<0.05)
3 讨论
通过使用1.0 μm、0.80 μm、0.60 μm三种微孔陶瓷膜过滤,首先滤除病毒液中细胞碎片、犊牛血清中与免疫无关的杂蛋白,然后使用5K的改良纤维素超滤膜滤除病毒液中多余的水分子,使病毒液得到纯化浓缩,显著提高了病毒含量,最后使用0.22 μm微孔滤膜进行除菌处理,避免了杂蛋白、细菌及其毒素对疫苗病毒抗原的免疫效果影响。
通过微滤、超滤、除菌处理使含毒病毒液浓缩倍数达到10倍之多,病毒平均含量由最初的104.7TCID50/mL提高到106.5TCID50/mL,杂蛋白去除率平均达到71.6%左右。由于三组微孔膜差异小,故纯化浓缩后三组之间检测数据差异不显著。三组纯化浓缩的病毒液制备的灭活疫苗的各项检验均一次检验合格,较某生物制品厂同类产品复检合格比较,说明杂质含量与疫苗质量关系密切。纯化浓缩的灭活疫苗与对照常规灭活疫苗免疫猪血清抗体效价数据分析,不同免疫日龄检测抗体水平数据表明:纯化的疫苗抗体数值显著高于未纯化的常规疫苗。
目前,为了提高疫苗的抗原蛋白含量,多数兽医生物制品厂家应用颇尔过滤器(PALL)对病毒细胞收获液或组织收获液进行超滤浓缩除去多余的水分子等低分子物质,但该设备只能浓缩,不能截留除去细胞膜碎片等大分子杂蛋白,提高了病毒含量的同时也提高了杂质的含量,增加了对疫苗免疫的影响因素。目前,国内膜的种类功能繁多、膜分离设备有开放式和密闭循环式多种,非常适合细菌、病毒、蛋白质、酶的分离纯化浓缩。
由于对病毒的纯化浓缩,增加了生产成本,而且膜分离设备和膜价格较高且操作具有一定的技术难度,所以未被兽医生物制品行业广泛开发研究利用。但人用疫苗的病毒和细菌培养物都是经过纯化的,基本没有副反应。所有病毒、细菌、蛋白质、酶、核酸的纯化浓缩工艺中膜分离技术是最快捷、回收率最高的[10]。本试验处理的病毒液是某兽医生物生物制品厂检验病毒含量低不能用于制备疫苗的,试验结果表明,膜分离技术非常适合报废的病毒液或灭活的病毒液纯化浓缩,做到废物回收利用,降低了生产成本,提高了疫苗的质量。膜分离注意事项是膜的孔径要比目的物的分子量大10倍左右,如果纯化的是活病毒尽量不用除菌处理,以免灭活病毒,循环流量和循环压力[10]尽可能低一些,避免生物活性被破坏。本试验是分段间歇性处理病毒液,下一步将研究密闭可循环式的串滤膜分离操作,达到一次产出合格的产品,提高收率和质量。
[1] 吕建强,陈焕春,赵俊龙,等.猪细小病毒-伪狂犬病病毒二联油乳剂灭活疫苗的研制[J].中国兽医杂志,2005, 41(6):17-20.
[2] 张超范,崔尚金,苗岚飞,等.猪细小病毒灭活疫苗安全性试验及佐剂的筛选[J].中国预防兽医学报,2009,31 (6):462-465.
[3] 张振梅,张超范,崔尚金,等.猪细小病毒BQ株灭活疫苗免疫剂量及免疫持续期的初步研究[J].中国预防兽医学报,2010,32(5):394-397.
[4] 王金华.猪瘟疫苗注射变态反应1例[J].黑龙江畜牧兽医,2002,3:58-59.
[5] 武桂梅,王振辉,张桂荣,等.通过膜分离法纯化猪瘟疫苗的效果分析[J].中国兽医杂志,2011,47(7):25-26.
[6] 王冬梅,吕淑霞,王金胜.生物化学实验指导(第一版)[M].北京:科学出版社,2009: 1-27.
[7] 中华人民共和国农业部.中华人民共和国兽药典[S].北京:中国农业出版社.2011.
[8] 赵本进,陈晓清,倪建平,等.不同剂型的猪细小病毒病油乳剂灭活疫苗比较分析[J].上海农业学报,2008,24(3):42-44.
[9] 张道华,张雪花,唐波,等.猪细小病毒灭活疫苗NJ株毒种分离与鉴定[J].江苏农业学报,2012,28(1):99-103.
[10]吴梧桐.生物制药工艺学(第二版)[M].北京:中国医药科技出版社,2006: 325-363.
(编辑:李文平)
Research on the Effect of Purified and Concentrated Porcine Parvovirus Inactivated Vaccine by Membrane Separation
WU Gui-mei1, WANG Zhen-hui1*, HE Yu-you2, LI Peng1, ZHENG Hong-juan2
(1.JilinAgriculturalScienceandTechnologyCollege,Jilin132101,China;2.JilinZhengYeBiologicalProductsCo.Ltd.,Jilin132101,China)
This research aims to test the immune effect of the purified and concentrated porcine parvovirus inactivated vaccine.The average amount of the porcine parvovirus was increased from 104.7TCID50/mL to 106.5TCID50/mL by applying the microfiltration/ultrafiltration tubular ceramic membrane system to purify and concentrate the porcine parvovirus vaccine cells liquid.Next, the purified concentrated porcine parvovirus virus was inactivated by formaldehyde and passed the test.Then it was used to produce the water-in-oil inactivated vaccines along with the injectable mineral white oil.In accordance with the quality standard of viral inactivation vaccine for Porcine Parvovirus, the immune effect tests have been done.The result show that: the removal rate of impure protein in porcine parvovirus virus liquid is about 71.6%.All three groups of the produced inactivated vaccine meet the standard.After 63 days immunization, the porcine parvovirus antibody level (HI) in immunized pigs is: 9.62 log2dilution ratio in average for purified and concentrated inactivated vaccine and 8.78 log2dilution ratio for conventional vaccines respectively.The difference is significant(P<0.05).The test shows that: the immune effect of inactivated vaccine with inactivated virus liquid membrane purification process was significantly better than the normal vaccines without the purification.
porcine parvovirus virus; purified and concentrated; inactivated vaccine; immune effect
吉林省教育厅“十一五”科研项目(吉教科合字[2008]第245号)
武桂梅,实验师,从事兽医生物制品实验教学研究。
王振辉。E-mail:yaowu108@sohu.com
2015-08-13
A
1002-1280 (2015) 11-0049-04
S858.28
