鸡源大肠杆菌对氟喹诺酮类药物的耐药性分析及相关耐药突变研究
2015-03-11邓春朋王红宁雷昌伟张安云张冬冬
邓春朋 王红宁雷昌伟 张安云 张冬冬
(四川大学生命科学学院,动物疫病防控与食品安全四川省重点实验室,生物资源与生态环境教育部重点实验室,“985工程”西南资源环境与灾害防治科技创新平台,四川成都 610064)
鸡源大肠杆菌对氟喹诺酮类药物的耐药性分析及相关耐药突变研究
邓春朋 王红宁*雷昌伟 张安云 张冬冬
(四川大学生命科学学院,动物疫病防控与食品安全四川省重点实验室,生物资源与生态环境教育部重点实验室,“985工程”西南资源环境与灾害防治科技创新平台,四川成都 610064)
本试验采用药敏纸片法对2014年从13 个不同规模化鸡场分离的135株鸡源大肠杆菌进行常用12种抗菌药物敏感性试验,结果表明,头孢西丁和阿莫西林/棒酸耐药率较低,分别为17.8%、18.5%,而氟喹诺酮类的环丙沙星、诺氟沙星和左氧氟沙星的耐药率较高,分别为68.9%、65.2%和63.7%;进一步对高耐药率的氟喹诺酮类耐药菌株测定环丙沙星MIC值为4~256µg/ml;PCR扩增相关耐药基因(gyrA和parC),并测序分析耐药决定区突变及与MIC对应关系表明,耐药菌株突变主要发生在gyrA基因的Ser83密码子和Asp87密码子,及parC基因的Ser80密码子和Glu84密码子上,不同突变类型分别对应一定MIC值范围,其中73.1%(57/78)突变类型为gyrA基因的C(Ser83)→T(Leu)和G(Asp87)→A(Asn)突变,及parC基因的G(Ser80)→T(Ile)突变,其MIC值在8~256µg/ml之间;本研究提示规模化鸡场在防治大肠杆菌等细菌病时,应根据药敏结果选用药物,少用或不用氟喹诺酮类药物。
鸡源大肠杆菌 氟喹诺酮类药物 耐药性 耐药突变
由某些血清型的禽致病性大肠杆菌感染所引起的鸡大肠杆菌病(Chicken colibacillosis),感染率、发病率、死亡率越来越高,已成为养鸡业中最常见和防治困难的重要疾病之一,给养鸡业造成了巨大的经济损失[1~3]。氟喹诺酮类抗菌药物,具有杀菌力强,抗菌谱广,安全性好等特点,在我国畜禽疾病防治方面使用很广[4]。随着氟喹诺酮类药物的广泛使用,大肠杆菌已成为规模化鸡场耐药最严重的菌种之一[5]。
细菌氟喹诺酮类耐药决定区点突变通常导致耐药性产生[6]。研究表明,对大肠杆菌而言,gyrA基因的Ser83密码子突变引起低度耐药,在发生Asp87密码子突变后导致较高程度耐药[7],而parC基因的Ser80密码子和Glu84密码子突变与高度耐药密切相关[8]。
本研究为规模化鸡场有效防治大肠杆菌引起的发病提供药物选择和使用建议,及为氟喹诺酮类突变耐药的进一步研究提供试验依据。
1 材料与方法
1.1 材料
MH培养基,伊红美蓝培养基(EMB);12种抗菌药物:头孢西丁、多粘菌素、阿米卡星、诺氟沙星、环丙沙星、阿莫西林/棒酸、庆大霉素、左氧氟沙星、氟苯尼考,新霉素,头孢他啶,头孢噻呋;Phoenix-100全自动细菌鉴定系统;BIO-RAD S1000 Thermal Cycler PCR仪;细菌基因组DNA提取试剂盒;PrimeSTAR Max Premix(2×)。
1.2 菌株
试验菌株:135株鸡源大肠杆菌分离自2014年,来源于13个不同规模化鸡场的病死鸡、饲料、蛋品等162份样品中。用接种环进行无菌操作,挑取162个样品划线于伊红美蓝培养基(EMB)37℃培养18~24 h,再挑取表面光滑,边缘整齐,长有紫红色或紫黑色带有金属光泽的小菌落,重复划线培养1~2次,对于可疑菌落进一步采用BD Phoenix™-100全自动细菌鉴定系统进行鉴定。通过鉴定,从162个样品中共分离到135株鸡大肠杆菌,分离率83.3%。质控菌株:大肠杆菌ATCC25922购自中国药品生物制品检定所。
1.3 方法
1.3.1 药物敏感性试验及MIC值测定
药敏试验采用美国临床实验室标准化委员会(the Clinical and Laboratory Institute,CLSI)推荐的K-B纸片法进行[9],以大肠杆菌ATCC25922作为标准质控菌株。
针对氟喹诺酮类耐药大肠杆菌进一步采用琼脂稀释法测定环丙沙星(CIP)最小抑制浓度(Minimum Inhibitory Concentrations,MICs),按照CLSI标准判读结果。
1.3.2 gyrA和parC基因氟喹诺酮类耐药决定区PCR扩增、测序及耐药突变分析
按细菌基因组DNA提取试剂盒说明,提取菌株的基因组DNA模板,针对gyrA基因和parC基因的氟喹诺酮类耐药区序列设计引物,gyrA-F:5′-TACACCGGTCAACATTGAGG-3′;gyrA-FR:5′- TTAATGATTGCCGCCGTCGG -3′;ParC -F:5′- GCGAATAAGTTGAGGAATC AG -3′;ParC -R:5′-AGCTCGGAATATTTCGACAAC -3′。按照PrimeSTAR Max Premix(2×)说明,配置25μL PCR反应体系。PCR反应条件如下:98℃预变性2min;94℃变性15s,55℃~℃58退火5s,72℃延伸5s,35个循环;72℃,延伸2min。扩增结束后,取5μLPCR产物经琼脂糖凝胶电泳后,使用凝胶成像系统照相确定产物,并将得到的gyrA和parC粗产物在低温下送至生工生物工程(上海)股份有限公司纯化后测序。
采用MEGA6生物分析软件,对测序得到的gyrA和parC基因DNA序列和标准野生型菌株大肠杆菌ATCC15922的DNA序列进行比对,确定其和标准菌株的上述DNA序列完全吻合后,比对试验菌株的DNA序列,进一步分析其突变位点和突变类型。
2 结果与分析
2.1 药敏试验及MIC值测定结果
12种常用抗生素的耐药率检测结果表明:头孢西丁、阿莫西林/棒酸和阿米卡星耐药率较低,分别为17.8%、18.5%和20.7%;氟喹诺酮类的环丙沙星、诺氟沙星和左氧氟沙星的耐药率较高,分别为68.9%、65.2%和63.7%。具体见表1。氟喹诺酮类耐药鸡大肠杆菌的环丙沙星MIC值测定结果为4~256 μg/ml。
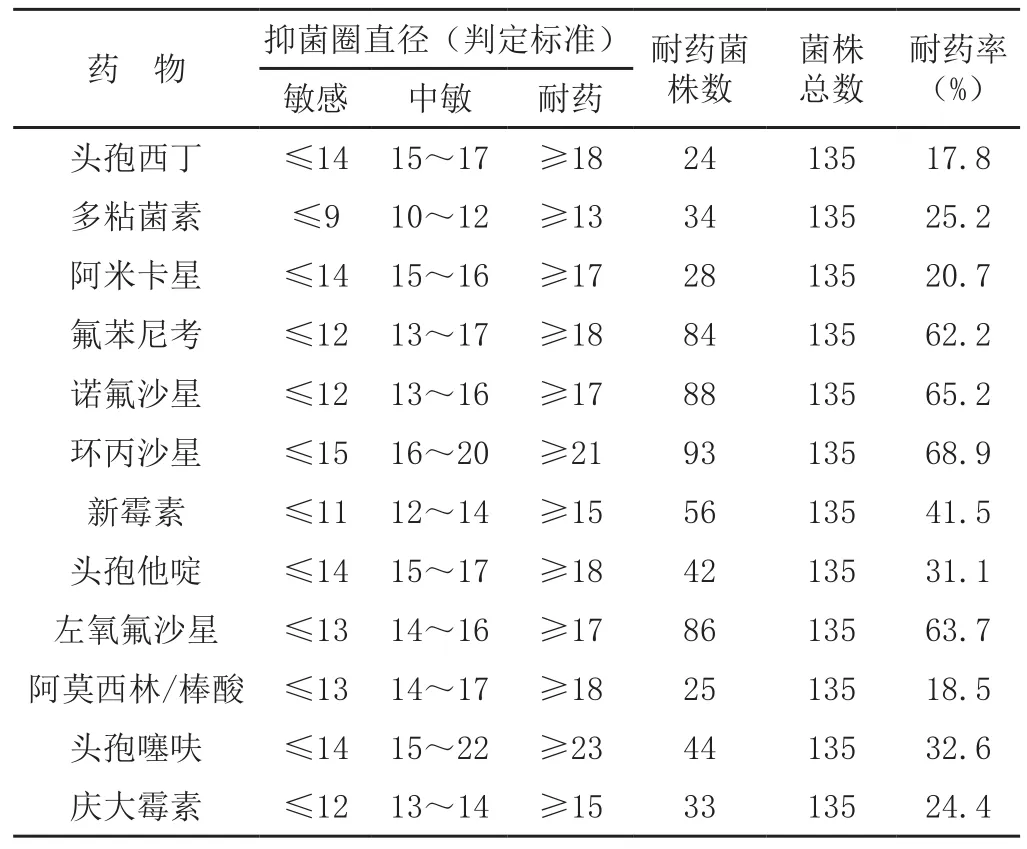
表1 135株鸡源大肠杆菌药敏实验结果
2.2 gyrA和parC基因氟喹诺酮类耐药决定区测序结果及耐药突变分析
2.2.1 gyrA和parC基因氟喹诺酮类耐药决定区测序结果及分析
93株环丙沙星耐药菌和大肠杆菌ATCC25922的氟喹诺酮类耐药决定区测序结果表明:78株耐药菌存在突变,突变耐药率为83.9%(78/93),主要突变位点为gyrA基因的83位Ser密码子和87位Asp密码子,及parC基因的80位Ser密码子和84位Glu密码子;根据这些位点突变的情况,菌株耐药突变类型可分为9种(不含未突变类型),其中73.1%的突变类型为gyrA基因的C(Ser83)→T(Leu)和G(Asp87)→A(Asn)突变,及parC基因的G(Ser80)→T(Ile)突变,而标准野生型菌株的氟喹诺酮类耐药决定区未发现突变。
2.2.2 耐药菌株突变类型与MIC值的对应分析
菌株耐药突变类型与MIC值的对应分析表明:发生gyrA基因的C(Ser83)→T(Leu)或TCG(Ser83)→ATG(Ile)突变仅引起菌株低度水平耐药(MIC值<16 μg/ml);gyrA基因的C(Ser83)→T(Leu)和G(Asp87)→A(Asn)或C(Ala)突变,及parC基因的G(Ser80)→T(Ile)或G(Arg)AGC,或(Ser80)→ATT(Ile)突变类型引起菌株中度水平耐药(MIC<128 μg/ml);在中度水平耐药菌株的突变基础上,发生parC基因的A(Glu84)→G(Gly)或T(Val)突变则引起菌株高度水平耐药(MIC≥128 μg/ml)。
3 讨论
随着氟喹诺酮类药物在我国畜禽养殖中的广泛使用,特别是不科学、过量地滥用氟喹诺酮类药物,导致了细菌的耐药性和药物残留等问题日益突出。B.Stephan等人的研究表明欧洲国家2008年鸡大肠杆菌对环丙沙星的耐药率为55.6%[10]。目前,在美国,氟喹诺酮类药物已被禁止家禽生产中使用,在欧盟,尽管在家禽饲养中仍有可能使用,但也受到有一些限制[11]。而本研究中,我国规模化鸡场鸡源大肠杆菌对环丙沙星的耐药率高达68.9%。
在氟喹诺酮类耐药突变分析中,gyrA基因的C(Ser83)→T(Leu)和G(Asp87)→A(Asn)突变,及parC基因的G(Ser80)→T(Ie)突变类型占突变耐药菌总数的73.1%,说明这可能是我国规模化鸡场环丙沙星耐药大肠杆菌中流行的耐药突变类型,且此类型菌株的环丙沙星MIC值在8~256μg/ml之间,说明存在未知突变或其他因素影响菌株的耐药性。
总之,本研究建议规模化鸡场在防治大肠杆菌等细菌病时,应根据药敏结果选用药物,少用或不用氟喹诺酮类药物。
[1] 郑志明,刘孟,李东明,金文杰,秦爱建.三株具有磷霉素抗性禽源大肠杆菌的分离鉴定及其MIC测定[J].中国家禽,2013,35(11):20-22.
[2] 贺常亮.治疗鸡大肠杆菌病的中药方剂筛选及其作用机理研究[D].长春:吉林大学,2011.
[3] 廖晓萍,岳 磊,曾振灵.禽源大肠杆菌耐药现状与防治对策[J].中国家禽,2008,30(6):1-5.
[4] 朱僧,邢艳萍,胡腾.15株临床分离耐药大肠杆菌耐氟喹诺酮类抗生素基因的检测与序列分析[J].中国兽医学报,2011,36(6):875-879.
[5] Yu,X.,Susa,M.,Knabbe,C.,Schmid,R.D.,Bachmann,T.T.,Development and validation of a diagnostic DNA microarray to detect quinolone-resistant Escherichia coli among clinical isolates[J]. Journal of clinical microbiology,2004,42,4083-4091.
[6] Jacoby,G.A.Mechanisms of resistance to quinolones[J].Clinical infectious diseases,2005,41 Suppl 2,S120-126.
[7] Sáenz,Y.,Zarazaga,M.,Briñas,L.,Ruiz-Larrea,F.,Torres,C.Mutations in gyrA and parC genes in nalidixic acidresistant Escherichia coli strains from food products,humans and animals[J].Journal of Antimicrobial Chemotherapy,2003,51,1001-1005.
[8] Hopkins,K.L.,Davies,R.H.,Threlfall,E.J.Mechanisms of quinolone resistance in Escherichia coli and Salmonella[J].International journal of antimicrobial agents,2005,25,358-373.
[9] 谭 瑶,舒为群,陈 浩.K-B纸片扩散法药敏试验[J].检验医学与临床,2010,7(20):2290 - 2291.
[10] A.de Jong,B.Stephan,P.Silley.Fluoroquinolone resistance of Escherichia coli and Salmonella from healthy livestock and poultry in the EU[J].Journal of Applied Microbiology,2011,112,239-245.
[11] Vanni M,董晓云.家禽大肠杆菌喹诺酮耐药决定区氟喹诺酮类药物耐药性及gyrA和parC基因分子特性研究[J].中国畜牧兽医,2014,(05),pp.93.
国家973重点基础研究计划(2013CB127200)、国家现代农业产业技术体系项目(蛋鸡)(CARS-41-K09)、四川省蛋鸡产业链项目(2011NZ0073)、四川省肉鸡产业链项目(2012NZ0037)、四川省科技基础条件平台项目-动物疫病防控与动物产品安全(14010136)。
邓春朋,男,硕士研究生,从事应用微生物研究。
王红宁,女,教授,博士生导师,从事动物疾病防控、微生物基因工程研究。
