鸡源和鸽源基因Ⅵ型新城疫病毒对鸽的致病性比较
2015-06-15胡新岗吴双黄银云郭广富
胡新岗+吴双+黄银云+郭广富
摘要:为了比较鸡源、鸽源VIb亚型新城疫病毒(NDV)对鸽的致病性差异,选取鸡源毒株ZJ3和鸽源毒株 WX-10-07-Pi,分别人工感染2月龄试验鸽。接种后,观察试验鸽的临床症状、病理剖解变化、喉气管和泄殖腔排毒以及组织学病变情况,结果发现,2株NDV均能导致接种鸽发病,发病率为100%,死亡率为0;WX-10-07-Pi感染组鸽泄殖腔排毒时间长,而且病毒检出率比其他组高;此外,在接种组鸽的多种组织器官中均可检测出病毒。试验结果表明,不同基因型NDV对鸽均有致病性,但致病力强弱与 NDV毒株特性有关;鸽源基因Ⅵb亚型NDV在鸽体内可长期带毒与排毒,且更易在鸽群中传播。
关键词:新城疫病毒;基因Ⅵ型;鸽;致病性;鸡源
中图分类号: S855.3 文献标志码: A
文章编号:1002-1302(2015)04-0208-03
收稿日期:2014-05-09
基金项目:国家自然科学基金(编号:31440083);江苏省科技支撑计划(编号:BE2012366);江苏农牧科技职业学院科研项目(编号:YB201006)。
作者简介:胡新岗(1974—),男,安徽宿州人,硕士,副教授,从事动物医学专业的教学、科研及高职教育管理研究。Tel:(0523)86158089;E-mail:gxh008@qq.com。
通信作者:吴 双,博士,副教授,研究方向为动物传染病防控与流行病学。E-mail:jswushuang@sina.cn。
新城疫(Newcastle disease,ND)是一种急性、高度传染性疾病,已知能自然或人工感染新城疫病毒(Newcastle disease virus,NDV)的鸟类超过了250种,现在已经被国际兽疫局(OIE)列为法定应报告的传染病[1]。鸽子是介于家养和野生中间状态的禽类,在新城疫传播中起到重要的桥梁作用,而鸽新城疫是由鸽Ⅰ型副黏病毒(pigeon paramyxovirus type 1,PPMV-1)引起的一种高度接触性传染病,是严重危害养鸽业的主要疫病之一[2]。大多数学者认为,PPMV-1是鸡NDV的一种变异株[3],该病毒首次于1981年在鸽体内被分离到,其中基因Ⅵ型NDV被认为是引起20世纪80年代初期新城疫第3次大流行的主要毒株,并在世界范围内陆续在鸽系野禽中流行[4]。
诸多分子流行病学研究表明,基因Ⅵ型NDV主要在鸽群中分离到,并且鸽群中分离到的NDV主要是基因Ⅵb亚型,与当前世界上流行的优势基因Ⅶd亚型并不一致[5-6];此外,对鸡而言,鸽体内分离的强毒NDV一般被认为是中等毒力病毒,这在一定程度上表明基因Ⅵb亚型NDV对其他家禽的传播能力相对有限[7-8]。因此可以认为,基因Ⅵb亚型NDV非常特殊、生物学意义重大,但是目前对基因Ⅵb亚型病毒的研究开展得还不够深入,多局限于基因组序列测定、分析和主要蛋白的表达等层面。本试验研究鸽源、鸡源基因Ⅵ型NDV对鸽的致病性,并分析鸽感染2种病毒后的临床诊断症状、病理变化、排毒规律等差异,以期了解它们在病毒携带和传播中的作用,对于基因Ⅵ型NDV的研究和控制具有一定的现实指导意义。
1 材料与方法
1.1 试验材料
1.1.1 毒株 基因Ⅵb亚型鸡源NDV ZJ3、基因Ⅵb亚型鸽源NDV WX-10-07-Pi均由农业部畜禽传染病学重点开放实验室分离、纯化和保存。ZJ3、WX-10-07-Pi均为对鸡中等毒力毒株,鸡胚半数致死量ELD50(0.1 mL接种剂量)毒价分别为108.50、108.14。
1.1.2 鸡胚及试验动物 非免疫鸡胚购自扬州市某非免疫鸡场,自行孵化到所需日龄。2月龄非免疫美国白羽王鸽,购自江苏省江都市飞亚肉鸽养殖基地。经测定,试验前所有试验动物体内均无NDV和禽流感病毒抗体。
1.1.3 运输液 运输液的配制是根据OIE推荐的配方[9]并稍作调整:用pH值为7.2的磷酸缓冲盐(PBS)溶液配制运输液,溶液中各种抗生素的剂量分别为青霉素10 000 U/mL,链霉素 10 mg/mL,庆大霉素250 μg/mL,卡那霉素250 μg/mL;最后用10mol/L浓度的NaOH溶液调节pH值,使运输液的pH值为7.2。
1.2 试验方法
1.2.1 分组设计 将20羽2月龄的美国白羽王鸽分成2组,每组10羽,另取5羽作为阴性对照组隔离饲养,专人负责。试验组鸽每羽滴鼻、点眼接种含1×106个ELD50病毒尿囊液。阴性对照组鸽接种同剂量的PBS。
1.2.2 临诊症状 接种后每天早晚定时观察2次,持续观察30 d,记录试验鸽的临床症状及发病死亡情况。
1.2.3 喉头和泄殖腔排毒检测 接种后每天定时采集泄殖腔棉拭子及喉头棉拭子,将棉拭子放入四抗PBS中,保存于-20 ℃。每份棉拭子接种3枚9~11日龄非免疫鸡胚,每 12 h 观察1次鸡胚,观察120 h。弃去24 h内死亡的鸡胚,将24 h以后死亡及120 h以后未死亡的鸡胚置4 ℃冰箱过夜后收集尿囊液,测定其血凝价。
1.2.4 病理切片 分别于接种后4、7、14 d,每组随机取2羽鸽子(对照组取1羽),进行病理解剖,记录剖解变化情况。采集气管、肾脏、脾脏、肺脏、肝脏、胰腺、回肠、十二指肠、胸腺9种组织,用10%福尔马林固定,按常规制作石蜡组织切片,苏木精-伊红(HE)染色,在光学显微镜下观察病理组织学变化。
2 结果与分析
2.1 临诊症状
病毒接种后3 d,WX-10-07-Pi、ZJ3感染组仅表现出轻微的精神状态不佳。WX-10-07-Pi组于接种后4 d粪便呈现墨绿色;接种后6 d精神不振、食欲减退,大部分病鸽表现出翅膀悬垂或向两侧分开,两脚麻痹、不能站立;接种后10 d出现眼睑发炎、呼吸困难、咳嗽;在观察期后期,出现轻微的震颤神经症状。ZJ3组在感染后7 d粪便呈水样稀粪;接种后9 d粪便呈墨绿色黏性稀粪;接种后12 d眼睑发炎、眼睛半睁半闭,呼吸困难,出现神经症状;接种后15 d左右,出现典型的神经症状,呈“观星姿势”;接种后20 d起神经症状有所缓解。在1个月的试验期内,试验组鸽发病率为100%,WX-10-07-Pi、ZJ3组均未见死亡,所有耐过的病鸽精神尚好,但明显消瘦;阴性对照组鸽无异常表现。endprint
2.2 病理解剖学变化
WX-10-07-Pi感染组在接种后5 d脾脏轻微肿大,肝边缘有出血点,气管环轻微出血;鸡接种后11 d气管环严重出血。ZJ3感染组鸽在接种后3 d脾脏肿大,表面有针尖至粟粒大的灰白色的坏死结节或伴有出血点,肝脏稍肿;接种后 4 d 胰腺萎缩,肝脏边缘、表面及心叶有出血点和出血纹,气管充血、出血;接种后6 d肝脏呈土黄色。
2.3 泄殖腔和喉头排毒检测
每个泄殖腔棉拭子接种3枚9~11日龄非免疫鸡胚。结果发现,ZJ3感染组的泄殖腔棉拭子中没有检测到病毒,而WX-10-07-Pi感染组的泄殖腔棉拭子中病毒分离率较高,结果见表1。由结果还可见,ZJ3组在接种后的1~4 d能检测到喉头间断性排毒,WX-10-07-Pi组在接种后1至 5 d 检测到喉头持续排毒。
表1 病毒 WX-10-07-Pi感染后3~17 d泄殖腔棉拭子分离病毒结果
接种时间(d) 阳性鸽数(羽) 幸存鸽数(羽)
4 0 10
5 5 8
6 4 8
7 3 8
8 4 6
9 5 6
10 4 6
11 4 6
12 5 6
13 2 6
14 1 6
15 2 4
16 0 4
17 0 4
注:由于ZJ3感染组的泄殖腔棉拭子中未检测出病毒,因此未在表中列出。
2.4 病理组织学变化
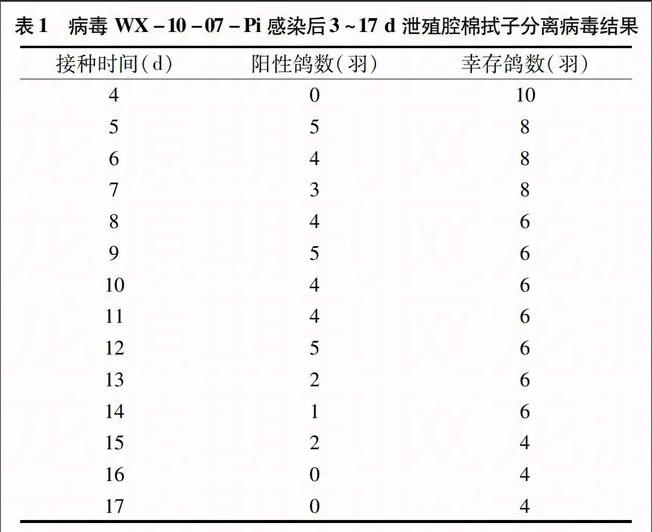
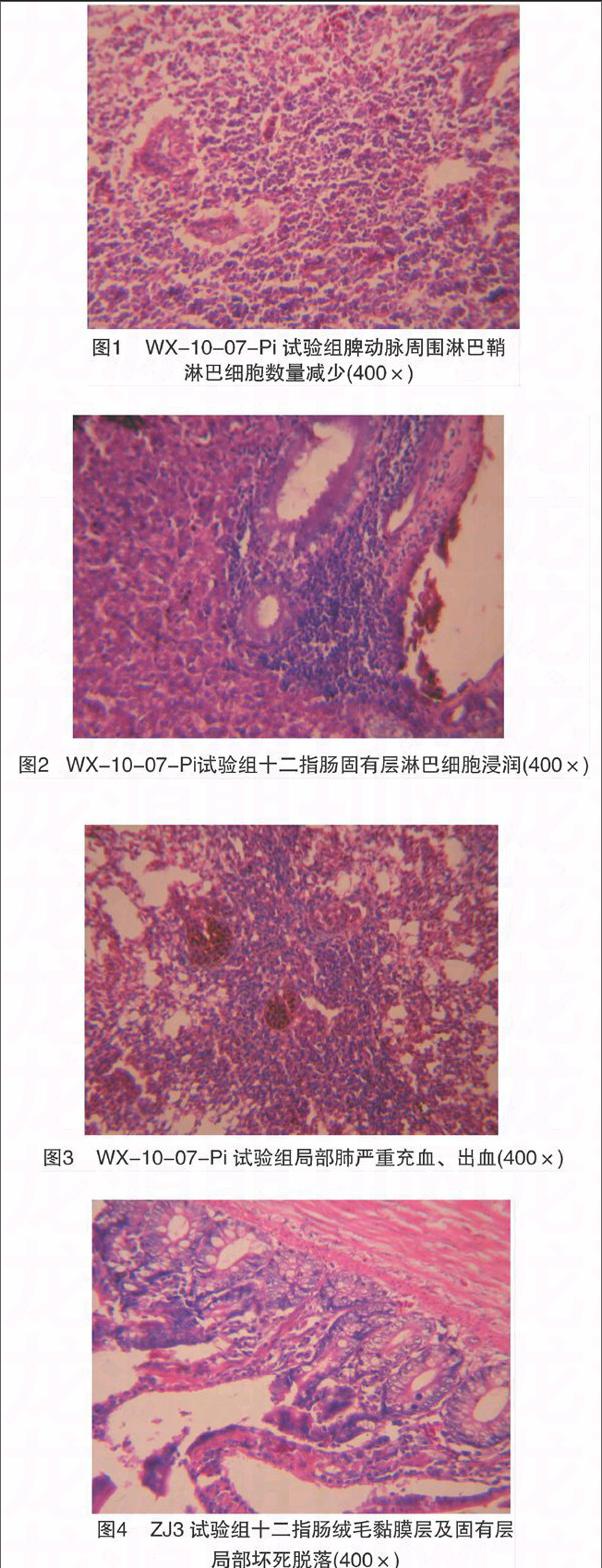
接种后,WX-10-07-Pi组鸽的脾脏、肺脏、十二指肠发生了明显的病理组织学变化,ZJ3组的组织学病变主要为脾动脉周围淋巴鞘淋巴细胞数量减少、十二指肠绒毛黏膜层及固有层局部坏死脱落;对照鸽未见异常变化。具体组织病变详见图1至图6,图7至图9为对照组肺、十二指肠、脾脏组织切片。
3 结论
不同宿主源基因Ⅵb亚型NDV同时感染鸽的试验研究数据目前还比较缺乏,在本试验中,用鸡源毒株ZJ3、鸽源毒株WX-10-07-Pi分别感染美国白羽王鸽,均未引起感染鸽的死亡;ZJ3感染组出现疾病症状比WX-10-07-Pi感染组晚,但是临床症状比WX-10-07-Pi严重许多,尤其是相关的神经症状更为明显,试验结果与相关文献报道鸡源强毒
NDV感染鸽未表现出任何临床症状不一致[10]。大体病变结果表明,肝脏和脾脏是最先观察到的病变部位,随着病程发展,更多的脏器出现病变,但其出现比例和严重程度都不算很高。大体病变最明显的区别是ZJ3感染组中肝脏呈现土黄色的病例较多,有个别病鸽虽然临床诊断症状相当严重,但大体病变却并不显著,与文献报道的一致[11]。
尽管2株病毒对鸽的致病性相当,但是ZJ3感染组泄殖腔却没有检测到排毒,WX-10-07-Pi感染组的泄殖腔棉拭子中病毒分离率较高;喉头排毒检测结果表明,鸽源毒株WX-10-07-Pi带毒时间长且排毒率明显高于ZJ3感染组。这在一定程度上表明,鸽源NDV更容易在鸽群中传播。此外,病鸽多种组织器官出现明显的组织损伤,主要见于消化系统和免疫系统,但是出现病变的比例和严重程度都不高。WX-10-07-Pi组的肺脏发生组织学病变,而ZJ3组的肺脏正常,在一定程度上说明WX-10-07-Pi对鸽的呼吸道亲嗜性较强。
从临床症状、泄殖腔的排毒时间以及泄殖腔的病毒检出率可以部分看出,同为基因Ⅵb亚型,鸽源NDV比鸡源NDV更易在鸽群中传播。这些结果一定程度上验证了目前在我国,Ⅵb亚型是鸽群中所特有的基因型,且鸽源分离株绝大多数属于该亚型的结论。
参考文献:
[1]Alexander D J. Newcastle disease[M]//Saif Y M,Barnes H J,Glisson J R,et al. Diseases of poultry. 11th ed. Ames:Iowa State University Press,2003:64-87.
[2]Alexander D J. Newcastle disease and other Paramyxoviridae infections[M]//Calnek B W,Barnes H J,Beard C W,et al. Diseases of poultry. Ames:Iowa State University Press,1997:541-569.
[3]Alexander D J,Russell P H,Parsons G,et al. Antigenic and biological characterization of paramyxovirus type Ⅰ isolates from pigeons—an international collaborative study[J]. Avian Pathol,1985,14(3):365-376.
[4]Kaleta E F,Alexander D J,Russell P H. The first isolation of the avian PMV-1 virus responsible for the current panzootic in pigeons ?[J]. Avian Pathology,1985,14(4):553-557.
[5]Liu X F,Wan H Q,Ni X X,et al. Pathotypical and genotypical characterization of strains of Newcastle disease virus isolated from outbreaks in chicken and goose flocks in some regions of China during 1985—2001[J]. Archives of Virology,2003,148(7):387-1403.endprint
[6]Guo H B,Liu X L,Han Z X,et al. Phylogenetic analysis and comparison of eight strains of pigeon paramyxovirus type 1 (PPMV-1) isolated in China between 2010 and 2012[J]. Archives of Virology,2013,158(6):1121-1131.
[7]Aldous E W,Fuller C M,Ridgeon J H,et al. The evolution of pigeon paramyxovirus type 1 (PPMV-1) in Great Britain:A molecular epidemiological study[J]. Transboundary and Emerging Diseases,2014,61(2):134-139.
[8]Kim L M,King D J,Guzman H,et al. Biological and phylogenetic characterization of pigeon paramyxovirus serotypes 1 circulating in wild North American pigeons and doves[J]. Journal of Clinical Microbiology,2008,46(10):3303-3310.
[9]王志亮,刘华雷.新城疫[M].北京:中国农业出版社,2012.
[10]de Oliveira T C A,Seki M C,de Freitas R T,et al. Experimental infection of Newcastle disease virus in pigeons (Columba livia):Humoral antibody response,contact transmission and viral genome shedding[J]. Veterinary Microbiology,2008,129(1/2):89-96.
[11]万洪全,刘海侠,吴力力,等. 鹅副黏病毒对鸽的致病性研究[J]. 中国兽医科技,2002,32(5):5-8.endprint
