基于脑局部给药的药物分布与清除大鼠模型的建立*
2015-03-11雷易鸣闫军浩刘会坡蒲小平韩鸿宾
左 龙 雷易鸣 闫军浩 刘会坡 袁 兰 蒲小平 韩鸿宾
(北京大学第三医院放射科 磁共振成像设备与技术北京市重点实验室,北京 100191)
·实验研究·
基于脑局部给药的药物分布与清除大鼠模型的建立*
左 龙 雷易鸣①闫军浩②刘会坡③袁 兰④蒲小平⑤韩鸿宾**
(北京大学第三医院放射科 磁共振成像设备与技术北京市重点实验室,北京 100191)
目的 应用磁共振分子探针示踪技术,研究大鼠深部脑组织间隙(interstitial space,ISS)内物质转运与脑组织液引流的规律。结合多孔介质经典扩散方程,建立大鼠脑局部给药的药物分布与清除动力学模型。 方法 24只SD大鼠随机分为尾状核、丘脑、中脑黑质3组(n=8)。将细胞外示踪剂惰性分子探针钆喷酸葡胺(gadolinium-diethylenetriaminepentaacetic acid,Gd-DTPA) 2 μl分别导入三个脑区细胞外间隙,利用磁共振成像(MRI)动态采集探针在大鼠脑ISS内的分布与清除过程。通过图像后处理获取ISS内示踪分子在大鼠全脑分布的最大分布容积比(Vdmax%)及半衰期(t1/2)。应用经典扩散方程,测量ISS有效扩散系数(D*)、清除率(k’)与局部迂曲度(λ)。结合上述结果及经典扩散方程,建立大鼠脑组织间隙内药代动力模型。 结果 示踪分子在大鼠不同脑区ISS内的转运分布区域、清除速率各不相同。尾状核Vdmax%和t1/2大于丘脑和黑质(P=0.000)。黑质区D*小于尾状核、丘脑(P=0.021),黑质ISS内迂曲度最大(P=0.280)。丘脑局部k’大于尾状核和黑质区域(P=0.000)。 结论 钆喷酸葡胺(Gd-DTPA)在大鼠深部脑组织内分布呈分区特征,各分区内药物的分布与清除速率各不相同。脑局部给药需考虑脑内ISS的解剖分区以及各个脑分区的物质转运与脑组织液流动参数特征。
组织间液; 细胞外间隙; 示踪剂; 扩散
脑局部给药可绕过血脑屏障(blood-brain barrier,BBB)的阻碍,是微创治疗脑病的新希望[1]。然而局部治疗药物在脑组织间隙(interstitial space,ISS)内的分布与清除过程的计算一直是脑局部给药领域的难题[2]。为此本课题组建立了基于MRI分子示踪技术的ISS成像系统,突破了以往脑组织间隙的测量技术的局限性[3],通过向ISS内导入磁性分子探针钆喷酸葡胺(Gd-DTPA)在MRI上“点亮”ISS内的水分子,实现了在全脑尺度脑组织间液(interstitial fluid,ISF)引流过程的动态观察[4,5],使探测脑深部组织ISS内组织液的引流情况成为可能。同时,可三维显示ISS内分子探针在全脑的分布与清除过程,对于ISS内水溶性药物的转运将提供更直接的参考。因此,本研究利用MRI分子探针示踪技术专门对尾状核(CPu)、丘脑(T)和黑质(SN)等脑深部核团区的ISS引流与物质转运规律进行研究。上述3个脑区是脑卒中、帕金森病的好发部位,具有非常重要的临床意义。我们的前期研究已经证实这3个脑区的微观扩散参数不同[6]。本研究进一步对上述3个脑区内的物质转运与脑组织液在全脑范围内的分布与清除过程进行动态研究与定量分析,在此基础上,结合多孔介质内物质的经典扩散方程,探讨建立脑ISS内药物分布与清除的动力学模型。
1 材料与方法
动物实验得到北京大学医学部伦理委员会的批准(Approval No. LA 2009-008)。
1.1 Gd-DTPA溶液和琼脂糖凝胶体模的配制
用生理盐水将Gd-DTPA释至10 mmol/L。将琼脂糖粉末(0.3 g)溶解于100 ml生理盐水中,混合物水浴加热直至粉末溶解。混合物室温下冷却至凝胶形态。在恒温水域装置中,使其保持37 ℃,在0.3%琼脂糖凝胶体模上进行自由扩散系数(D)的测量。
1.2 MRI扫描序列、体模研究和自由扩散参数的测量
1.2.1 MRI扫描序列 在3.0T磁共振机(Magnetom Trio,Siemens Medical Solutions,Erlangen,德国)上,采用腕线圈采集大鼠颅脑快速采集磁化准备梯度回波序列(magnetization-prepared rapid gradient-echo,MP-RAGE)T1加权图像。扫描参数如下:脉冲重复时间(TR)1500 ms,回波时间(TE)3.7 ms,翻转角12°,反转时间(TI)900 ms,视野(FOV)267 mm,体素0.5 mm×0.5 mm×0.5 mm,矩阵512×512,平均次数2,相位编码步数96。每只大鼠的扫描时间约为290 s。
1.2.2 体模研究测量自由扩散参数 琼脂糖凝胶体模是标准的生物渗透组织的代表,示踪剂在其中的扩散可以被认为是自由扩散。注射Gd-DTPA前应用MP-RAGE序列对其进行扫描。在10 min以内将2 μl Gd-DTPA溶液(10 mmol/L)注入琼脂糖凝胶体模中心,等待5 min以防回流。注射示踪剂Gd-DTPA后,每0.5 h进行MRI扫描来记录扩散过程。
1.3 动物实验
1.3.1 实验动物 实验使用24只年龄相近,体重250~300 g的雄性SD大鼠。大鼠随机分成3组,每组8只,在不同部位注射药物:①尾状核组(对照《大鼠脑立体定位图谱》确定前囟前1.0 mm,中线右3.5 mm,深4.5 mm);②丘脑组(前囟后2.0 mm,中线右2.0 mm,深5.5 mm);③黑质组(前囟后4.8 mm,中线右1.9 mm,深8.5 mm)。
1.3.2 MR预扫描 大鼠通过腹腔内注射戊巴比妥、乙醇、水合氯醛、硫酸镁和丙二醇(0.3 ml/kg)的复合物进行麻醉,操作过程中通过补充注射维持麻醉状态[0.2 ml/(kg·h)]。用直肠温度计测量中心温度,检查过程中用电热垫使体温维持在(38±0.5)℃。大鼠俯卧位行MRI扫描(具体参数见1.2.1),以获得基本的参考图像,确定穿刺部位。
1.3.3 向鼠脑中注射Gd-DTPA测量脑ISS的扩散参数 注药前的MRI扫描用以测量穿刺的路径和深度,确保穿刺的准确性。刮去大鼠头顶皮肤,并以酒精消毒。从双耳区至两眼间线区,沿正中矢状缝切开,剥离骨膜和肌肉,暴露前囟。将大鼠固定于立体定位仪(Lab Standard Stereotaxic-Single,Stoelting Co,美国),并根据3组不同的定位钻孔。将10 μl的微量注射器立体定位后(深度4.5 mm),在10 min以内以0.2 μl/min的速率向3组不同位点手动推入10 mmol/L Gd-DTPA,等待5 min以防止其沿针头回流。在确认每只大鼠的注药部位无误后,迅速将其置于MRI机中扫描。
1.3.4 MR扫描及图像后处理 注射Gd-DTPA后,在15、30 min及其后每小时用MP-RAGE序列对每只大鼠进行扫描(成像序列及参数见1.2.1)。使用以矩阵实验室软件(Matrix & laboratory,MATLAB)为基础自主研发(未公开)的软件对注药前后获得的MR图像进行配准。所有注药后的MR图像经自动刚性变换、相似性测量、高阶内插以及自适应随机梯度下降优化后,与预扫描的图像进行减影。通过在感兴趣区(region of interest,ROI)中设定种子点和阈值获得“明亮区域”与示踪剂的出现有关。应用该软件我们得到一套新的,层厚为1 mm的,包含轴位、冠状位和矢状位的MR处理后图像。经过配准和减影后,用信号强度增量(ΔSI)对处理后MR图像靶区的信号强度进行测量,将所得数值用于鼠脑ISS扩散参数的进一步计算。
1.3.5 脑ISS扩散参数的计算 采用以修正的扩散方程和标准最小二乘法为基础的算法计算扩散参数:迂曲度λ=(D/D*)1/2,自由扩散系数(D)及有效扩散系数(D*)分别是某种给定分子在自由媒介及脑ISS中的扩散系数,而λ表示ISS局部结构对扩散的阻碍作用。采用标准最小二乘法拟合技术,求解D*和k’。数值最小化计算采用单纯的下行计算方法。

1.3.6 脑ISS物质转运宏观分布与清除参数的计算 采用自主研发的图像后处理软件提取感兴趣区内高于背景噪声2个标准差的所有像素作为Gd-DTPA的分布区域,采用遍历算法得到每只鼠脑最大分布容积比(Vdmax%)。再将从每个鼠脑提取的Gd-DTPA分布区域进行可变性向量场(deformable vector field,DVF)配准,映射到基于互信息配准算法重建得到的标准鼠脑上,对不同脑区的Vdmax采用不同的伪彩色标记。最后对3组不同脑区的Vdmax占全脑的比例进行统计学分析。根据时序MR扫描图像上每个像素的浓度-时间曲线,可以计算得到每个时间点Gd-DTPA的总量(Gdsum)。Gd-DTPA在脑内的清除符合一级动力学方程,即Gdsum=e-kt,k是清除速率常数,与半衰期的关系为t1/2=ln(2/k)。

2 结果
2.1 示踪分子经ISS分布动态过程的MRI表现
在ISS内导入Gd-DTPA分子探针后,注药点周围局部脑组织在MRI上表现为高信号。随着脑ISS内水分子的扩散及ISF的流动运动,导入的Gd-DTPA浓度逐渐稀释,表现为增强区域范围扩大,信号强度下降(图1)。在3个脑区中,尾状核ISS内示踪分子的分布区域最为广泛,在2 h后,示踪分子可达到同侧大脑额、颞、顶区的皮层,并最终引流入蛛网膜下腔。相比之下,丘脑及中脑黑质的强化区局限于其解剖分区而并未向远处分布。
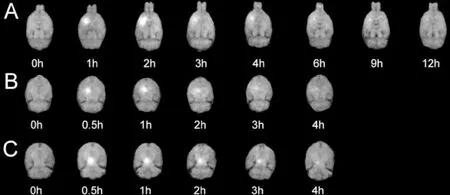
图1 注射Gd-DTPA前后的冠状位鼠脑MRI表现。强化开始出现于注药后0.5 h,不同部位强化范围不同,并且信号强度随时间衰减。A-尾状核;B-丘脑;C-中脑黑质Figure 1 Coronal views of the rat brain at times before and after Gd-DTPA injection. The images showed the initial gradual enhancement at 0.5 h after injection, and different scopes of enhancement at different structures with enhancement decaying with time. A: caudate putamen; B: thalamus; C: substantia nigra.
2.2 不同脑区ISS内药物的分布与清除
尾状核Vdmax%大于丘脑和黑质(9.61%±1.36% vs. 2.30%±0.63% & 3.27%±0.72%,F=102.724,P=0.000, LSD test,t=7.32, 6.35,P均=0.000)。尾状核区t1/2大于丘脑和黑质[(1.46±0.24) h vs. (0.81±0.03) h & (0.68±0.24) h,F=27.956,P=0.000, LSD test,t=0.66, 0.79,P均=0.000](图2)。
2.3 ISS内扩散参数、平均迂曲度和微观清除率的比较

图2 鼠脑ISF流动参数统计分析。A:Gd-DTPA分布容积比-时间变化曲线;B:Gd-DTPA含量-时间拟合曲线;C:Gd-DTPA的Vdmax%比较;D:t1/2的比较。CPu:尾状核;T:丘脑;SN:中脑黑质;**P<0.01,***P<0.001Figure 2 Statistical analysis of ISF parameters in rat brains. A: Gd-DTPA volume of distribution ratio-time curve; B: Gd-DTPA amount-time fitting curve; C: Vdmax% comparisons; D: half life time (t1/2) comparisons. CPu: caudate putamen; T: thalamus; SN: substantia nigra. **P<0.01, ***P<0.001.
经计算,在37 ℃琼脂糖凝胶中,示踪分子探针的D为5.18×10-4mm2/s。黑质D*小于尾状核和丘脑[(2.06±1.01)×10-4mm2/s vs. (3.33±0.69)×10-4mm2/s & (3.37±0.45)×10-4mm2/s,F=5.034,P=0.021, LSD test,t=1.18,1.21,P=0.016,0.014]。黑质λ最大,而尾状核和丘脑之间无显著差异(2.46±0.87 vs. 1.63±0.43 & 1.56±0.21,F=4.567,P=0.280,LSD test,t=0.83, 0.90,
P=0.024, 0.016)(图3)。丘脑k’大于尾状核和黑质[(1.55±0.39)×10-4/s vs. (0.65±0.11)×10-4/s & (0.88±0.25)×10-4/s,F=17.169,P=0.000,LSD test,t=0.90, 2.01,P=0.000, 0.001](图3)。

图3 鼠脑ISS扩散参数统计分析。A:有效扩散系数(D*);B:迂曲度(λ);C:清除率(k’)。CPu:尾状核;T:丘脑;SN:中脑黑质;*P<0.05,**P<0.01Figure 3 Statistical analysis of ISS diffusion parameters in rat brains. A: effective diffusion coefficient (D*); B: tortuosity (λ); C: local clearance rate (k’). CPu: caudate putamen; T: thalamus; SN: substantia nigra. *P<0.05, **P<0.01.
3 讨论
本研究结果表明,对于导入到ISS内的药物而言,脑组织间隙存在一个分区的引流系统,每个ISS分区内药物的分布范围、流动速度和清除过程均不相同。尽管都位于脑的深部区域,且彼此邻近,但尾状核、丘脑和黑质区的ISS内的物质的部分并不沟通,在各自独立的引流区内分布,并且内部药物转运的速度也各不相同。尾状核区ISS内示踪分子的分布范围最大,在2 h左右,扩散至同侧大脑额、颞、顶区的皮层,并最终引流入蛛网膜下腔。相比之下,丘脑及中脑黑质的强化区局限于其解剖分区。
脑组织间隙由细胞周围基质、组织液、组织通道共同组成。其中组织液是神经细胞获取营养物质、转运各类代谢与活动所需能量与代谢废物的直接场所,其内物质转运的基本方式包括扩散和团流运动[7]。扩散是由于浓度梯度为动力的物质运动方式,而团流或者对流运动是以压力梯度为动力的物质运动方式。本研究中采用的Gd-DTPA是一种具有极性的水溶性细胞外示踪分子探针,相对分子质量为938.00,可缩短邻近2.41~2.44 Å范围内的水分子中的氢原子核的进动频率,进而在MRI上表现为高信号。
与以往报道的对流增强给药(convection-enhanced delivery,CED)给药方式不同,本研究并没有采用持续加压的给药方式,我们采用了单次微小剂量局部给药,这种给药方式只提供了药物在ISS内的扩散浓度梯度,藉此,所导入的惰性磁敏感分子探针Gd-DTPA在ISS内也可以向远处扩散分布。因此,我们证实只要药物的极性和大小合适,在ISS内的转运分布并不一定需要外部压力的辅助,只依靠浓度梯度一样可以使药物在ISS内得以向远处分布[8]。同时,本研究结果也表明,药物经脑ISS在脑内的分布是呈现分区分布特征的,因此,必须根据药物靶区的位置来选择药物导入的原始点。换言之,在脑内的某个ISS脑区内,即使形成局部的浓度梯度,甚至持续施加压力,形成压力梯度,也无法使药物扩布到其他邻近的ISS分布区域。
对于单个ISS分区而言,药物在其内的分布还与该ISS分区的结构特征,如迂曲度、空间占比有关,其内ISF的流动速度也与ISF的黏度、温度有关[9]。当然,神经元、胶质细胞、血管内皮的细胞膜及其表面的基质成分共同构成了ISS的空间框架,这个空间内部或周围的所有成分都可能影响ISF的引流速度[10]。已有报道在神经元电兴奋活动会导致局部水分子扩散速率下降[11],睡眠或麻醉状态下中脑ISS内代谢产物的清除较清醒状态下明显增快[12]。上述研究都显示ISF的流动速度与ISS内的物质转运与脑神经元的兴奋活动有关。
星形胶质细胞是ISF流速的重要影响因素[13]。AQP4是表达于星形胶质细胞、BBB、血脑脊液屏障表面的膜蛋白[14],ISS中的水通过AQP4的运输进出星形细胞,并导致细胞的肿胀或萎缩,最终导致ISS体积或ISF流速的变化[15]。
细胞外基质是脑细胞微环境的重要组成部分[16]。细胞外基质分子可以增加ISS的迂曲度,使得ISS不再是自由介质[17],比如,其中的透明质酸的水合作用可影响ISS的宽度[18]。另外,细胞外基质带负电的大分子会影响阳离子和阴离子物质成分的转运[19]。
血管对ISF的影响是多方面的。首先,血管周边的ISS尺度较大,且动脉搏动是促成ISF流动的重要因素,这使得血管周围的ISF是脑内清除代谢废物的重要途径[20]。其次,血管渗透性对ISF容量存在明显影响,从而也间接影响着ISF的流动速度和其内水分子的扩散速度[3]。
虽然脑ISS分区以及不同ISS分区内ISF流速差异的机制尚不清楚,但本研究显示的脑ISS内物质转运的位置依赖性不仅揭示了一种全新的脑分区系统,也为局部给药技术的优化提供一个实用的参考以及数学建模的平台[5,8]。
本研究动态观察了惰性分子探针Gd-DTPA在脑内的分布代谢与清除的过程,并根据传统药代学的经验,选取Vdmax%和半衰期2个基本参数来表述药物在ISS内的分布与清除过程。由于本研究中3个脑区内的药物整体清除过程都呈单指数衰减,因此,我们应用半衰期来表述药物在不同脑ISS分区内的清除过程。在各个ISS脑分区内,药物在任一位置的浓度动态变化也可计算得到。另外,利用经典扩散方程,我们还可以对脑内任一位置的药物分布与清除进行精准定量分析。在此,我们只提出一个基于经典扩散方程的改良药物在ISS某个脑区内的扩散方程。
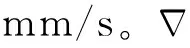
几十年来,采用传统给药途径进行绝大多数脑病治疗药物的临床试验结果令人沮丧[21],比如,经传统的口服或静脉内给予神经保护药治疗缺血性卒中已被证明无效,这一类耗费巨资的项目流产的原因被广泛而深入地讨论,但结合本研究的结果,我们认为以往所选用的不适当的给药途径是问题的核心和关键。
利用上述模型,本课题组在前期的研究工作中,成功计算出胞二磷胆碱(citicoline,CDPC)在ISS内的给药浓度和有效剂量,并依据惰性药物Gd-DTPA的分布清除过程,推演出CDPC在脑内的动态分布与清除的近似过程,评价了其在离体培养中的神经保护效果,较常规给药途径发挥了更高效的神经保护作用[5]。药物在ISS发挥作用的方式、作用位点、入胞与否,需进一步深入探索。因此,本研究提供的参考系统对其他水溶性小分子药物或脂溶性小分子药物在ISS内的分布代谢过程的指导价值均有待进一步的研究证实。
本研究中所采用的MRI示踪法可提供全脑尺度范围内ISS内物质转运的三维动态可视化技术,也将有助于我们进一步深入研究脑微环境的结构、功能,包括记忆、情感等高级脑功能。
1 Blumling Iii JP,Silva GA.Targeting the brain: advances in drug delivery.Curr Pharm Biotechnol,2012,13(12):2417-2426.
2 Lonser RR,Sarntinoranont M,Morrison PF,et al.Convection-enhanced delivery to the central nervous system.J Neurosurg,2014 Nov 14:1-10. [Epub ahead of print]
3 Iliff JJ,Wang M,Liao Y,et al.A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β.Sci Transl Med,2012,4(147):147ra111.
4 韩鸿宾.应用磁共振成像技术定量测量活体大鼠脑细胞外间隙的扩散参数.北京大学学报(医学版),2012,44(5):770-775.
5 Han H,Li K,Yan J,et al.An in vivo study with an MRI tracer method reveals the biophysical properties of interstitial fluid in the rat brain.Sci China Life Sci,2012,55(9):782-787.
6 Han H,Shi C,Fu Y,et al.A novel MRI tracer-based method for measuring water diffusion in the extracellular space of the rat brain.IEEE J Biomed Health Inform,2014,18(3):978-983.
7 Abbott NJ.Evidence for bulk flow of brain interstitial fluid: significance for physiology and pathology.Neurochem Int,2004,45(4):545-552.
8 Han H,Xia Z,Chen H,et al.Simple diffusion delivery via brain interstitial route for the treatment of cerebral ischemia.Sci China Life Sci,2011,54(3):235-239.
9 Hopkins AM,Desimone E,Chwalek K,et al.3D in vitro modeling of the central nervous system.Prog Neurobiol,2014 Nov 22.pii: S0301-0082(14)00123-3.
10 Sykova E,Nicholson C.Diffusion in brain extracellular space.Physiol Rev,2008,88(4):1277-1340.
11 Tsurugizawa T,Ciobanu L,Le Bihan D.Water diffusion in brain cortex closely tracks underlying neuronal activity.Proc Natl Acad Sci U S A,2013,110(28):11636-11641.
12 Xie L,Kang H,Xu Q,et al.Sleep drives metabolite clearance from the adult brain.Science,2013,342(6156):373-377.
13 Sykova E,Mazel T,Simonova Z.Diffusion constraints and neuron-glia interaction during aging.Exp Gerontol,1998,33(7-8):837-851.
14 Nielsen S,Nagelhus EA,Amiry-Moghaddam M,et al.Specialized membrane domains for water transport in glial cells:high-resolution immunogold cytochemistry of aquaporin-4 in rat brain.J Neurosci,1997,17(1):171-180.
15 Dietzel I,Heinemann U,Hofmeier G,et al.Stimulus-induced changes in extracellular Na+ and Cl- concentration in relation to changes in the size of the extracellular space.Exp Brain Res,1982,46(1):73-84.
16 Nicholson C.Dynamics of the brain cell microenvironment.Neurosci Res Program Bull,1980,18(2):175-322.
17 Rusakov DA,Kullmann DM.Geometric and viscous components of the tortuosity of the extracellular space in the brain.Proc Natl Acad Sci U S A,1998,95(15):8975-8980.
18 Bignami A,Asher R.Some observations on the localization of hyaluronic acid in adult,newborn and embryonal rat brain.Int J Dev Neurosci,1992,10(1):45-57.
19 Nicholson C,Phillips JM.Ion diffusion modified by tortuosity and volume fraction in the extracellular microenvironment of the rat cerebellum.J Physiol,1981,321:225-257.
20 Gurevicius K,Gureviciene I,Valjakka A,et al.Enhanced cortical and hippocampal neuronal excitability in mice deficient in the extracellular matrix glycoprotein tenascin-R.Mol Cell Neurosci,2004,25(3):515-523.
21 Fisher M,Feuerstein G,Howells DW,et al.Update of the stroke therapy academic industry roundtable preclinical recommendations.Stroke,2009,40(6):2244-2250.
(修回日期:2015-01-26)
(责任编辑:王惠群)
Establishment of a Rat Model of Drug Distribution and Clearance for Brain Localized Delivery
ZuoLong*,LeiYiming,YanJunhao,etal.
*DepartmentofRadiology,PekingUniversityThirdHospital,Beijing100191,China
HanHongbin,E-mail:hanhongbin@bjmu.edu.cn
Objective To explore the drainage process of brain interstitial fluid (ISF) and transport property in interstitial space (ISS) in rat deep brain tissue by tracer-based magnetic resonance imaging (MRI). On the basis of classical diffusion equation in porous media, to establish distribution and clearance model for local drug administration of brain. Methods A total of 24 Sprague Dawley rats were randomly divided into three groups according to the injection points: caudate putamen (CPu), thalamus (T), and substantia nigra (SN), with 8 rats in each group. The brain ISF was traced with a MRI contrast agent, 2 μl gadolinium diethylenetriaminepentaacetic acid (Gd-DTPA), which was injected into the brain ISS. Three-dimensional dynamic distribution of the probes was displayed and quantitative calculations were completed by self-developed image processing software. The distribution ratio referring tracers’ maximum volume of the whole brain (Vdmax%) and the half-life time (t1/2) were obtained. ISS microscopic diffusion parameter (D*), clearance rate (k’), and local tortuosity (λ) were measured based on classical diffusion equation. Hence, we established pharmacokinetics model of the brain ISS. Results The transport distribution area and clearance rates of tracer molecule varied in ISS of different brain regions. TheVdmax% andt1/2of the caudate putamen were greater than those of the thalamus and substantia nigra (P=0.000). TheD*in substantia nigra was less than that in caudate putamen and thalamus (P=0.021), deriving the greatestλin substantia nigra (P=0.280). Thek’ in thalamus was greater than that in caudate putamen and substantia nigra (P=0.000). Conclusions Drug distribution in the brain ISS is partitioned, with drug distribution and clearance rates varying within each sub-region. Topical brain anatomy in each brain partition and fluid flow parameter characteristics of partitioned ISS should be considered in local brain delivery.
Brain interstitial fluid; Interstitial space; Tracer; Water diffusion
国家自然科学基金应急管理项目(61450004);国家自然科学基金重大研究培育项目(91330103)
R-332
A
1009-6604(2015)04-0360-06
10.3969/j.issn.1009-6604.2015.04.023
2014-12-29)
**通讯作者,E-mail:hanhongbin@bjmu.edu.cn
① (北京大学信息科学技术学院,北京 100871)
② (北京大学医学部基础医学院,北京 100191)
③ (北京应用物理与计算数学研究所,北京 100088)
④ (北京大学医药卫生分析中心,北京 100191)
⑤ (北京大学药学院,北京 100191)
