HIF-1α、ET-1和ADM在低压低氧性肺动脉高压大鼠肺血管的表达及意义
2015-03-11徐娇阳是文辉李建瑛刘江伟桂俊豪余伍忠
徐娇阳,是文辉,付 勇,李建瑛,刘江伟,桂俊豪,余伍忠*
(1.石河子大学医学院;2.兰州军区乌鲁木齐总医院 a.临床医学研究所 b.动物实验科 c.病理科,新疆 乌鲁木齐 830000)
HIF-1α、ET-1和ADM在低压低氧性肺动脉高压大鼠肺血管的表达及意义
徐娇阳1,2a,是文辉2b,付勇2c,李建瑛2b,刘江伟2b,桂俊豪2a*,余伍忠1,2a*
(1.石河子大学医学院;2.兰州军区乌鲁木齐总医院 a.临床医学研究所 b.动物实验科 c.病理科,新疆 乌鲁木齐 830000)
摘要:目的模拟6,000米海拔高度,建立低压低氧性肺动脉高压(HPH)大鼠模型,研究HPH大鼠肺组织中低氧诱导因子-1α(HIF-1α)、内皮素-1(ET-1)和肾上腺髓质素(ADM)的表达及其变化规律。方法将120只SD大鼠随机分为五组,模拟6 000米海拔大气压和氧分压,分别进行低压低氧暴露4天、7天、10天、14天和21天处理,同时设相应时间点对照组(对照组所处海拔为900米),低压低氧暴露时间为24小时/天。于计划的暴露终点采集各组大鼠肺组织标本,HE染色后观察大鼠肺组织的病理学变化,免疫组化法检测肺组织中HIF-1α、ET-1和ADM的表达。结果低压低氧条件分别暴露10天、14天和21天后SD大鼠的平均肺动脉压(mPAP)及肺小动脉血管壁中层壁厚占外径比值(MT%)较同时点相应对照组显著升高(P<0.01);HPH大鼠肺组织中HIF-1α自低压低氧暴露4天后表达即增高,14天后下降,至21天时表达与对照组无显著差异;ET-1在低压低氧10天、14天和21天时其表达较对照组显著升高(P<0.05);ADM在低压低氧4天、7天和10天时表达增加,随后表达降低。结论HPH大鼠模型肺组织中HIF-1α、ET-1和ADM表达均呈正相关,三种因子可能共同参与了大鼠HPH发生与发展。
关键词:低压低氧;肺动脉高压;缺氧诱导因子-1α;内皮素-1;肾上腺髓质素
(ChinJLabDiagn,2015,19:1996)
低氧性肺动脉高压(Hypoxic Pulmonary Hypertension,HPH)以肺血管阻力及肺动脉压力增高为特征,是多种高原性心、肺疾病的病理基础。本研究通过模拟6 000米海拔低压低氧暴露,建立低压低氧性肺动脉高压大鼠模型,观察不同低压低氧暴露时点大鼠肺组织中低氧诱导因子-1α(HIF-1α)、内皮素-1(ET-1)和肾上腺髓质素(ADM)的表达变化规律及其相互关系,为进一步研究HPH的分子机制奠定基础。
1材料与方法
1.1实验动物与分组
6周龄清洁级SD雄性大鼠120只(体重为200±20 g),购自新疆医科大学实验动物中心。随机数字表法分为低氧4天、7天、10天、14天和21天组,每组12只。同时各组设常氧对照组。
1.2主要试剂与仪器
1.2.1试剂HIF-1α兔抗鼠多克隆抗体、ADM兔抗鼠多克隆抗体、兔IgG两步法免疫组化试剂盒(SV0002)及DAB显色试剂盒均购自武汉博士德生物有限公司;ET-1兔抗鼠多克隆抗体由北京博奥森生物公司提供。
1.2.2主要仪器西北特殊环境人工实验舱(兰州军区乌鲁木齐总医院)、多道生理记录仪及压力传感器(成都仪器设备有限公司)、光学显微镜(OLYMPUS公司)和千屏医学图文报告系统。
1.3动物模型的建立
1.3.1人工气候舱参数设定模拟海拔高度为6 000 m(相对氧浓度约为11.3%);降压速度5.0 m/s;新风量需求设定50 m3/h,使舱内压力达47.3 KPa;温度22℃;湿度23.4%RH。
1.3.2低压低氧处理将低压低氧暴露组SD大鼠置于人工气候舱内,运行时间为24 h/天,昼夜比12 h∶12 h,保证其水及饲料充足,低氧组大鼠每2天开舱半小时为其更换饲料、水以及垫料。同日龄对照组除低压低氧条件外,其他饲养条件均同低氧组。分别于相应时间点取出各组大鼠,进行相关指标的检测。
1.4HPH模型指标检测
1.4.1肺动脉压力检测各低压低氧组及相应对照组大鼠在出舱后立即进行肺动脉压力检测:大鼠经麻醉、固定后,气管插管行机械通气(呼吸频率60次/min,潮气量6 ml,呼吸比3∶2)。开胸后用7号针头在肺动脉根部1 cm处逆血流方向刺入肺动脉,针头另一端连接压力传感器及生理信号记录仪记录平均肺动脉压力(mPAP)。
1.4.2肺小动脉形态学检测大鼠经测压后处死,迅速切取大鼠左肺组织置10%多聚甲醛溶液固定一周,常规石蜡包埋切片及HE染色后光镜下观察肺小动脉变化情况。选取直径约为100 μm的肺小动脉,测定并计算肺小动脉中层壁厚/肺小动脉外径(MT%),作为衡量肺血管重塑的指标。
1.5肺组织HIF-1α、ET-1、ADM表达的检测
1.5.1免疫组化方法参照说明书,对大鼠肺组织标本进行常规石蜡包埋切片后,经过脱蜡至水,3%H2O2室温10 min灭活内源性酶,抗原热修复;滴加封闭液室温10 min,分别滴加HIF-1α抗体(工作浓度1∶50)、ADM抗体(工作浓度1∶100)以及ET-1抗体(工作浓度1∶250),4℃过夜,PBS洗5 min×3次;滴加聚合HRP标记抗兔IgG,37℃孵育30 min,PBS洗5 min×3次;经过DAB显色,苏木素复染,封片后显微镜下观察三种抗体的定位及表达。
1.5.2阳性对照及阴性对照以已知HIF-1α、ET-1和ADM抗体阳性的切片为阳性对照,PBS代替一抗作为阴性对照。
1.5.3结果判读采用单盲法进行阅片,细胞内出现棕黄色颗粒为阳性,随机观察10个视野进行计分,积分标准参考文献[1,2]并稍作修改,根据每个视野阳性细胞占全部细胞总数的比例:阳性细胞<1%(-),1%-33%(+),34%-64%(++),65%-100%(+++),分别记为0,1,2,3分;免疫染色强度分为:轻度着色(+),中度着色(++),深度着色(+++),分别记为1,2,3分;计算两者相加作为最终分级:1级(1-2分),2级(3-4分),3级(5-6分)。
1.6统计方法

2结果
2.1不同暴露时点大鼠肺动脉压(PAP)及肺血管形态的变化
2.1.1不同暴露时点大鼠肺动脉压(PAP)的比较低压低氧暴露10、14、21d组大鼠mPAP较同时点对照组显著升高(P<0.01);而低氧4d、7d组与相应对照组无显著差异(P>0.05)(图1)。

注:*P<0.01 vs对照组,▽P<0.01 vs 10 d组
2.1.2肺小动脉变化情况低压低氧暴露10d、14d、21d组大鼠MT%较相应对照组显著升高(P<0.05);而低氧4d、7d组与对照组差异无统计学意义(P>0.05)(图2)。光镜下可见:缺氧10d组大鼠肺小动脉中膜较对照组略有增厚;缺氧14d组及21d组大鼠肺组织局部实变,肺小动脉中膜平滑肌层显著增厚,管腔明显狭窄,其中21d组比14d组程度更加严重(图3)。
2.2大鼠肺组织中HIF-1α、ET-1和ADM的表达
2.2.1HIF-1α、ET-1和ADM表达的分布情况低氧组大鼠肺组织中HIF-1α、ET-1、ADM分级的总体分布情况与对照组均不相同(HIF-1α:Z=-5.633,P<0.01;ET-1:Z=-4.968,P<0.01;ADM:Z=-4.507,P<0.01。)其中,HIF-1α阳性表达部位位于肺动脉内皮细胞、肺血管平滑肌细胞及肺泡上皮细胞;ET-1阳性表达主要位于肺动脉内皮细胞、平滑肌细胞以及肺小血管,ADM阳性部位主要为肺内皮细胞和平滑肌细胞(图4)。
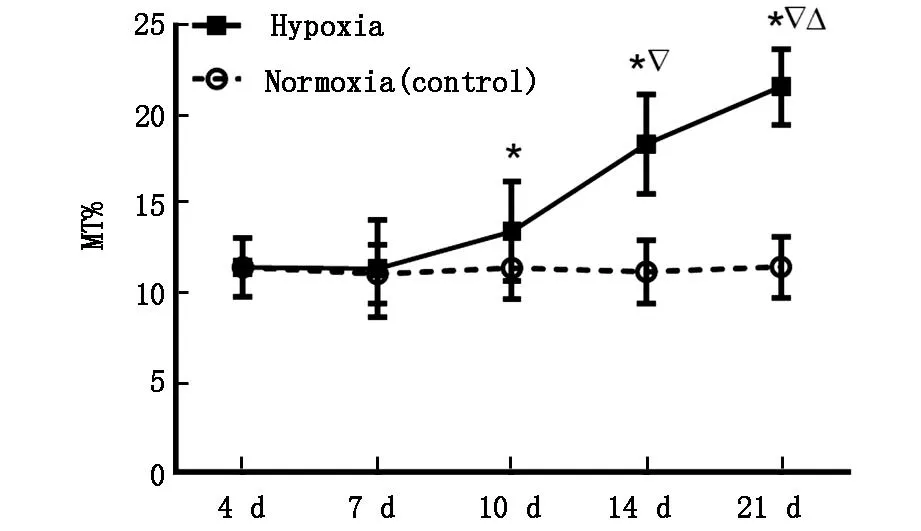
注:*P<0.05vs对照组,▽P<0.01vs10d组,ΔP<0.05vs14d组
图2不同低氧时间大鼠MT%变化情况

A:对照组;B:低压低氧10 d组;C:低压低氧21 d组(HE染色,×400)

A:低氧7 d组(HIF-1α);B:低氧14 d组(ET-1);C:低氧10 d组(ADM); D:对照组(HIF-1α);E:对照组(ET-1);F:对照组(ADM)
2.2.2HIF-1α、ET-1、ADM免疫组化分级情况根据免疫组化分级结果:HIF-1α在对照组大鼠基本呈阴性或弱阳性表达,低氧4天-10天表达明显增高,低氧14天表达稍有下降,随低氧时间延长至21天,表达与对照组无显著差异;ET-1在10天-21天低氧组大鼠表达较对照组明显增强;而ADM在低氧4、7、10天时表达增强,随后其表达与对照组无显著性差异,见表1-3。

表1 不同低氧时间大鼠肺HIF-1α表达分级情况的比较
注:各组各时点的样本均为12只大鼠,但低氧21天组2只大鼠死亡,n=10。下同

表2 不同低氧时间大鼠肺ET-1表达分级情况的比较

表3 不同低氧时间大鼠肺ADM表达分级情况的比较
2.3相关性分析
spearman相关分析显示:HIF-1α与mPAP及MT%正相关(r值分别为0.530、0.551,P值均<0.01),与ET-1和ADM亦呈正相关关系(r值分别为0.840、0.218,P值均<0.05);ET-1与mPAP及MT%正相关(r值分别为0.620、0.727,P值均<0.01);而ADM与mPAP及MT%均无相关关系(P>0.05),与ET-1亦无显著相关性(P>0.05)。
3讨论
低压低氧是诱发HPH的重要因素。一方面,低氧导致肺动脉平滑肌细胞肥大,管腔狭窄;另一方面,低氧诱发多种内源性因子分泌失调,进而导致持续性肺血管收缩,细胞外基质重建,肺血管管腔进一步被“锁定”在狭窄状态[3]。本研究通过模拟6000米海拔不同时程持续低压低氧建立大鼠HPH模型,结果显示,低氧10天mPAP即可升高,低氧14天mPAP达到高峰,提示模型建立成功;而大鼠肺组织HE染色结果显示,低氧后的大鼠肺小动脉中膜明显增厚,管腔狭窄,MT%在低氧10天时较对照组明显增加,并随低氧时间延长而增长,说明此时已形成了低氧性肺血管重建,并呈逐渐加重的趋势。
HPH发生的分子机制极其复杂。其中,HIF-1α是机体应对缺氧的核心调控因子,常氧状态下经泛素-蛋白酶体途径降解,因此体内表达量很低,在低氧状态下活化并进一步激活其下游靶基因转录,引发一系列的低氧应激反应,被称为是“低氧调节的总开关”[4]。本研究显示:HIF-1α在低氧4天大鼠中表达即较对照组明显升高,并且随后其表达的增长与mPAP及MT%呈正相关趋势,提示HIF-1α作为低氧的主要应答因子参与了HPH的病理生理过程,这与文献报道一致[5]。另外,ADM和ET-1是参与血压调控的重要因子[6],ET-1是由内皮细胞分泌的具有强烈缩血管效应的生物活性肽,能够引起血管内皮细胞、平滑肌细胞及成纤维细胞增殖和收缩[7],ADM则是ET-1的拮抗物质,具有舒血管作用,肺是其合成和代谢的主要场所;ADM主要由内皮细胞和平滑肌细胞分泌[8];正常情况下,缩血管肽和舒血管肽在体内处于动态平衡的状态,共同调控血管的舒缩功能;另一方面,二者均为HIF-1α的下游靶基因,在低氧状态下由HIF-1α诱导分泌增加,舒缩因子分泌失衡,进而导致HPH的发生与发展[9]。
以往研究表明[10]:内皮细胞中的HIF-1α是受氧浓度控制的最重要的调控因子,它调控着包括ET-1和ADM在内的数百种基因的表达,其中,ET-1和ADM在低氧时分别增长了1.9倍和4.2倍。Li等[11]研究发现,HIF-1α与ET-1之间可能形成了正反馈循环回路,进而能持续的促进平滑肌细胞收缩及增生,最终加剧了肺动脉高压的进程。本研究结果表明,ET-1在低压低氧10 d,14 d及21 d时表达较对照组升高,且与mPAP及MT%呈正相关趋势,提示其参与了HPH的形成过程,并在肺动脉高压及肺血管重塑过程中发挥作用,与Takahashi等[1]的研究结果相符合,且ET-1与HIF-1α的表达亦为正相关关系,这也间接验证了Li等[11]和Pisarcik等[12]的结果。作为HIF-1α的下游基因,ET-1通过与位于血管平滑肌细胞的特异性受体ETA结合,介导其收缩,并促进其增殖,参与肺血管重建;而ADM则通过旁分泌或自分泌的方式对肺血管平滑肌抑制其收缩及增殖,在HPH过程中发挥代偿作用[13]。我们发现,ADM在低氧4、7、10天时表达即有升高,而随低氧时间的延长,14天及21天时其表达又降低(与对照组无显著性差异),这可能是因为ADM是HPH的保护性因子,在低氧程度较轻时受HIF-1的调控表达上调,从而拮抗ET-1的缩血管作用,因此此时段mPAP较之对照组并未升高;当低氧时间延长,内皮细胞损伤随之增加,由于ADM主要是由肺组织内皮细胞分泌,肺组织内ADM水平进而逐渐减低。
综上,模拟海拔6000米高原环境大鼠在低氧14天时mPAP及MT%显著升高,此时肺组织内HIF-1α表达水平增高,并且其表达与ET-1、ADM的表达水平呈正相关;HIF-1α与ET-1均与mPAP、MT%呈正相关关系,藉此推测二者均促进了HPH的发生发展;而ADM的表达与HIF-1α正相关但与mPAP、MT%无相关关系,说明ADM的表达一定程度上受HIF-1α的调控,其在HPH早期表达增加,这可能是HPH前期发挥的代偿作用,即肺组织虽有一定程度缺氧但mPAP、MT%并未升高的原因之一。总之,HIF-1α作为低氧的调控因子参与了HPH的形成与发展,而其下游靶基因ET-1和ADM作为调节血管舒缩平衡的活性肽亦在此过程中发挥重要作用。
参考文献:
[1]Takahashi H,Soma S,Muramatsu M,et al.Upregulation of ET-1 and its receptors and remodeling in small pulmonary veins under hypoxic conditions[J].Am J Physiol Lung Cell Mol Physiol,2001,280(6):L1104.
[2]王建荣,周英,桑葵,等.缺氧性肺动脉高压新生大鼠肺血管重塑与肺血管HIF-1α、ET-1、iNOS表达的相关性研究[J].中国当代儿科杂志,2013(02):138.
[3]Ball M K,Waypa G B,Mungai P T,et al.Regulation of hypoxia-induced pulmonary hypertension by vascular smooth muscle hypoxia-inducible factor-1alpha[J].Am J Respir Crit Care Med,2014,189(3):314.
[4]Semenza GL.Hydroxylation of HIF-1:oxygen sensing at the molecular level[J].Physiology (Bethesda),2004.19:p.176.
[5]Lai YL,Law TC.Chronic hypoxia- and monocrotaline-induced elevation of hypoxia-inducible factor-1 alpha levels and pulmonary hypertension[J].J Biomed Sci,2004.11(3):315.
[6]Vogt S,Winkler E,Hermsen D,et al.Endothelin-1 and adrenomedullin plasma levels after exposure to fludrocortisone,dexamethasone,and spironolactone[J].Clin Exp Hypertens,2012,34(8):582.
[7]Van Hung T,Emoto N,Vignon-Zellweger N,et al.Inhibition of vascular endothelial growth factor receptor under hypoxia causes severe,human-like pulmonary arterial hypertension in mice:Potential roles of interleukin-6 and endothelin[J].Life Sci,2014,118(2):313.
[8]Fontes-Sousa A P,Pires A L,Carneiro C S,et al.Effects of adrenomedullin on systolic and diastolic myocardial function[J].Peptides,2009,30(4):796.
[9]Wang L,Zhou Y,Li M,et al.Expression of hypoxia-inducible factor-1alpha,endothelin-1 and adrenomedullin in newborn rats with hypoxia-induced pulmonary hypertension[J].Exp Ther Med,2014,8(1):335.
[10]Manalo D J,Rowan A,Lavoie T,et al.Transcriptional regulation of vascular endothelial cell responses to hypoxia by HIF-1[J].Blood,2005,105(2):659.
[11]Li M,Liu Y,Jin F,et al.Endothelin-1 induces hypoxia inducible factor 1alpha expression in pulmonary artery smooth muscle cells[J].FEBS Lett,2012,586(21):3888.
[12]Pisarcik S,Maylor J,Lu W,et al.Activation of hypoxia-inducible factor-1 in pulmonary arterial smooth muscle cells by endothelin-1[J].Am J Physiol Lung Cell Mol Physiol,2013,304(8):L549.
[13]徐平,戴爱国,周厚德,低氧性肺动脉高压大鼠肺内肾上腺髓质素及受体表达研究[J].中华结核和呼吸杂志,2002(8):20.
The expression and significance of HIF-1α,ET-1 and ADM in lung vessel of rats with hypobaric hypoxic-induced pulmonary hypertensionXUJiao-yang,SHIWen-hui,FUYong,etal.(ShiheziUniversitySchoolofMedicine,Urumqi830000,China)
Abstract:ObjectiveTo study the expression and variation of HIF-1α,ET-1 and ADM in lung tissue,by exposing rats to simulated 6000m altitude to establish hypobaric hypoxia-induced pulmonary hypertension (HPH) animal model.Methods120 SD rats were placed into a large artificial climate cabin (simulated 6000m altitude circumstance,24h/day) after they were randomly divided into hypoxic groups for 4 days,7 days,10 days,14 days,21 days and control groups(900m altitude above the sea level) of each corresponding time points;pulmonary tissue samples were analyzed by pathology images analyze software after HE staining;the expression of HIF-1α,ET-1and ADM in lung tissues were detected by immunohistochemistry.ResultsThe mPAP and MT% of SD rats of hypobaric hypoxic for 10 days,14 days,21 days groups were significantly higher than the corresponding control groups;the expression of HIF-1α in HPH rats were increased since hypoxic for 4 days,and were no significant difference compared with the control groups until hypoxic for 21 days after they were undergone a decrease in 14 days hypoxic group;the expression of ET-1 in hypoxic 10 days,14 days,21 days groups were increased significantly compared with the normoxia groups;while the expression of ADM was increased in hypoxic 4 days,7 days,10 days groups,then the expression undergone a reduction afterwards.ConclusionThe expression of HIF-1α in HPH rats lung tissues showed a positive correlation between that of ET-1 and ADM,and the three factors were involved in the occurrence and development of HPH rats.
Key words:Hypobaric hypoxia;Pulmonary hypertension;Hypoxia-inducible factor-1α;Endothelin-1;Adrenomedullin
(收稿日期:2014-08-25)
作者简介:徐娇阳(1989-),女,硕士研究生,研究方向:分子生物学检验诊断。
文献标识码:A
中图分类号:R544.1
文章编号:1007-4287(2015)12-1996-05
*通讯作者
基金项目:兰州军区医药卫生科研计划课题(CLZ12JA12);新疆自治区青年科技人才专项科研课题(2013QK016);医院博士返院后续课题(2013ZY001)
