脑红蛋白在脑梗死大鼠表达及丁苯酞干预效应
2015-03-11闫莹莹娄季宇白宏英杨霄鹏焦义明刘海燕
闫莹莹,娄季宇,白宏英,杨霄鹏,焦义明,乐 婷,刘海燕
脑红蛋白(neuroglobin,NGB)是Burmester 等[1]发现的主要表达于神经系统的第三类携氧珠蛋白,与氧有很高的亲和力,促进氧传递到线粒体,提高脑组织氧利用率。NGB 减少氧化应激诱导的ROS/RNS 过表达和脂质过氧化作用,抑制线粒体功能障碍、凋亡及细胞死亡[2]。降低NGB 表达会增加组织和细胞缺氧损伤程度,缺血/缺氧可启动NGB 对神经细胞的保护,从而为治疗脑卒中的候选药物。丁苯酞(NBP)具有明确抗脑缺血作用,但其具体的机制未完全明了。本文旨在研究NBP 是否调节脑缺血大鼠NGB 表达,减少氧化应激损伤,从而为NBP治疗脑梗死患者提供理论基础。
1 材料与方法
1.1 实验动物与分组 健康雄性SD 大鼠90只,体重280g~350 g,购自河南省实验动物中心(合格证号SCXK(豫)2010-0002)。随机分为假手术组、模型组、治疗组。每组按术后处死时间分为3 个亚组:1 d、3 d 和7 d,每亚组10 只。
1.2 药物和主要试剂 NBP 原料药由石药集团恩必普药业有限公司提供,批号518120502。以植物油制成浓度为32 mg/ml 溶剂用于动物灌胃。RT-PCR 试剂盒和Trizol 购自Transgen 公司,引物购自北京博大泰克公司;NGB 单克隆兔抗鼠抗体购自美国Sigma 公司;SOD、MDA 试剂盒购自南京建成生物工程研究所。图像采集使用德国Lecia 显微照像系统,图像分析系统为上海山富科学仪器有限公司(Biosens Digital Imaging System v1.6)。
1.3 方法
1.3.1 给药方法 治疗组于术后2 h 按80 mg/kg 丁苯酞植物油灌胃,假手术组和模型组予等量植物油灌胃,每天2 次。
1.3.2 实验动物模型建立 10%水合氯醛3 ml/kg 腹腔注射(ip)麻醉,仰卧位固定,颈部备皮,消毒,颈部正中切口,钝性分离各层组织,分离左侧颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA),结扎ECA 远心端,动脉夹夹闭CCA 及ICA,剪断ECA,沿ECA 残端向ICA 插入鱼线,进入长度约18 mm±0.5 mm 时,可感阻力,停止插线,ECA 残端结扎并固定鱼线。清理切口,逐层缝合。术后60W 白炽灯直接照射保持肛温37 ℃。假手术组只分离,不结扎,不插线。
采用Longa 等[3]制定的5 级神经功能缺损评分法对脑梗死大鼠术后3 h 和各时间点处死前行行为学评分。1 分以上为模型制作成功,选择评分在1~3 分大鼠为实验对象,剔除神经损伤太重或无损伤大鼠并予以补充。
1.3.3 标本采集及保存 每组大鼠于相应时间点处死,随机取5 只心脏灌注4%多聚甲醛后取脑,4%多聚甲醛固定24 h 后石蜡包埋保存。其余5只断头新鲜取脑,液氮迅速冷冻后移于-80℃冰箱保存。
1.3.4 RT-PCR 检测 NGB mRNA Trizol 一步法提取脑组织总RNA,用紫外分光光度计定量,取少量用于RNA 含量及纯度测定。总RNA 先用RNase H 处理后,用RT-PCR 试剂盒进行cDNA 的合成及PCR 反应。通过大鼠NGB cDNA 序列设计引物,如下:上游:5’-CCGCAGCCCTCTGGAACAT-3’;下游:5’-TGTAGAGCAGGGACTCACCTA-3’;扩增产物长度296 bp。以GAPDH 为内参照,引物序列为上游:5’-TATCGGACGCCTGGTTAC-3’;下游:5’-TGATGGCATGGACTGTGG-3’;扩增产物长度506 bp。PCR 反应条件:94 ℃预变性2 min,一个循环;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,共35 个循环,72 ℃总延伸6 min。PCR 扩增目的产物进行电泳并对目的条带用凝胶分析系统进行分析,对目的条带与内参GAPDH 的DNA 条带灰度值的比值进行相对含量计算。
1.3.5 免疫组化法检测NGB 表达 大鼠脑组织石蜡切片5 μm,二甲苯脱蜡,梯度酒精水化,PBS洗3 次,高压抗原修复5 min,自然冷却,PBS 冲洗3次,用二抗同源血清进行封闭,甩掉血清,滴加一抗50 μl,室温下孵育1 h;滴加二抗50 μl 室温孵育15 min,DBA 显色,苏木素复染,脱水,透明及封片。100 倍镜下观察,400 倍镜下计数阳性细胞数,同时采用图像分析系统进行分析。
1.3.6 化学比色法检测SOD 活性和MDA 含量 将新鲜脑组织用磷酸盐漂洗3 次,除去血液、滤纸拭干,精确称重后制备10%匀浆,3000 r/min 离心15 min,取上清液按测试盒说明书进行SOD 活性和MDA 含量检测。
1.4 统计学方法 采用SPSS 20.0 进行数据录入和处理,计量资料用 表示,多组间多时间点比较采用析因方差分析,进一步分析分组单独效应,方差齐时两两比较采用LSD 法,方差不齐时采用Dunnett’s T3 法,两独立样本比较采用t 检验,检验水准=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 神经功能缺损评分 除术后3 h 外,治疗组神经功能评分均低于模型组;不同时间点之间两组神经功能评分差异有统计学意义(P<0.05),术后3 h 评分开始增加,1 d 达峰,随后逐渐下降;分组和时间之间存在交互效应(P<0.05)(见表1)。
2.2 NGB mRNA 表达 不同组间NGB mRNA差异有统计学意义(P<0.05),模型组较假手术组高,治疗组较模型组高;不同时间点间NGB mRNA差异有统计学意义(P<0.05),假手术组各时间点NGB mRNA 差异不明显,模型组和治疗组NGB mRNA 表达随时间延长逐渐降低;分组和时间之间存在交互效应(P<0.05)(见表2、图1)。
2.3 NGB 蛋白表达 不同组间NGB 差异有统计学意义(P<0.05),模型组较假手术组高,治疗组较模型组高;不同时间点间NGB 差异有统计学意义(P<0.05),假手术组各时间点NGB 差异不明显,模型组和治疗组NGB 表达随时间延长逐渐下降;分组和时间之间存在交互效应(P<0.05)(见表3)。
2.4 SOD 活性、MDA 含量检测 不同组间SOD 活性和MDA 含量差异有统计学意义(P<0.05),SOD 活性模型组较假手术组低,治疗组较模型组高、较假手术组低;MDA 含量模型组较假手术组高,治疗组较模型组低、较假手术组高;不同时间点间SOD 活性和MDA 含量差异有统计学意义(P<0.05),假手术组各时间点SOD 活性和MDA 含量差异不明显,模型组和治疗组SOD 活性和MDA 含量表达均随时间延长逐渐下降;分组和时间之间存在交互效应(P<0.05)(见表4、表5)。
表1 各时间点模型组和治疗组神经功能评分比较(±s)

表1 各时间点模型组和治疗组神经功能评分比较(±s)
分组主效应:F 组间=26.947,P=0.000;时间主效应:F 时间=19.579,P=0.000;交互效应:F 交互=4.842,P=0.006。#表示与模型组比较,P<0.05
表2 各时间点3 组间NGB mRNA 表达比较(±s)
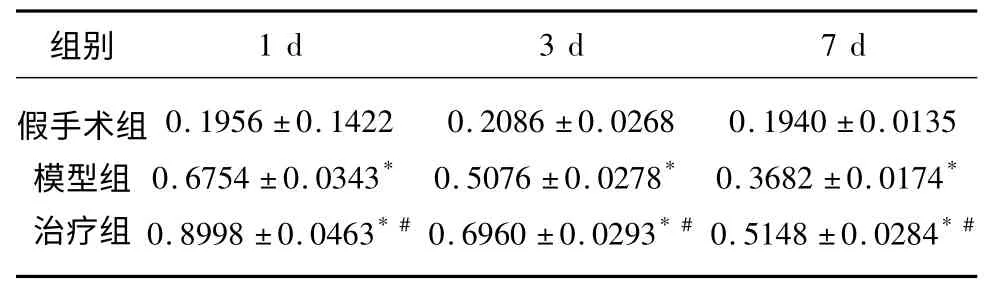
表2 各时间点3 组间NGB mRNA 表达比较(±s)
分组主效应:F 组间=1224.040,P=0.000;时间主效应:F 时间=252.000,P=0.000;交互效应:F 交互=64.980,P=0.000。* 表示与假手术组比较,P<0.05;#表示与模型组比较,P<0.05
表3 各时间点3 组间NGB 平均光密度值比较(±s)

表3 各时间点3 组间NGB 平均光密度值比较(±s)
分组主效应:F 组间=173.903,P=0.000;时间主效应:F 时间=25.374,P=0.000;交互效应:F 交互=12.352,P=0.000。* 表示与假手术组比较,P<0.05;#表示与模型组比较,P<0.05
表4 大鼠脑组织3 个时间点SOD 活性(U/mgpro)(±s)

表4 大鼠脑组织3 个时间点SOD 活性(U/mgpro)(±s)
分组主效应:F 组间=245.01,P=0.000;时间主效应:F 时间=20.059,P=0.000;交互效应:F 交互=9.405,P=0.000。* 表示与假手术组比较,P<0.05;#表示与模型组比较,P<0.05
表5 大鼠脑组织3 个时间点MDA 含量(mmol/mgpro)(±s)
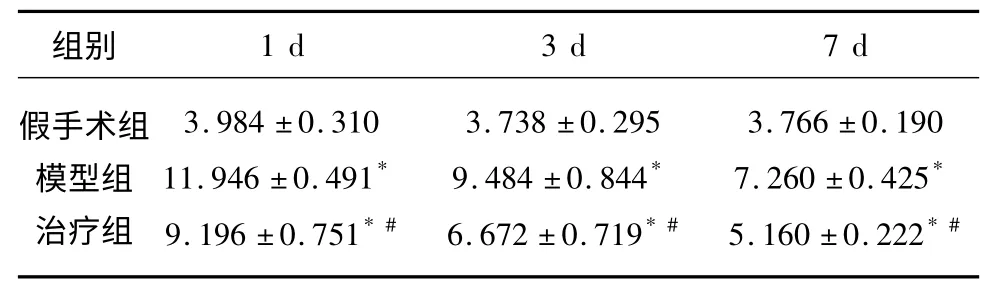
表5 大鼠脑组织3 个时间点MDA 含量(mmol/mgpro)(±s)
分组主效应:F 组间=448.833,P=0.000;时间主效应:F 时间=121.918,P=0.000;交互效应:F 交互=26.699,P=0.000。* 表示与假手术组比较,P<0.05;#表示与模型组比较,P<0.05
3 讨论
脑是机体代谢率最高的器官,缺血时造成细胞能量代谢紊乱,活性氧(Reactive oxygen species,ROS)产生过多,氧化应激损伤,在脑缺血后神经元损伤中起关键作用。如何改善脑梗死患者能量代谢和降低氧化应激损伤,成为科研和临床工作重点。NBP 是从芹菜种子中分离出的有效成分,又叫作芹菜甲素,可阻断缺血性脑卒中所致损伤的多个病理环节,具有较强抗脑缺血作用。明显缩小大鼠局部脑缺血梗死面积,减轻水肿,改善能量代谢和缺血区微循环和血流量,抑制神经细胞凋亡,以及抗脑血栓形成和抗血小板聚集等药理作用[4]。
NGB 是继血红蛋白和肌红蛋白之后发现的携氧珠蛋白,主要表达在脊椎动物神经系统和视网膜细胞中[5]。目前研究揭示了NGB 作为内生性神经保护因子,在脑梗死和其他神经系统疾病中起作用,关于其机制进行了很多研究。Li 等[6]离体研究证实NGB 通过PTEN-AKT 通路促进轴突再生。Khan等[7]研究认为NGB 通过抑制膜死亡传导信号复合体形成来保护神经元免受NMDA 和β 淀粉样蛋白毒性作用。Li 等[8]认为NGB 具有抗氧化特性,减少氧化应激损伤。本实验结果显示NGB 主要在神经元表达,神经胶质细胞也有少量表达,与既往研究结果相符。模型组较假手术组、治疗组较模型组NGB 表达增高,提示脑缺血时机体启动了内生性保护因子,减少急性应激损伤。而且丁苯酞可上调NGB 表达减少脑缺血损伤。试验中NGB 表达随时间呈下降趋势,提示其表达已于24h 内达到高峰,即缺血引起NGB 上调已达最大程度。如果刺激持续存在,神经细胞缺血缺氧亦进一步加重并超出自身代偿能力,NGB 表达降低,使细胞供氧进一步下降,缺氧情况急剧恶化,细胞功能丧失并走向死亡。
在脑梗死病理生理中,氧化应激占有重要地位。ROS 过量产生不仅引起脂质、蛋白和DNA 等重要细胞成分氧化,也改变脑梗死中重要信号通路,最终引起细胞损伤和死亡[2]。脑缺血时细胞受自由基攻击引发链式脂质过氧化反应,形成大量脂质过氧化物,其中以MDA 毒性最大,间接反映机体细胞受自由基攻击严重程度。SOD 是机体清除氧自由基,阻断自由基病理性连锁反应最重要的防御酶,其活性测定作为清除氧自由基能力主要指标。实验结果显示,模型组较假手术组脑组织中MDA 含量显著升高,SOD 活性显著降低,表明脑缺血诱发了脑组织氧化应激损伤。随着时间变化,MDA 含量逐渐减少,SOD 活性逐渐升高,可能与ROS 作为机体内抗氧化应激系统信号分子,上调SOD 表达,调控其自身水平有关[9],启动脑内代偿机制。治疗组较模型组MDA 含量下降,SOD 活性升高。提示NBP 可提高脑梗死大鼠SOD 活性,降低MDA 含量。其可以对抗自由基,拮抗过氧化损伤,可能与抑制黄嘌呤-黄嘌呤氧化酶反应系统中超氧阴离子自由基形成有关。Burmester 等[10]认为NGB 有提供氧气和减少ROS 损伤作用,Watanabe 等[11]研究认为NGB 通过抑制氧化应激引起的cAMP 浓度下降,保护损伤细胞。NBP 可能也通过上调NGB 表达,间接减少氧化应激损伤,发挥对缺血性神经元保护作用。
综上所述,NBP 对缺血大鼠脑损伤有保护作用,机制可能为上调缺血脑组织NGB 表达,提高SOD 活性,增加氧供,改善能量代谢,促进自由基清除,对抗脂质过氧化损伤,进而降低MDA 含量,稳定细胞膜,改善脑组织病理变化,提高神经元对缺血缺氧耐受性。这可能为NBP 治疗脑梗死提供一些理论依据。但NBP 如何上调MCAO 大鼠脑组织中NGB 表达,减少氧化应激损伤需要体外细胞培养进一步研究。

图1 不同时间点不同组NGB mRNA 表达比较
[1]Burmestern T,Weich B,Reinhardt S,et al.A vertebrate globin express in the brain[J].Nature,2000,407:520-523.
[2]Richard CL,Shang ZL,Seung KL,et al.Neuroglobin protects neurons against oxidative stress in globin ischemia[J].J Cerebral Blood Flow& Metabolism,2010,30:1874-1882.
[3]Zea Longa EL,Weisnstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[4]端木寅,王 源,梁 爽,等.丁苯酞脑缺血治疗作用的相关药理学研究进展[J].中药药理与临床,2012,28(3):126-129.
[5]De Marinis E,Marino M,Ascenzi P.Neuroglobin,estrogens,and neuroprotection[J].IUBMB Life,2011,63(3):140-145.
[6]Li L,Liu QR,Xiong XX,et al.Neuroglobin proments outgrowth via differential binding to PTEN and AKT[J].Mol Neurobiol,2014,49:149-162.
[7]Khan AA,Mao XO,Banwait S,et al.Neuroglobin attenuates betaamyloid neuro toxicity in vitro and transgenic Alzheimer phenotype in vivo[J].Proc Natl Acad Sci,2007,104(48):19114-19119.
[8]Li RC,Morris MW,Lee SK,et al.Neuroglobin protects PC12 cells against oxidative stress[J].Brain Res,2008,1190(23):159-166.
[9]Yu ZY,Poppe JL,Wang XY.Mitochondrial mechanisms of neuroglobin’s neuroprotection[J].Oxidative Medicine and Cellular Longevity,2013,Article ID 756989,11pages,http://dx.doi.org/10.1155/2013/756989.
[10]Burmester T,Hankeln T.What is the function of neuroglobin[J].Exp Biol,2009,212:1423-1428.
[11]Watanabe S,Takahashi N,Uchida H,et al.Human neuroglobin functions as an oxidative stress-responsive sensor for neuroprotection[J].J Biol Chem,2012,287(36):30128-30138.
