总前列腺特异性抗原定量测定试剂盒(化学发光免疫分析法)的性能验证
2015-03-10方婉仙李志雄董志宁吴英松
方婉仙 李志雄 董志宁 李 明 吴英松★
总前列腺特异性抗原定量测定试剂盒(化学发光免疫分析法)的性能验证
方婉仙1李志雄1董志宁1李明2吴英松2★
[摘要]目的对自制的总前列腺特异性抗原(total prostate specific antigen,tPSA)定量测定试剂盒(化学发光免疫分析法)进行性能验证,判断自制试剂盒是否满足产品行业标准要求。方法参照产品行业标准要求,对自制试剂盒的准确度、最低检测限、线性、重复性、批间差、稳定性、配对抗体等克分子反应性进行考察。结果自制试剂盒的最低检测限为0.0022 ng/mL,线性相关系数r=0.9998,重复性为2.82%和1.96%,批间差为5.55%,配对抗体等克分子反应小于15%,均符合产品标准的要求。对刚过12个月有效期的产品进行以上项目检测,也符合产品标准要求,说明效期内试剂质量稳定。结论自制试剂盒的各项性能指标符合行业标准要求,在线性、最低检测限和检测范围方面比临床常用的罗氏tPSA电化学发光试剂盒更优,可替代国外昂贵试剂应用于临床检测。
[关键词]总前列腺特异性抗原(tPSA);化学发光免疫分析法(CLIA);性能验证
作者单位:1.广州市达瑞生物技术股份有限公司,广东,广州510665 2.南方医科大学生物技术学院,广东,广州510515
The verification of the performance of total prostate specific antigen (tPSA) quantitative diagnostic kit (chemiluminescent immunoassay)
FANG Wanxian1, LI Zhixiong1, DONG Zhining1, LI Ming2, WU Yingsong2★
(1. Darui Biotechnology Co., Ltd., Guangzhou, Guangdong, China, 510665; 2. School of Biotechnology, Southern Medical University, Guangzhou, Guangdong, China, 510515)
[ABSTRACT]ObjectiveTo verify the performance of total prostate specific antigen (tPSA) quantitative diagnostic kit (CLIA) in order to know whether the kit is fit for industrial standard.Methods Refering to tPSA quantitative diagnostic kit (CLIA) industrial standard, the kit accuracy, sensitivity, linearity, repeatability, precision between different assays, stability and equal gram molecular reaction of matching antibodies were studied. ResultsThe sensitivity of the kit was 0.0022 ng/mL.The linear coefficient (r) was 0.9998.Repeatability were 2.82% and 1.96%.And the precision between different assays was 5.55%.Equal gram molecular reaction of matching antibodies was less than 15%. All results were in line with the requirements of industrial standard. The same analysis was performed with the kits which were one month over the expiration date and all the analysis results were in line with industrial standard.ConclusionAll analytic performance results of the kit meet industrial standard.The detection index of linearity, detection limit, detection range are better than that of the tPSA kit from Roche, which can replace foreign expensive reagent for clinical testing and basic medical researh.
[KEY WORDS]Total prostate specific antigen (tPSA); Chemiluminescent immunoassay(CLIA); Performance verification
当前,人口老龄化日益加剧,前列腺疾病患者数量不断增长,其中前列腺癌已成为严重危害人类健康的主要疾病之一[1],如何及时正确诊断该类疾病是目前临床与医药科学研究的热点。前列腺特异性抗原(prostate specific antigen,PSA)是一种含有237个氨基酸、侧链含有7%~8%碳水化合物且具有糜蛋白酶样活性的丝氨酸蛋白酶,其分子量约为30 000道尔顿。在正常、存在良性增生和恶性前列腺组织的男性血清中均可以检测出PSA,但在没有前列腺组织(如:由于根治性前列腺切除术或膀胱前列腺切除术)的男性血清或大多数女性血清中不能检测出PSA。故PSA成为监视前列腺癌男性病人的合适标志。研究表明[2-3]总前列腺特异性抗原(total prostate specific antigen,tPSA)是诊断前列腺疾病特异性最强的血清学指标。而PSA在监测患者术后或药物治疗后前列腺癌转移或病情迁延也有重要价值。目前,我国大部分大医院用进口化学发光法试剂盒进行测定,如罗氏、雅培、西门子等外国公司[4-5]的试剂,但价格昂贵,患者负担沉重。本研究应用磁珠为载体,采用双抗体夹心免疫分析法将高灵敏度的化学发光体系和高特异性的免疫反应结合,配合国产全自动化学发光仪,定量测定人血清或血浆中的tPSA含量[6]。该分析体系稳定可靠,成功实现化学发光tPSA体外诊断试剂的国产化,在临床上辅助诊断及监测前列腺癌等方面具有很高的应用价值。
1 材料与方法
1.1材料与试剂
检测试剂:总前列腺特异性抗原定量测定试剂盒(化学发光免疫分析法),广州市达瑞生物技术股份有限公司制备。校准品:总前列腺特异性抗原校准品,广州市达瑞生物技术股份有限公司制备。质控品:Lyphochek Tumor Marker Plus Control,来源于Bio-Rad公司。溯源性参考物质:世界卫生组织tPSA国际标准品,来源于英国国家生物标准与检定所。游离PSA:世界卫生组织游离前列腺特异性抗原(free prostate specific antigen,fPSA)国际标准品,来源于英国国家生物标准与检定所。
1.2仪器
全自动化学发光免疫分析仪,型号:Caris200,来源于厦门优迈科医学仪器有限公司。
1.3参考法规及标准
行业标准:《总前列腺特异性抗原(tPSA)定量测定试剂(盒)(化学发光免疫分析法)YY/T 1163-2009》。
1.4实验方法
1.4.1试剂盒定标与质量控制
试剂盒在使用前均需要用校准品进行标准曲线定标,同时测定第三方Bio-Rad质控品进行质量控制。
1.4.2准确度
以浓度为40 ng/mL国际标准品tPSA(NIBSC code:96/670)作为样本检测5次,测得的平均浓度记为M,根据公式测量偏差=(M-理论值)/理论值×100%,行业标准要求其测量结果相对偏差应在±10%范围内。
1.4.3最低检测限
用零浓度校准品作为样本进行检测,重复测定20次,得出20次测量结果的RLU(relative light unit)值,计算其平均值(mean,M)和标准差(standard deviation,SD),得出M+2SD,根据零浓度校准品和相邻校准品之间的浓度-相对发光值(relative light unit,RLU)值结果进行两点回归拟合得出一次方程,将M+2SD的RLU值带入上述方程中,得到的最低检测限,行业标准要求结果应不高于0.1 ng/mL。
1.4.4线性
将浓度为100ng/mL的高值样本按一定比例稀释为5个浓度,其中低值浓度样本须接近线性范围下限。每一浓度样本重复测试2次,计算其平均值,通过四参数拟合线性,行业标准要求试剂盒的相关系数(correlation coefficient,r)应不低于0.9900。
1.4.5重复性
用浓度分别为4 ng/mL±0.8 ng/mL和30 ng/mL±6 ng/mL的样本各重复检测10次,计算10次测量结果的平均值M和标准差SD,根据公式CV=SD/M均值有限公得出其变异系数(variable coefficient,CV),行业标准要求应不大于10.0%。
1.4.6批间差
用3个不同批号试剂盒检测同一样本30 ng/mL±6 ng/mL范围内的样本,重复检测10次,计算30次测量结果的M和SD,根据公式CV=SD/M×100%得出CV,3个批号试剂盒之间的批间CV应符合行业标准要求,不大于15.0%。
1.4.7稳定性
在2℃~8℃条件下,保存至有效期后1个月,按照1.4.2~1.4.6的方法进行检测,结果需符合相应要求。
1.4.8配对抗体的等克分子反应性
配制tPSA浓度为10.0 ng/mL而fPSA比例不同的系列样本(见表1),分别平行测定各样本的浓度,取测定结果平均值记为M,根据公式:测量偏差=(M-理论值)/理论值×100%,其测量结果的相对偏差应符合行业标准要求,在±15%范围内。

表1 等克分子反应性样本配制表Table 1 Sample preparation of equal gram molecular reaction
2 结果
2.1试剂盒定标与质量控制
第三方质控测量结果均在质控所标示的范围内(见表2),实验准确可靠。
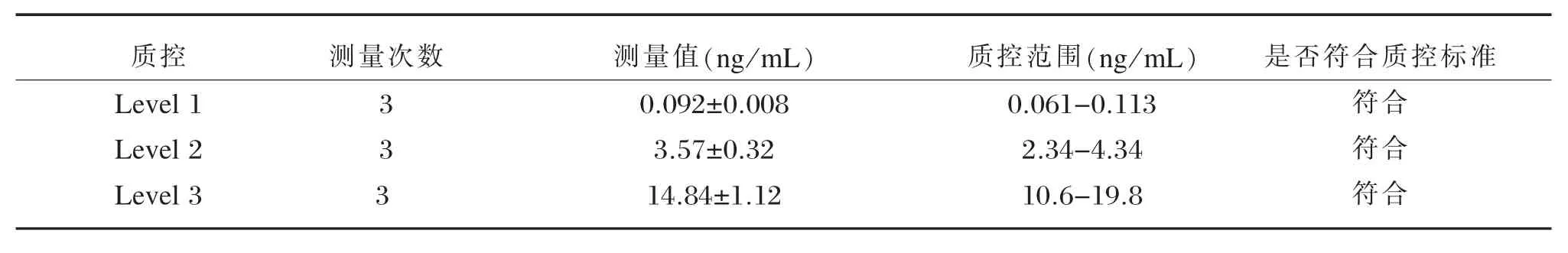
表2 Lyphochek Tumor Marker Plus Control测量结果Table 2 Measurement results of Lyphochek Tumor Marker Plus Control
2.2准确度
试剂盒对稀释成40.0ng/mL的tPSA国际标准品进行检测,其相对标准偏差为3.85%,试剂盒准确度良好(见表3)。

表3 准确度测量结果(x±s)Table 3 Measurement results of accuracy(x±s)
2.3最低检测限
试剂盒对tPSA零浓度标准品检测,其最低检出量为0.0022 ng/mL,远远低于标准规定的0.1 ng/mL(见表4)。

表4 最低检测限检测结果(x±s)Table 4 Measurement results of sensitivity(x±s)
2.4线性
将稀释好的5个浓度样本进行检测,将测量结果通过四参数拟合线性,线性方程为Y=(63.75-732488053.74)/(1+(X/28037.19)0.88)+732488053.74,其相关系数r为0.9998,线性良好(见表5和图1)。

表5 tPSA线性检测结果Table 5 Measurement results of linearity of tPSA
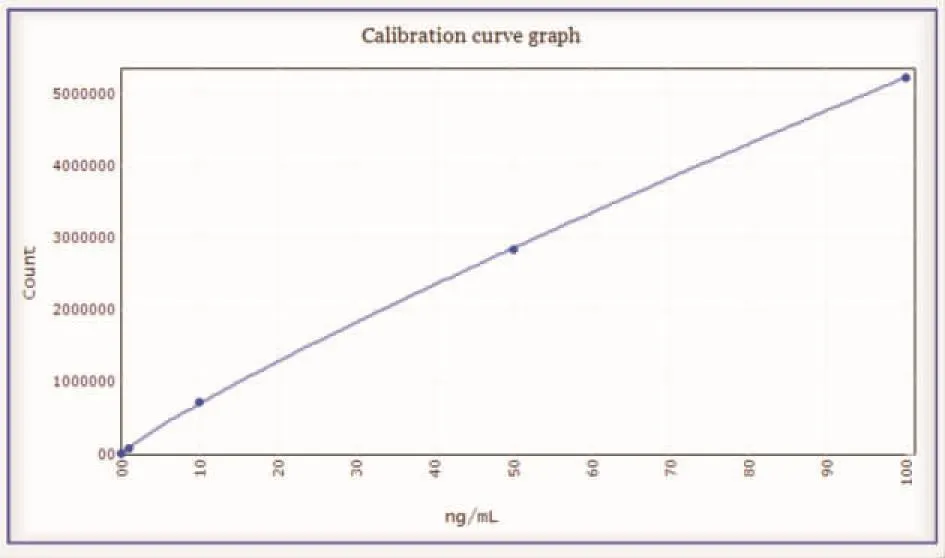
图1 tPSA线性拟合Figure 1 linear fitting of tPSA
2.5重复性
浓度分别为4 ng/mL±0.8 ng/mL和30 ng/mL±6ng/mL的样本,其变异系数CV%分别为2.82%和1.96%,均不大于10.0%(见表6)。
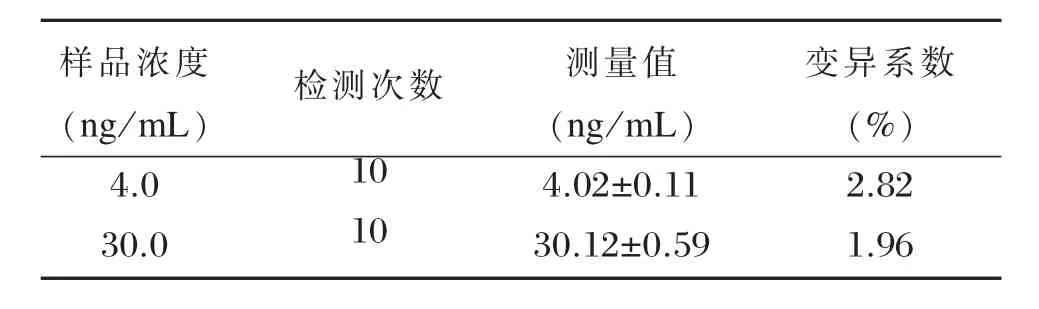
表6 重复性检测结果(x±s)Table 6 Measurement results of repeatability(x±s)
2.6批间差
用3个批次试剂盒测定30 ng/mL±6 ng/mL范围内的样本,其变异系数CV%为5.55%,符合标准要求(见表7)。

表7 批间差检测结果(x±s)Table 7 Measurement results of precision between different assays(x±s)
2.7稳定性
结果显示,所有项目均符合标准要求,说明在1个月有效期内,检测性能未发生变化,线性关系良好,且标准品A点发光值未见明显升高(见表8)。
2.8配对抗体的等克分子反应性
试剂盒检测根据表1配制tPSA浓度为10.0 ng/mL而fPSA比例不同的系列样本,其测量结果均在±15%范围内(见表9)。
3 讨论
试剂盒性能的好坏直接关系到试剂盒的临床使用性能。本研究着重验证自制的总前列腺特异性抗原定量测定试剂盒(化学发光免疫分析法)的分析性能。自制试剂盒用吖啶酯作为标记物,其化学反应简单、快速、无须催化剂;非特异性结合少,本底低;与大分子的结合不会减小所产生的光量,从而增加灵敏度。实验结果中充分体现这一特点,试剂盒其最低检测限为0.0022 ng/mL,结果非常突出,灵敏度和精确度比酶免法、荧光法高几个数量级,可替代放射免疫分析。与国内外市场占有率较高的罗氏tPSA试剂盒进行比对,罗氏tPSA试剂盒最低检测限为0.003 ng/mL,自制试剂盒灵敏度更高。自制试剂盒准确度良好,检测结果相对标准偏差为3.85%,在线性范围为0.1 ng/mL~100 ng/mL内相关系数r为0.9998,而罗氏tPSA试剂盒在0.1 ng/mL~50 ng/mL内相关系数r为0.898,自制试剂盒线性更优。自制试剂盒检测范围为0.0022 ng/mL~100 ng/mL,比罗氏tPSA试剂盒检测范围0.003 ng/mL~100 ng/mL略广。配对抗体的等克分子反应性检测表明试剂盒对PSA和PSA-ACT的识别是等量的。对过期1个月的试剂盒进行检测,试剂盒的性能仍然符合标准要求,试剂盒的稳定性较好。相对于罗氏tPSA试剂昂贵的价格,自制试剂盒价格便宜,能更好地在临床应用中降低医疗成本,减轻患者负担,提高医疗服务质量。
目前,全国批准上市的国产tPSA检测试剂盒种有16种,进口同类型tPSA检测试剂盒有7种,tPSA试剂盒检测方法也不尽相同,其中有放射免疫分析法、酶联免疫吸附法、时间分辨荧光免疫分析法、胶乳增强免疫比浊法、流式荧光免疫法、胶体金法、微磁粒分离酶联免疫法等,其中接近30%的试剂盒应用酶联免疫吸附法,但都存在某些缺点,如荧光背景突光、荧光淬灭、放射性废物、灵敏度不佳、测定范围有限、标记物稳定性差等[7-8]。而化学发光免疫分析技术将具有高灵敏度的化学发光测定技术与高特异性的免疫反应相结合,已经成为一种成熟的、先进的超微量活性物质检测技术,应用范围广泛,近10年发展迅猛,是目前发展和推广应用最快的免疫分析方法,也是目前最先进的标记免疫测定技术,主要具有灵敏度高、特异性强、试剂价格低廉、试剂稳定且有效期(6个月~18个月)、方法稳定快速、检测范围宽、操作简单自动化程度高等优点[9-10],受到广大科研工作者和临床分析工作者的青睐,显示了该技术将在现在及未来的免疫分析检测领域极其重要的作用。
综上所述,自制的总前列腺特异性抗原定量测定试剂盒(化学发光免疫分析法)各项性能均远远超出《总前列腺特异性抗原(tPSA)定量测定试剂(盒)(化学发光免疫分析法)YY/T 1163-2009》规定的要求,具有非常好的分析性能,与目前临床广为应用的进口试剂盒罗氏tPSA试剂盒在线性、检测限和检测范围更优,自制试剂盒所需样本量少、操作流程简单、无放射性危害、成本较进口试剂盒经济,因此能更好地满足临床检测的需要,并对tPSA检测的应用推广、国产化,并打破国外试剂的垄断具有重要意义。

表8 有效期后一个月的试剂盒分析性能评估的结果总结Table 8 Summarizes the results of performance of the kits which were one month over the expiration date

表9 配对抗体的等克分子反应性(x±s)Table 9 Measurement results of equal gram molecular reaction of matching antibodies(x±s)
参考文献
[1]韩苏军, 张思维, 陈万青,等. 中国前列腺癌发病现状和流行趋势分析[J]. 临床肿瘤学杂志, 2013,18(4):330-334.
[2]张汉东, 富晓敏. 前列腺特异性抗原的临床应用价值 [J]. 医学理论与实践, 2014,27(12):1648-1649.
[3]Yeniyol CO, Bozkaya G, Cavusoglu A, et al.The relation of prostate biospy and ration of free to tatol PSA in patients with a total PSA between 4-20 ng/ml [J]. Int Urol Nephrol, 2001,33:503-506.
[4]徐元基, 凌世淦, 刘荷中,等. 前列腺特异性抗原EIA试剂盒的研制及应用 [J]. 细胞与分子免疫学杂志,2000,16(4):360-362.
[5]唐望清. 国内体外诊断行业分析及DS 公司营销策略研究[D]. 上海:上海交通大学, 2008.
[6]金茂俊, 邵华,金芬,等. 化学发光免疫分析方法的研究及应用[J]. 农产品质量与安全, 2012,(2):42-46.
[7]杨晓达,常文保,慈云祥. 免疫分析法进展[J]. 化学进展, 1995,7(2):83-97.
[8]赵启仁,王世真. 时间分辨突光免疫分析及其应用前景[J]. 国际放射医学核医学分册, 1992,16(4):182-188.
[9]陈海斌. 化学发光免疫分析技术及其进展[J]. 中国医学装备, 2011, 8(5):56-59.
[10]金茂俊,俊邵,华金芬,等. 化学发光免疫分析方法的研究及应用[J]. 农产品质量与安全, 2012,(2):42-46.
通讯作者:★吴英松,E-mail:yingsongwu@hotmail.com
基金项目:国家高技术研究发展计划(863计划)2011AA02A101
