硫酸脱氢表雄酮化学发光微粒子免疫法定量测定试剂的研制
2015-03-10黄明聪张晓琍林光华翁祖星孙旭东葛胜祥
黄明聪 张晓琍 林光华 翁祖星 孙旭东 葛胜祥 张 军★
硫酸脱氢表雄酮化学发光微粒子免疫法定量测定试剂的研制
黄明聪1张晓琍2林光华2翁祖星1孙旭东1葛胜祥3张军3★
[摘要]目的研制硫酸脱氢表雄酮化学发光免疫定量检测试剂。方法利用硫酸脱氢表雄酮人工完全抗原免疫小鼠,通过杂交瘤技术制备特异性抗硫酸脱氢表雄酮单克隆抗体,采用竞争抑制法建立硫酸脱氢表雄酮化学发光免疫定量检测试剂。结果筛选获得了27株稳定分泌抗硫酸脱氢表雄酮的单克隆抗体细胞株,建立了化学发光微粒子免疫法定量测定硫酸脱氢表雄酮的试剂盒雏形,与雅培公司的硫酸脱氢表雄酮定量检测试剂在检测临床标本上的相关系数r达0.99以上。结论本研究为国产化硫酸脱氢表雄酮化学发光微粒子免疫法定量测定试剂盒的研发奠定了基础。
[关键词]硫酸脱氢表雄酮;化学发光微粒子免疫法;定量试剂盒
作者单位:1.厦门万泰凯瑞生物技术有限公司,福建,厦门361022 2.福建医科大学附属协和医院检验科,福建,福州350001 3.厦门大学国家传染病诊断试剂与疫苗工程技术研究中心,福建,厦门361102
注:黄明聪和张晓琍为并列第一作者
Development of chemiluminescent microparticle immunoassay for quantitative determination of dehydroepiandrosterone sulfate
HUANG Mingcong1, ZHANG Xiaoli2, LIN Guanghua2, WENG Zuxing1, SUN Xudong1, GE Shengxiang3, ZHANG Jun3★
(1. Xiamen Innodx Biotech Co., Ltd, Xiamen, Fujian, China, 361022; 2. Clinical Laboratory Department, Fujian Medical University Union Hospital, Fuzhou, Fujian, China, 350001; 3. National Institute of Diagnostics and Vaccine Development in Infectious Disease, Xiamen University,Xiamen, Fujian, China, 361102)
[ABSTRACT]Objective To develop chemiluminescent microparticle immunoassay for quantitative determination of dehydroepiandrosterone sulfate. Methods Mice were immunized by dehydroepiandrosterone sulfate artificial complete antigen.Monoclonal antibodies against dehydroepiandrosterone sulfate were prepared by hybridoma technique.Chemiluminescent microparticle immunoassay for quantitative determination of dehydroepiandrosterone sulfate was developed based on competitive binding method.Results27 monoclonal antibodies were obtained. Chemiluminescent microparticle immunoassay for quantitative determination of dehydroepiandrosterone sulfate prototype kit was established. The coefficient r of testing specimens with reagent from Abbott company was over 0.99. Conclusion Development of domestic chemiluminescent microparticle immunoassay for quantitative determination of dehydroepiandrosterone sulfate reagent was laid foundation by this study.
[KEY WORDS]Dehydroepiandrosterone sulfate; Chemiluminescent microparticle immunoassay; Quantitative determination kit
硫酸脱氢表雄酮(dehydroepiandrosterone sulfate,DHEAs)是脱氢表雄酮(dehydroepiandrosterone,DHEA)的硫酸酯形式,是一种主要由肾上腺皮质分泌的甾醇类激素[1-2]。作为雄性激素和雌性激素的前体,DHEAs是人体中含量最丰富的甾醇类物质,在人血清中的含量比DHEA高250~500倍,比睾酮高100~500倍,比雌二醇高1 000~10 000倍[3-4]。循环血液中的DHEAs并不具备雄性和雌性激素的生物学活性,运送到靶组织后经脱硫酸化生成DHEA,进而转变为不同的雄性和雌性激素化合物,发挥生物学功能。在临床上,DHEAs的定量检测常用于多毛症、女性男性化及多囊性卵巢综合症的辅助诊断,当发生肾上腺肿瘤时DHEAs的水平也会异常升高[5-6]。
DHEAs的定量检测方法主要有液相色谱-质谱联用法和免疫检测法[7-8]。液相色谱-质谱法由于其样品前处理复杂,仪器昂贵,耗时长,其应用受到限制。免疫学检测方法包括放射免疫法、酶联免疫法和化学发光微粒子免疫法(chemiluminescent microparticle immunoassay,CLIA)。其中CLIA灵敏度高、线性范围宽、再现性好、易于实现自动化和高通量检测,已逐渐成为临床检测中的主流方法。目前,国内只有罗氏、雅培、西门子和贝克曼等国外大公司的DHEAs CLIA定量检测试剂上市,价格昂贵,研制国产化的DHEAs化学发光免疫定量检测试剂十分必要。
1 材料与方法
1.1材料
1.1.1试剂
人工完全抗原DHEAs-BSA、DHEAs-OVA由本实验室自行合成,弗氏完全佐剂、弗氏不完全佐剂购自Sigma公司,吖啶酯来自于厦门大学。
1.1.2临床血清标本
临床血清标本来源于厦门大学。
1.1.3仪器
Berthold Sirius单管式化学发光检测仪为德国Berthold Technologies公司产品;PHOMO全自动酶标仪为安图生物公司产品。
1.1.4实验细胞、动物
骨髓瘤细胞Sp2/0-Ag14由本实验室保存;Balb/c小鼠和F1小鼠均购自上海斯莱克实验动物有限责任公司。
1.1.5耗材
细胞培养板购自美国Thermo Nunc公司;96孔酶标板购自厦门怡佳美实验器材有限公司;细胞冻存管为德国Greiner公司产品;磁微粒Dynabeads M-270购自美国Lifetechnologies公司。
1.2方法
1.2.1小鼠免疫
取6~8周龄的Balb/c小鼠,人工完全抗原DHEAs-BSA和佐剂乳化后皮下注射小鼠,初次免疫注射100 μg抗原,加强免疫注射50 μg抗原,免疫间隔周期为3w,加强免疫3针后,眼眶后静脉丛采血4~6滴,分离血清后检测血清效价,取效价高的小鼠进行脾脏免疫。
1.2.2单克隆抗体的筛选
小鼠脾脏免疫72 h后取脾脏细胞与骨髓瘤细胞融合,融合5 d~7 d后换液,间接酶联免疫吸附试验和间接竞争酶联免疫吸附试验筛选阳性克隆,采用有限稀释法进行杂交瘤细胞的克隆化。
1.2.3单克隆抗体的制备
取F1小鼠,向腹腔中注射0.5 mL的液体石蜡油;3 d后,向腹腔中注射对数生长期的杂交瘤细胞约1×106个;7 d~14 d后,抽取腹水,离心取上清。上清经饱和硫酸铵沉淀后用Protein A亲和层析柱纯化单克隆抗体。
1.2.4磁珠包被
磁微粒用MEST(10 mmol/L MES,pH 6.0,0.05%Tween 20)洗涤2次后加入新配制的EDC活化30 min,用MEST洗涤2次;加入抗体或抗原,37℃反应3 h;用MEST洗涤5次,用含2%酪蛋白的磷酸盐缓冲液重悬后于4℃保存。
1.2.5吖啶酯标记
取50 μg抗原或抗体加入到600 μL 0.1 mol/L 的PBS(pH 8.0)中,加入5 μL 1 mmol/L吖啶酯,混匀,室温避光反应1 h;加赖氨酸溶液反应15 min,然后4℃透析至20 mmol/L pH 6.5的PBS中12 h。
1.2.6间接竞争酶联免疫吸附试验
包被:包被抗原用20 mmol/L的CBS(pH 9.6)稀释至2 μg/mL,每孔加100 μL,37℃恒温箱中放置2 h。封闭:取出酶标板,用PBST(20 mmol/L PBS,pH 6.0,0.1%Triton-X100)洗1遍。每孔加入180 μL封闭液,37℃恒温箱中放置2 h。弃去封闭液,将板拍干。加样:加入梯度稀释的血清或细胞上清和梯度稀释的DHEAs各50 μL,混匀后于37℃恒温箱中孵育30 min,PBST清洗5遍。加酶标二抗:每孔加入酶标二抗100 μL,于37℃恒温箱中孵育30 min,PBST清洗5遍。显色:将混合后加100 μL于孔中,37℃恒温箱中孵育15 min。终止并读值:2 mol/L硫酸终止反应,用酶标仪读值。
1.2.7管式化学发光免疫分析实验
1.2.7.1竞争模式一向微孔板中依次加入包被DHEAs-BSA的磁微粒50 μL、梯度稀释的DHEAs 20 μL和按1∶500稀释的吖啶酯标记DHEAs单克隆抗体50 μL,水浴37℃反应25 min;用PBST(20 mmol/L PBS,pH 6.0,0.1%Triton-X100)洗4遍;将反应孔中的磁微粒转移至反应杯中,用单管式化学发光检测仪检测发光值。
1.2.7.2竞争模式二向微孔板中依次加入50 μL包被DHEAs单克隆抗体的磁微粒,20 μL梯度稀释的DHEAs,50 μL按1∶500稀释的吖啶酯标记DHEAs-BSA,水浴37℃反应25 min;用PBST(20 mmol/L PBS,pH 6.0,0.1%Triton-X100)洗4遍;将反应孔中的磁微粒转移至反应杯中,用单管式化学发光检测仪检测发光值。
1.2.7.3DHEA对DHEAs定量检测的干扰向微孔板中依次加入50 μL包被DHEAs单克隆抗体的磁微粒,分别加入20 μL同等浓度的DHEAs、DHEA及DHEAs和DEHA的混合物,50 μL按1∶500稀释的吖啶酯标记DHEAs-BSA,水浴37℃反应25 min;用PBST(20 mmol/L PBS,pH 6.0,0.1% Triton-X100)洗4遍;将反应孔中的磁微粒转移至反应杯中,用单管式化学发光检测仪检测发光值。
2 结果
2.1 DHEAs单克隆抗体的制备
2.1.1小鼠免疫和单克隆抗体筛选小鼠加强免疫3针后,血清效价达1∶2×105以上,间接竞争ELISA的结果显示免疫血清中存在DHEAs和DHEA特异性抗体(图1)。选择效价高的小鼠取脾脏与骨髓瘤细胞融合并进行单克隆抗体的筛选。
结合间接ELISA和间接竞争ELISA筛选DHEAs特异性抗体,获得了27株稳定分泌抗DHEAs抗体的杂交瘤细胞。
2.1.2单抗性质鉴定
27株DHEAs单克隆抗体的效价均在1:1×105以上,均特异性识别DHEAs,不与氢化可的松、甲羟孕酮、β-雌二醇发生交叉反应,但能结合DHEA(图2)。其中2D1、3C4两株单抗对DHEAs的亲和力明显高于对DHEA的亲和力,选择这2株单抗作为试剂建立的原料。
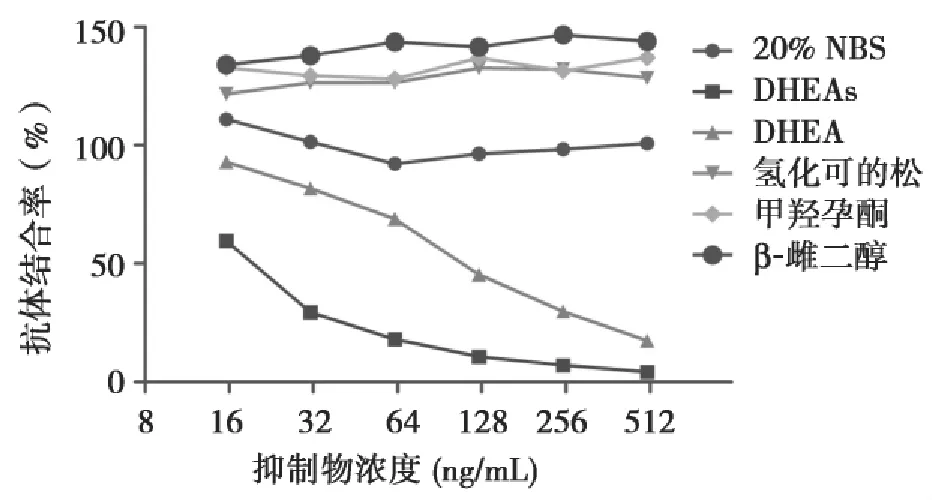
图2 DHEAs单克隆抗体的竞争抑制性Figure 2 Competitive inhibition ability of DHEAs Mabs
2.2 DHEAs化学发光免疫定量测定法的建立
2.2.1竞争模式的选择
分别用DHEAs-BSA抗原和DHEAs单克隆抗体包被磁微粒,并用吖啶酯标记DHEAs-BSA抗原和DHEAs单克隆抗体,以竞争抑制法建立DHEAs的化学发光免疫测定方法,检测系列稀释的DHEAs。用双对数法拟合剂量反应曲线,结果显示2种竞争模式的定量检测结果与样品稀释倍数均有较好的线性相关,但标记抗体的斜率更优(表1)。

表1 标记抗体或抗原模式所建立的CLIA检测系列稀释样品的线性方程Table 1 Linear equation of CLIA test series diluted sample based on antibody or antigen labeled pattern
2.2.2DHEA对DHEAs定量检测的干扰
在同等浓度下,抗体对DHEAs显示出更高的亲和力(图3),当DHEAs和DHEA以同等浓度存在时,DHEA并不影响抗体与DHEAs的结合,加上生理条件下DHEAs的浓度是DHEA的250~500倍[3-4],因此检测临床标本时,DHEA对DHEAs定量检测影响很小。

图3 DHEA对检测的干扰Figure 3 Interference of DHEA on detection
2.2.3与国际主流同类产品的初步比较
选取35份不同背景值的临床血清标本,分别用Abbott DHEAs定量测定试剂盒和本研究建立的DHEAs CLIA法定量测定试剂检测DHEAs的含量,结果显示本研究建立的试剂盒与Abbott的试剂盒在检测临床血清标本上相关性良好,相关系数r在0.99以上(图4)。

图4 临床血清标本检测相关性评价Figure 4 Correlation of measuring specimens
3 讨论
决定化学发光免疫定量测定试剂性能的参数主要有检测灵敏度、线性范围、特异性等。对于小分子半抗原的免疫定量检测试剂,特异性是影响其检测准确性的一个重要因素。DHEAs是小分子半抗原物质,外周血中存在着许多结构类似的甾醇类激素化合物,此外还有DHEA在化学结构上与其只相差一个磺酸基,因此,难以获得DHEAs高特异性抗体。本研究中筛选获得的单克隆抗体均能特异性地识别DHEAs,与β-雌二醇、甲羟孕酮、氢化可的松这三种甾醇类激素均无交叉反应,且部分抗体对DHEAs的亲和力明显高于DHEA,选用此类抗体使得DHEA对DHEAs的定量检测影响很小。并且在人血清中DHEAs的含量比DHEA 高250~500倍[3-4]。因此本研究中建立的DHEAs CLIA定量检测试剂虽然对DHEA有一定的交叉反应,但其对临床标本的检测影响很小。
本研究筛选获得了DHEAs特异性的单克隆抗体,建立了DHEAs化学发光微粒子免疫检测法定量检测雏形试剂盒,初步评价特异性和定量准确性良好。
参考文献
[1]Van Voorhees EE, Dennis MF, Calhoun PS, et al. Association of DHEA, DHEAS, and cortisol with childhood trauma exposure and posttraumatic stress disorder[J]. International Clinical Psychopharmacology, 2014, 29(1):56.
[2]Van Voorhees EE, Dennis MF, McClernon FJ, et al. The association of dehydroepiandrosterone (DHEA) and DHEA sulfate (DHEAS) with anxiety sensitivity and electronic diary negative affect among smokers with and without posttraumatic stress disorder[J]. Journal of Clinical Psychopharmacology, 2013,33(4):556.
[3]S覬eborg T, Frederiksen H, Fruekilde P, et al. Serum concentrations of DHEA, DHEAS, 17α-hydroxyprogesterone,Δ4-androstenedione and testosterone in children determined by TurboFlow-LC-MS/MS[J]. Clinica Chimica Acta, 2013,419:95-101.
[4]Urbanski HF, Mattison JA, Roth GS, et al. Dehydroepiandrosterone sulfate (DHEAS) as an endocrine marker of aging in calorie restriction studies[J]. Experimental Gerontology, 2013,48(10):1136-1139.
[5]Goodarzi MO, Carmina E, Azziz R. DHEA, DHEAS and PCOS[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2015,145:213-225.
[6]Jiménez MC, Sun Q, Schürks M, et al. Low dehydroepiandrosterone sulfate is associated with increased risk of ischemic stroke among women[J]. Stroke, 2013, 44(7):1784-1789.
[7]Azziz R, Chang WY, Stanczyk FZ, et al. Effect of bilateral oophorectomy on adrenocortical function in women with polycystic ovary syndrome[J]. Fertility and Sterility, 2013,99(2):599-604.
[8]Hildreth KL, Gozansky WS, Jankowski CM, et al. Association of serum dehydroepiandrosterone sulfate and cognition in older adults: Sex steroid, inflammatory, and metabolic mechanisms[J]. Neuropsychology, 2013, 27(3): 356.
通讯作者:★张军,E-mail:zhangj@xmu.edu.cn
基金项目:国家高技术研究发展计划(863计划)(2011AA02A101)
