化学发光免疫分析法研究进展
2015-03-10陆龙飞葛胜祥
陆龙飞 葛胜祥 张 军
化学发光免疫分析法研究进展
陆龙飞葛胜祥张军★
[摘要]化学发光免疫分析法(chemiluminescence immunoassay,CLIA)是一种高灵敏度高特异性的检测分析技术,具有广泛的应用领域。本文简要介绍了化学发光免疫分析法的分类、发展和应用,重点从实际应用的角度阐述了化学发光在解决低丰度低信噪比、多组分检测、高速自动化等方面的发展情况,以及简要介绍了新型材料、试剂和技术应用于化学发光体系的进展,并对化学发光免疫分析法的发展趋势进行了展望。
[关键词]化学发光免疫分析;多组分检测;流动注射分析;量子点;微流控芯片
作者单位:厦门大学国家传染病诊断试剂与疫苗工程技术研究中心,福建,厦门361102
Review on the development of chemiluminescence immunoassay
LU Longfei, GE Shengxiang, ZHANG Jun★
(National Institute of Diagnostics and Vaccine Development in Infectious Diseases, Xiamen University,Xiamen, Fujian, China, 361102)
[ABSTRACT] Chemiluminescence immunoassay (CLIA) was a widely used technology attribute to its high sensitivity and specificity. The classification, recent advances and the application of chemiluminescence immunoassay were reviewed. This review was focused on the advances of chemiluminescence immunoassay in practical application, especially in improving the signal-to-noise ratio of low abundance samples, multianalyte detection, rapid and automatic detection. In addition, the advances of new materials, reagents and technologies applied in chemiluminescence immunoassay were briefly reviewed.And the development trend of chemiluminescence immunoassay was prospected.
[KEY WORDS] Chemiluminescence immunoassay; Multi-analyte detection; Flow injection analysis; Quantum dot; Microfluidics
1978年Halman等成功建立化学发光免疫分析法(chemiluminescence immunoassay,CLIA)以来,该方法大致经历了4个阶段的发展[1],相继应用了大量新的材料、技术、工艺和仪器而日趋完善和普及。化学发光免疫分析法是将具有高灵敏度的化学发光测定技术与高特异性的免疫反应相结合的检测分析技术,通过激发化学发光剂进入激发态再回到稳定态并发射光子的过程,将免疫反应信号转化为光信号,进而利用光信号测量仪器测定发光强度,发光强度因与待测物质浓度在一定条件下呈线性定量关系,从而确定待测物质浓度。
1 化学发光免疫分析的分类
根据化学发光所用的标记物和发光原理的不同,一般可分为3类:直接化学发光免疫分析、酶促化学发光免疫分析和电化学发光免疫分析。不同于前两者,电化学发光由电启动电极表面的电化学发光剂发生电化学反应产生光信号,常需要共反应剂提高发光效率,如三丙胺(tripropylamine,TPA)作为三联吡啶钌([Rb(bpy)3]2+)的电子供体共反应剂。常用的发光体系有:吖啶酯类、鲁米诺类(luminol)、三联吡啶钌类、过氧化草酸酯类(TCPO、DNPO)和强氧化剂高锰酸钾、Ce(SO4)2等(见表1)。有些发光剂与氧化剂反应缓慢,还需要催化剂和增强剂的作用,提高发光强度和稳定性。
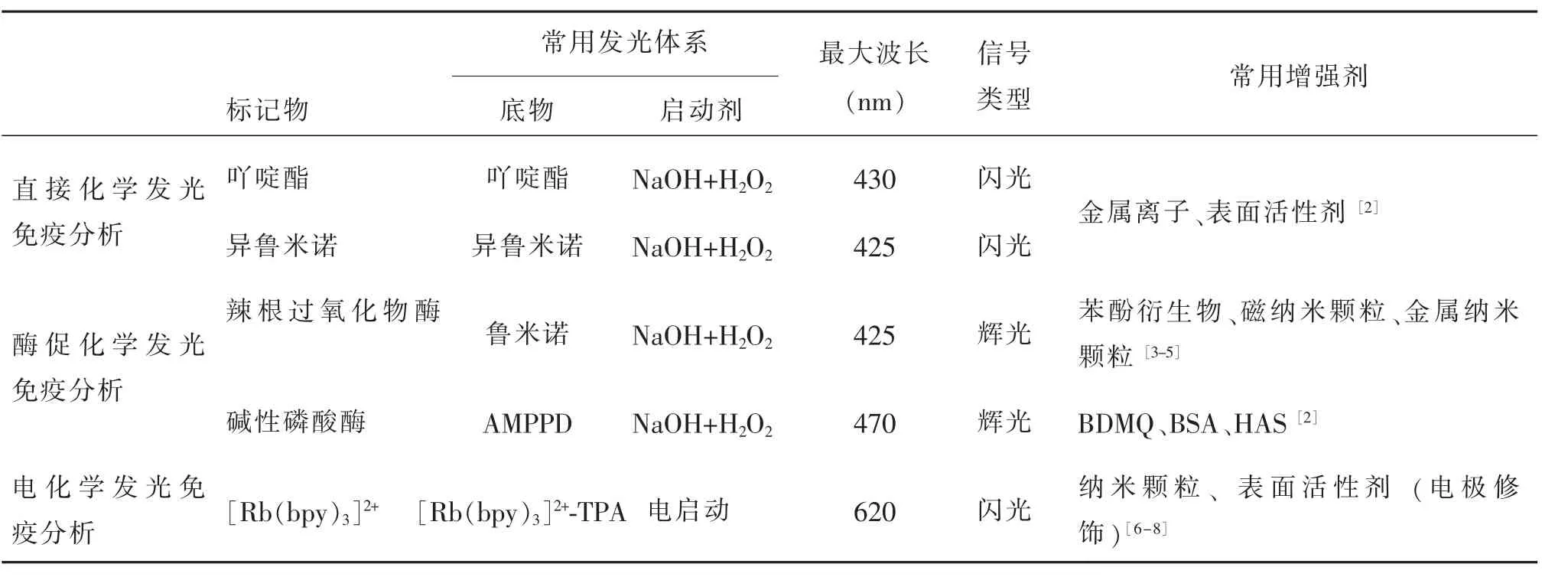
表1 化学发光免疫分析的分类和常用体系Table 1 Classification of chemiluminescence immunoassay and systems in common use
2 化学发光免疫分析的发展方向
近年来,随着化学发光免疫分析在各个领域的应用,对其各方面要求和需求也发生了改变,在应用了大量新技术、新材料的基础上,化学发光免疫分析法呈现出高灵敏度、高通量和自动化的发展趋势。
2.1高灵敏度检测
实际应用中常涉及到样品丰度低、信噪比低、稳定性差和信号干扰等的问题。为解决化学发光免疫分析的实用性,需要提高其灵敏度和稳定性:一方面降低信号噪音,减少非特异性反应信号和信号干扰;另一方面增强光信号,提高信噪比和稳定性。
化学发光免疫分析系统的信号噪音和信号干扰的因素主要是发光体系缺陷和原料试剂特异性的影响。为改善发光体系缺陷,研发新的发光剂、增强剂、发光体系等[5,9]以及对于反应时间、孵育时间、缓冲液的选择和标记抗体浓度等细节进行优化[10-11],都是减少信号噪音干扰的影响因素,也是人们长期研究的目标。原料试剂中,基因工程抗原由于表达系统、标签融合蛋白的不同而导致修饰折叠的差异,往往对重组抗原的特异性和灵敏度带来很大影响。单克隆抗体(monoclonal antibody,Mab)具有很强的免疫反应特异性,围绕Mab的改造,减少无关结构,提高特异性和活性的研究日益增多,如嵌合抗体、小分子抗体、噬菌体抗体和胞内抗体等。因此,如何表达筛选获得高特异性和高灵敏度的抗原抗体[12-13]成为人们研究的重点之一。此外采用多种重组抗原或抗体联检[14-15]往往也能起到很好的效果。
除了减少信噪和干扰外,如何增强发光信号提高稳定性一直是化学发光研究的重点,新型纳米材料如纳米金、碳纳米管CNT、碳纳米球CNSs、碳纳米纤维以及量子点等联用到CLIA中,大大提高了CLIA的信号强度和稳定性。电化学发光免疫分析中电极表面是电化学反应的关键场所,电极表面的修饰对于电化学发光具有重要作用,对此人们开展了大量电极修饰的研究,特别是新型纳米材料、表面活性剂等[6-8]对于电化学发光影响的研究。近些年,透明电极如氧化铟锡(indium tinoxide,ITO)电极与光导纤维技术的结合减少了干扰且更为简便,具有很好的应用前景。Chen[6]用覆盖了一层含氟表面活性剂的4 nm的金纳米颗粒(GNPs)去修饰ITO电极,形成了FSO-GNP-ITO修饰电极,大大改善了ITO电极用于ECLIA时TPA氧化率低和ITO表面不稳定的问题,提高了发光的稳定性和灵敏度。
量子点QDs具有尺寸可调的光学特性和高荧光量子产率,是生物荧光标记物的理想光学材料。但是量子点化学发光也存在着自身的缺点,比如QDs-ECL需要高发光电位,发光强度低等问题。通过改造量子点比如核壳结构量子点、掺杂型量子点和单质量子点等[16-18],修饰和改善QDs-ECL体系的发光信号强度和灵敏度,取得了很好的效果。Guo等[19]建立了一个表面用石墨烯(G)-CdS QDs-琼脂糖复合材料修饰的玻璃碳电极(glass carbon electrode,GCE)的CdS QDs-ECL系统,以戊二醛(glutaric dialdehyde,GLD)为交联剂结合抗体,检测甲种胎儿球蛋白,石墨烯能大大提高CdS QDs-ECL的检测下限和灵敏度。
2.2多项目联合检测
在临床应用中,常常需要对复杂体系的未知样本进行多组分的测定或者多种指标的检测,实现对于多组分的检测可以大大提高检测分析的准确性和可靠性,减少检测分析时间和繁琐的人工操作,是免疫分析研究的一个重要方向。一般静态多组分同时检测主要有2种模式:多标记物分辨技术和空间分辨技术。
多标记物分辨技术以不同的标记物标记不同的免疫活性物质,再通过识别不同的标记信号来检测不同的组分。Qian[20]以兔免疫球蛋白抗原(IgG)和癌胚抗原(carcino-embryonic,CEA)为模型蛋白,将水溶性量子点材料CdS和PbS分别包裹到SiO2纳米颗粒上作为探针标记到IgG和CEA抗体上,形成”三明治”探针Si/Cd/anti-IgG 和Si/Pb/anti-CEA,经夹心法免疫反应后,再以方波伏安法(square wave voltammetry,SWV)在-0.57V和-0.81V电压下分别检测探针信号,实现了多标记物的同时检测。多色量子点用于CLIA的多组分检测是另外一种形式的“多标记物”分辨技术,多色荧光探针具有一元激发多元发射的优点,能同时标记和跟踪多个生物分子事件。Goldman等[21]构建了ZnS-CdSe核壳结构的多色量子点标记抗体,用夹心免疫法在4种不同波长下检测4种毒素的混合物,显示多色量子点能够完成一般有机染料难以完成的同时多组分检测。但是由于多种信号的重叠交叉干扰,多标记物模式不可避免地涉及到最优分析的妥协。
空间分辨技术是通过在不同的区域空间发生免疫反应,再利用阵列检测器光电倍增管(photomultiplier tube,PMT)、电荷耦合元件(charge-coupled device,CCD)等同时测定大量样品。Fu[22]设计的双通道流通池,通道Ⅰ标记肿瘤标志物CA153 和CA125抗体,通道Ⅱ标记CA199和CEA抗体,同时检测4种肿瘤标志物(图1)。其将碱性磷酸酶(alkaline phosphatase,ALP)和辣根过氧化物(horseradish peroxidase,HRP)标记到2个通道的抗体上,再向两个通道分别加入相应的底物发光剂(S1和S2)催化两个通道的化学发光(chemiluminescence,CL)反应。当用光电倍增管PMT收集其中一个信号时,采取移动光栅来遮蔽其他通道进行收集。
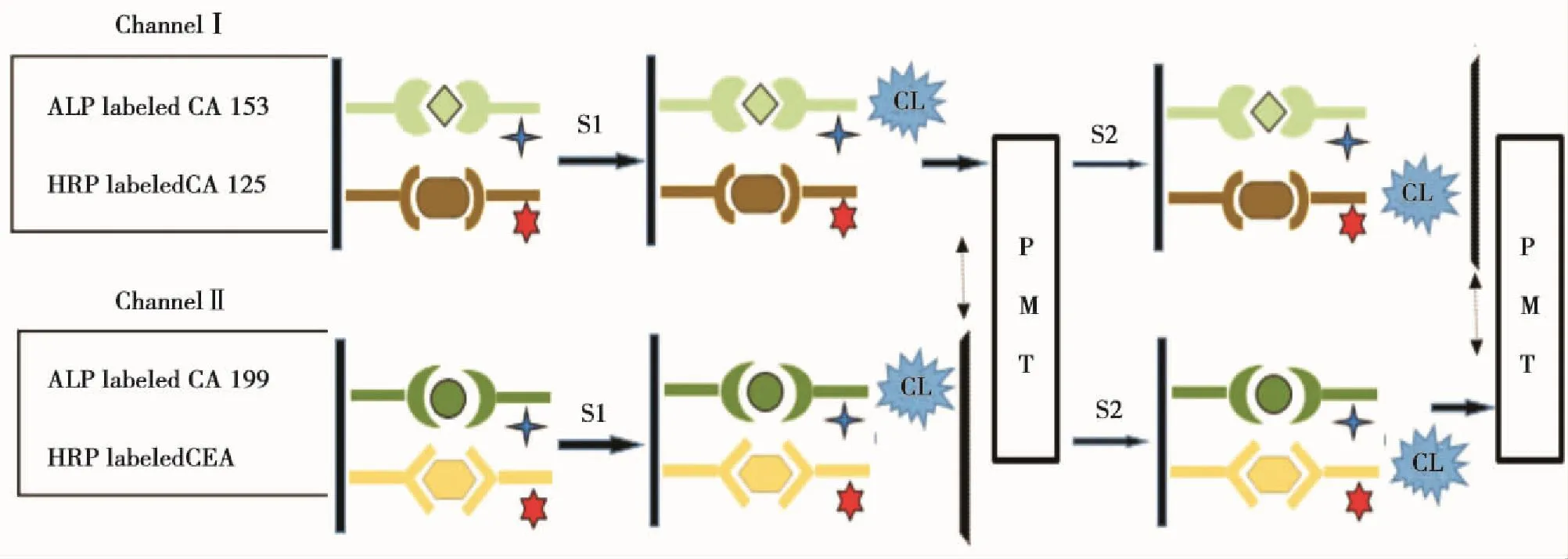
图1 通道底物二维空间分辨化学发光免疫分析系统[22]Figure 1 Channel and substrate zone two-dimensional resolution system for CLIA[22]
传统的静态检测方法耗时较多,流动注射分析(flow injection analysis,FIA)结合化学发光系统形成的动态检测方法具有灵敏度高、分析速度快、重复性好和在线自动分析的优点,顺序注射分析作为FIA分析的一个重要分支还可以实现多组分的在线过程分析和同时检测[23-24]。一些具有高效分离检测能力的技术也可以与化学发光结合,如高效液相色谱法(high performance liquid chromatography,HPLC)、毛细管电泳法(capillary electrophoresis-chemiluminescence,CE)和微流控芯片(micro-fluidic chip,MFC)[25-28],形成高自动化水平和高分离能力,快速、灵敏的在线多组分分离免疫分析检测法。当然联用体系也存在着自身的缺点,需要优化检测条件和接口类型等。Huang等[26]构建了微型化的FIA-CE-ECL装置中(图2),采用落滴型分流接口来解决FIA分流进样与CE的隔离,[Rb(bpy)3]2+以流动的方式不断加入柱端检测区域,将毛细管尾端插入到[Rb(bpy)3]2+流动池中实现[Rb(bpy)3]2+在毛细管出口端的电化学发光反应,再通过光纤经PMT检测。通过优化毛细管出口和工作电极、光纤的相对位置获得很高的灵敏度和分离效率。在68 mm长的分离毛细管中,脯氨酸、缬氨酸、苯丙氨酸在180 s内得到分离检测。
微流控芯片分析技术结合了CLIA、CE、FIA和微流控的技术和优势,具有分析速度快、试剂消耗少和高度自动化等特点,包括非均相免疫反应和均相免疫反应2种反应方式。非均相免疫反应因具有富集效应而拥有更高的灵敏度[29],而均相免疫反应具有更高的分离效率和更短的反应时间,但是由于在线引入发光剂对其他通道的干扰以及与发光剂混合效率较低等因素[27],实际应用还存在许多问题。Zhao[28]在微芯片电泳系统上完成细胞注入加载、溶解、电泳分离和发光检测,通过luminol-Na2S2O8体系选择性地检测细胞内的巯基化合物Cys、GSH和血红蛋白Hb,在120 s内完成分离,检测下限分别达到1 amol、32 amol、69 amol。虽然微流控芯片与传统CE相比灵敏度还不够理想,但是未来微型化、自动化、集成化和便携化是分析仪器设备发展趋势,微流控分析芯片作为微全分析系统的重要组成部分之一,还是具有很大的改进空间和应用前景。

图2 微型流动注射毛细管电泳电化学发光检测系统[26]Figure 2 Miniaturized capillary electrophoresis system with flow injection sample introduction and electrogenerated chemiluminescence detection[26]
2.3全自动化检测
传统的免疫分析由于免疫物质的混合反应效率低,检测分析的流程冗长操作繁琐,因而耗时较多。为实现快速检测,需加速热力和免疫动力学反应,提高自动化水平,联用其他技术减少操作节约时间。磁性纳米微粒作为载体平台,不但可以提高混合和反应效率以及灵敏度,利用外加磁场还可以方便快捷的分离结合相,减少繁琐的人工操作,为CLIA的全自动化发展奠定了坚实的基础。Zhang等[30]利用磁微粒(magnetic particles,MP)和包被管的化学发光酶免疫分析法(chemiluminescent enzyme immunoassay,CLEIA)对人血清甲种胎儿球蛋白的评估和分析进行了研究比较,MP-CLEIA的线性范围更广泛、分析时间更短、钩状效应浓度更高,显示MP-CLEIA对于筛查检测的方便快捷优越的优点和全自动化操作系统的应用潜力。
随着人们对于检测水平和仪器要求的提高,化学发光免疫分析提高灵敏度、稳定性、检测项目以及分析速度等,集成磁微粒、流动注射分析、微流控芯片以及机械电子等的新型自动化材料技术形成智能化、自动化、一体化系统是大势所趋。未来更高通量的全自动化学发光分析仪器、即时检测[31]仪器、远程在线检测仪器等将成为相关的研究热点之一。表2概述了目前市场上国内外代表性全自动化学发光免疫分析体系。
3 化学发光的应用与展望
鉴于化学发光免疫分析法高灵敏度、宽线性范围、分析速度快等优点,雅培、罗氏、贝克曼等相继推出了全自动检测仪器,极大地提高了工作效率和检测的准确度灵敏度,减少人为操作误差,推动了化学发光免疫分析法在临床、食品安全和环境分析等方面的应用。目前在临床上主要应用于激素、肿瘤标志物、心肌标志物、传染病等[32-33]的检测,为了提高诊断准确性,减少漏检等误差,结合多种抗原抗体联检取得了良好的效果。第四代雅培的艾滋病毒化学发光检测试剂盒,采用艾滋病毒的P24抗原和HIVI/HIVII型抗体联检,大大提高了检测的准确度和灵敏度,有效的减少了漏检的发生。
自从20世纪60年代开始,现代电子技术和高灵敏度的光电传感器的发展,提供了许多研究和测定化学发光的新手段,对该领域的发展起到了极大的推动作用而迅速发展。近年来,化学发光的发展主要表现在:(1)化学发光使用的试剂以及原料的制备标记等研究和发展;(2)新化学发光体系和条件的不断建立和优化;(3)新型纳米材料与化学发光的结合应用;(4)化学发光与其他方法或技术联用,包括流动注射技术、新传感器技术、毛细管电泳分离技术和微流控技术等等,拓宽了化学发光体系的应用范围;(5)化学发光仪器的研究开发,为化学发光的进一步发展创造条件;(6)化学发光分析的应用范围扩大至各个领域。因此,可以预见,化学发光免疫分析法将更多的联用其他技术和材料,提高灵敏度和稳定性,逐步完善自动化、集成化、微型化、智能化和便携性水平,特别是发展多组分的全自动快速检测仪器和POCT仪器,应用到更广泛的领域范围。

表2 常见的化学发光免疫分析仪器技术参数Table 2 Technical parameters of common chemiluminescence immunoassay instruments
参考文献
[1]李振甲,应希堂,马世俊.化学发光免疫分析技术的研究现状与展望[J].国际检验医学杂志, 2006,27(1):95-97.
[2]尹东光,贺佑丰,刘一兵,等.几种主要化学发光物质的发光性能及其化学发光免疫分析体系[J].标记免疫分析与临床, 2002,9(4):225-230.
[3]Luo J, Cui X, Liu W, et al. Highly sensitive homogenous chemiluminescence immunoassay using gold nanoparticles as label [J]. Spectrochim Acta A Mol Biomol Spectrosc, 2014,131:243-248.
[4]He S, Shi W, Zhang X, et al. Beta-cyclodextrins-based inclusion complexes of CoFe(2)O(4) magnetic nanoparticles as catalyst for the luminol chemiluminescence system and their applications in hydrogen peroxide detection[J]. Talanta, 2010, 82(1):377-383.
[5]Nozaki O, Ji XY, Kricka LJ. New enhancers for the chemiluminescent peroxidase-catalyzed chemiluminescent oxidation of pyrogallol and purpurogallin[J]. Journal of Bioluminescence and Chemiluminescence, 1995, 10(3):151-156.
[6]Chen Z, Zu Y. Gold nanoparticle-modified ITO electrode for electrogenerated chemiluminescence: well-preserved transparency and highly enhanced activity [J]. Langmuir, 2007,23(23):11387-11390.
[7]Liu ZM, Yang HF, Li YF, et al. Core-shell magnetic nanoparticles applied for immobilization of antibody on carbon paste electrode and amperometric immunosensing[J]. Sensors and Actuators B-Chemical, 2006,113(2): 956-962.
[8]Zu Y, Bard AJ. Electrogenerated chemiluminescence. 67.Dependence of light emission of the tris (2,2′) bipyridylruthenium (II)/tripropylamine system on electrode surface hydrophobicity[J]. Anal Chem, 2001,73 (16):3960-3964.
[9]Martin C, Bresnick L, Juo RR, et al. Improved chemiluminescent DNA sequencing[J]. Biotechniques, 1991, 11(1):110-113.
[10]Kaar JL. Lipase activation and stabilization in roomtemperature ionic liquids[J]. Methods Mol Biol, 2011, 679:25-35.
[11]Broeke LJP, van denBruijn VG, deHeijnen JHM, et al. Micellar catalysis for epoxidation reactions[J]. Industrial & Engineering Chemistry Research, 2001,40(23):5240-5245.
[12]Mousli M, Turki I, Kharmachi H, et al. Recombinant single-chain Fv antibody fragment-alkaline phosphatase conjugate: a novel in vitro tool to estimate rabies viral glycoprotein antigen in vaccine manufacture[J]. J Virol Methods, 2007,146(1-2): 246-256.
[13]Brockmann EC, Vehniainen M, Pettersson K. Use of high-capacity surface with oriented recombinant antibody fragments in a 5-min immunoassay for thyroidstimulating hormone[J]. Analytical Biochemistry, 2010, 396(2):242-249.
[14]Holec-Gasior L, Kur J. Toxoplasma gondii: Recombinant GRA5 antigen for detection of immunoglobulin G antibodies using enzyme-linked immunosorbent assay [J]. Experimental Parasitology, 2010,124(3):272-278.
[15]Busse C, Strubel A, Schnitzler P. Combination of native and recombinant cytomegalovirus antigens in a new ELISA for detection of CMV-specific antibodies [J]. J Clin Virol, 2008,43(2):137-141.
[16]Geng J, Jia XD, Zhu JJ.S onochemical selective synthesis of ZnO/CdS core/shell nanostructures and their optical properties[J]. Crystengcomm, 2011,13(1):193-198.
[17]Deng L, Shan Y, Xu JJ, et al. Electrochemiluminescence behaviors of Eu(3+)-doped CdS nanocrystals film in aqueous solution[J]. Nanoscale, 2012,4(3):831-836.
[18]Fan FR, Park S, Zhu Y, et al. Electrogenerated chemiluminescence of partially oxidized highly oriented pyrolytic graphite surfaces and of graphene oxide nanoparticles[J]. J Am Chem Soc, 2009,131(3):937-939.
[19]Guo Z, Hao T, Duan J, et al. Electrochemiluminescence immunosensor based on graphene-CdS quantum dots-agarose composite for the ultrasensitive detection of alpha fetoprotein[J]. Talanta, 2012,89:27-32.
[20]Qian J, Dai HC, Pan XH, et al. Simultaneous detection of dual proteins using quantum dots coated silica nanoparticles as labels[J]. Biosensors & Bioelectronics, 2011,28(1):314-319.
[21]Goldman ER, Clapp AR, Anderson GP, et al. Multiplexed toxin analysis using four colors of quantum dot fluororeagents [J]. Analytical Chemistry, 2004,76(3): 684-688.
[22]Fu Z, Yang Z, Tang J, et al. Channel and substrate zone two-dimensional resolution for chemiluminescent multiplex immunoassay[J]. Anal Chem, 2007,79(19): 7376-7382.
[23]Gomez V, Callao MP. Multicomponent analysis using flow systems[J]. Trac-Trends in Analytical Chemistry, 2007,26(8):767-774.
[24]Liu H, Fu Z, Yang Z, et al. Sampling-resolution strategy for one-way multiplexed immunoassay with sequential chemiluminescent detection[J]. Anal Chem, 2008, 80(14):5654-5659.
[25]Ikeda R, Ichiyama K, Tabuchi, N, et al. Determination of folates by HPLC-chemiluminescence using a ruthenium(II)-cerium(IV) system, and its application to pharmaceutical preparations and supplements[J]. Luminescence, 2014,29(7):824-830.
[26]Huang XJ, Wang SL, Fang ZL. Combination of flow injection with capillary electrophoresis 8. Miniaturized capillary electrophoresis system with flow injection sample introduction and electrogenerated chemiluminescence detection[J]. Analytica Chimica Acta, 2002,456 (2):167-175.
[27]Hashimoto M, Tsukagoshi K, Nakajima R, et al. Microchip capillary electrophoresis using on-line chemiluminescence detection[J]. Journal of Chromatography A, 2000,867(1-2):271-279.
[28]Zhao S, Huang Y, Ye F, et al. Determination of intracellular sulphydryl compounds by microchip electrophoresis with selective chemiluminescence detection [J]. J Chromatogr A, 2010,1217(36):5732-5726.
[29]Wolter A, Niessner R, Seidel M. Detection of escherichia coli O157: H7, salmonella typhimurium, and legionella pneumophila in water using a flow-through chemiluminescence microarray readout system[J]. Analytical Chemistry, 2008,80(15):5854-5863.
[30]Zhang QY, Wang X, Li ZJ, et al. Evaluation of alphafetoprotein (AFP) in human serum by chemiluminescence enzyme immunoassay with magnetic particles and coated tubes as solid phases[J]. Analytica Chimica Acta, 2009,631(2):212-217.
[31]Yazawa Y, Oonishi T, Watanabe K, et al. System-onfluidics immunoassay device integrating wireless radiofrequency-identification sensor chips[J]. J Biosci Bioeng, 2014,118(3): 344-349.
[32]Tong HL, Li J, Wen XY, et al. Clinical value of the combination detection serum tumor markers in cervical cancer[J]. Labeled Immunoassays & Clin Med, 2011, 18(3):160-162.
[33]Ohta H, Takemura M, Furuta N, et al. Clinical significance and problems in HCV measurement—comparison of CLEIA method with PCR method[J]. Rinsho Byori, 2004,52(10): 813-818.
·论著·
通讯作者:★张军,E-mail:zhangj@xmu.edu.cn
基金项目:国家高技术研究发展计划(863计划)(2011AA02A101)
