基于全自动管式化学发光免疫检测系统的人结核感染T细胞检测方法的建立
2015-03-10陈鹭颖林海军翁祖星徐飞海葛胜祥
陈鹭颖 林海军 翁祖星 徐飞海 葛胜祥 张 军★
基于全自动管式化学发光免疫检测系统的人结核感染T细胞检测方法的建立
陈鹭颖1林海军2翁祖星2徐飞海2葛胜祥2张军2★
[摘要]目的建立基于化学发光平台的人结核感染T细胞检测方法。方法将一株γ-干扰素单抗标记在磁微粒上,另一株γ-干扰素单抗标记在吖啶酯上,然后将检测体系与已有的细胞刺激培养体系相结合。结果本研究成功建立基于化学发光平台的人结核感染T细胞检测方法。以ELISA平台检测试剂的检测结果作为参考,该方法的灵敏度为98.3%,特异性为99.2%,总体符合率达到98.8%。结论该方法具有更高的分析灵敏度(可达0.27 pg/mL)、更宽的线性范围(1 pg/mL~5 000 pg/mL)、更好的重复性(批内与批间变异系数均<6.0%)及更易实现高通量检测,为临床诊断结核感染提供了有力的工具。
[关键词]结核感染T细胞;γ-干扰素定量检测;化学发光
作者单位:1.福建省食品药品认证审评中心,福建,福州350003 2.厦门大学国家传染病诊断试剂与疫苗工程技术研究中心,福建,厦门361102
Development of detection kit for T cell infected with Mycobacterium tuberculosis based on fullautomatic chemiluminescence immune analyzer
CHEN Luying1, LIN Haijun2, WENG Zuxing2, XU Feihai2, GE Shengxiang2, ZHANG Jun2★
(1. Fujian Food and Drug Administration, Fuzhou, Fujian, China, 350003; 2. National Institute of Diagnostics and Vaccine Development in Infectious Diseases, Xiamen University, Xiamen, Fujian, China, 361012)
[ABSTRACT] ObjectiveTo develop the detection kit for T cell infected with Mycobacterium tuberculosis based on full-automatic chemiluminescence immune analyzer. Mehtods An antiIFN-γ Mab was coated on the surface of microparticle. Another anti IFN-γ Mab was labelled to acridinium ester. After that, the detection system was combined with the in vitro cell culture system.ResultsThis research developed the detection kit for T cell infected with Mycobacterium tuberculosis based on full-automatic chemiluminescence immune analyzer. Compared with the testing results of the ELISA kit, the sensitivity, specificity and total matching ratio of the CLIA kit was 98.3%, 99.2% and 98.8%, respectively. ConclusionThe CLIA kit has better sensitivity (0.27 pg/mL), wilder linear range (1 pg/mL ~ 5 000 pg/mL), and better repeatability (intra and inter coefficient of variation < 6.0%). It makes a high throughput detection available. It will contribute to the clinical diagnosis of Mycobacterium tuberculosis.
[KEY WORDS] T cell infected with Mycobacterium tuberculosis; IFN-γ quantitative detection; Chemiluminescent immunoassay
目前全球约有三分之一的人感染了结核分枝杆菌,其中约10%会进一步发展成为活动性结核[1]。临床上用于判断结核分枝杆菌感染的最常见方法是结核菌素皮肤试验(tuberculin skin test,TST)。但TST的特异性较差,阳性结果不能排除非结核分枝杆菌(Nontuberculous mycobacteria,NTM)感染,也无法区分是否由接种卡介苗引起[1-2]。因此,近年来在欧美发达国家,TST已逐渐被γ-干扰素释放试验(interferon gamma release assay,IGRA)所取代。IGRA的方法是利用结核分枝杆菌特异性抗原与受试者的新鲜外周全血中的T细胞共同孵育刺激培养,如果受试者受到过结核分枝杆菌感染,那么激活的T细胞会分泌大量的γ-干扰素,通过γ-干扰素的定量检测可以判断受试者是否存在结核菌感染。由于IGRA采用结核分枝杆菌特异性抗原(CFP-10和ESAT-6)作为刺激原,不受卡介苗和一些非结核分枝杆菌的影响,其判断结核感染特异性明显高于TST试验[3-6]。目前国内已上市的IGRA产品主要分为2类,一类为酶联免疫斑点法(enzyme-linked Immunospot,ELISPOT),代表试剂为英国Oxford Immnnotec 的T-SPOT.TB试剂;另一类为体外释放酶联免疫法(tuberculosis interferon gamma release assay,TB-IGRA),代表试剂为澳大利亚Cellestis公司的QFT-GIT试剂和北京万泰的TB-IGRA试剂。ELISPOT方法直接测量外周血中MTB特异T细胞的含量,但需进行淋巴细胞分离培养和ELISPOT斑点计数,其技术水平和实验室条件要求较高,在我国仅能在部分科研单位及大的中心实验室使用。TB-IGRA方法通过检测T细胞在体外抗原刺激后的IFN-γ释放来间接检测机体特异性T细胞应答。该技术采用全血培养,仅需普通37℃温箱和实验室常规的检测仪器,便于在有一定条件的医疗单位推广使用。目前采用TB-IGRA方法的试剂在γ-干扰素检测部分均采用传统的酶联免疫分析,而化学发光免疫分析与传统的酶联免疫分析相比,它具有更高的灵敏度、更宽的线性范围、更好的重复性及更容易实现高通量的检测[7]。本研究基于TB-IGRA原理,采用化学发光免疫分析法[7-8](chemiluminescent immunoassay,CLIA)建立γ-干扰素检测体系,并结合已有的细胞刺激培养体系建立了人结核感染T细胞检测方法,评价试剂各项性能指标,在临床检测中与国产主流试剂进行对比,其更宽检测范围等性能的实现,将为γ-干扰素释放试验(interferon gamma release assay,IGRA)方法在结核病的辅助诊断以及用药后的疗效监测等方面的深入研究与应用提供有力的工具。
1 材料与方法
1.1材料和试剂
2株γ-干扰素单克隆抗体C6H4和8A11、γ-干扰素抗原、特异性刺激抗原E1CO和阳性刺激抗原PHA均来自厦门大学;磁珠购自Merck公司,吖啶酯原料来自厦门大学;检测仪器CARIS200分析仪及其配套耗材来自厦门优迈科医学仪器有限公司;对照试剂盒采用北京万泰生物药业股份有限公司的结核分枝杆菌相关γ-干扰素检测试剂盒(体外释放酶联免疫法)。
用γ-干扰素抗原配制的参考品:L系列参考品(L1~L8,浓度分别为1 pg/mL、5 pg/mL、15 pg/mL、50 pg/mL、150 pg/mL、500 pg/mL、1 500 pg/mL、5 000 pg/mL);精密度参考品CV-1(15 pg/mL)、CV-2(500 pg/mL)。临床样本来自厦门大学。
1.2方法
1.2.1磁珠包被单克隆抗体
取磁珠用EDC溶液(10 mg EDC溶于1mL去离子水)活化,然后加入单克隆抗体C6H4并置于旋转混匀仪上孵育偶联,孵育后用甘氨酸溶液(pH 7.4)进行封闭,完成封闭后保存在含酪蛋白的磷酸盐缓冲液(phosphate buffer solution,PBS)中。
1.2.2吖啶酯标记单克隆抗体
取单克隆抗体8A11稀释到合适浓度后加入吖啶酯(溶于甲基甲酰胺中),混匀,室温避光反应;加入赖氨酸溶液(pH 8.0)封闭;最后透析到PBS中,用含酪蛋白的PBS稀释后使用。
1.2.3刺激培养管的配制
直接在培养管中加入50 μL 50 mmol/L的PBS,作为本底对照培养管N。用50 mmol/L的PBS将特异性结核杆菌抗原E1C0稀释至50 μg/mL,每根培养管中加入50 μL稀释后的E1C0,作为测试培养管T。用50 mmol/L的PBS将阳性抗原PHA稀释至1 mg/mL,每根培养管中加入50 μL稀释后的PHA,作为阳性对照培养管P。
1.2.4参考品的配制
用20%婴牛血清将γ-干扰素抗原稀释成所需浓度,-20℃保存备用。
1.2.5γ-干扰素的体外释放
采集:每个受试者采用静脉穿刺术采集标本,使用肝素抗凝的真空采血管采集。分装:在2 h之内将采集的全血分装到“本底对照培养管N”、“测试培养管T”、“阳性对照培养管P”3个培养管中。每种培养管加入全血1.0 mL,分装前需要将采集的全血标本颠倒混匀3次以上。培养:将培养管轻柔颠倒5次后迅速放入37℃温箱培养(22±2)h,培养过程中保持试验管直立。离心:将培养后的全血以3 000 r/min~5 000 r/min离心10 min,取血浆进行检测,注意不可吸到细胞层。
1.2.6γ-干扰素的测定
通过CARIS系统执行测定操作:CARIS系统先吸取样本转移到反应杯中;向反应杯中加入包被后的磁珠,混匀、孵育并冲洗反应混合物;向反应杯中加入标记后的吖啶酯,混匀、孵育并冲洗反应混合物;添加预激发液和激发液后检测反应复合物的相对发光强度(relative light unit,RLU)。
1.2.7四参数拟合剂量反应曲线

1.2.8分析灵敏度的确定
用试剂检测L系列参考品,用GraphPad Prism5.01进行四参数拟合试剂剂量反应曲线。然后重复测定基质血清20次,计算其平均发光值、标准差(standard deviation,SD),得出M+2SD,然后将M+2SD的RLU值代入试剂盒剂量反应曲线方程中,求出对应的浓度值,即为其分析灵敏度。
1.2.9精密度的测量
用3批试剂分别检测精密度参考品CV-1(15 pg/mL)、CV-2(500 pg/mL),每份标本平行检测10次,计算测定值的平均值和SD,按照公式CV=SD/平均值×100%计算批内和批间CV。
2 结果
2.1分析灵敏度
以L系列参考品建立四参数拟合试剂剂量反应曲线,通过重复测定基质血清得出所建立化学发光试剂的检测下限(分析灵敏度)为0.27 pg/mL,而ELISA试剂盒的分析灵敏度为2 pg/mL。
2.2剂量反应曲线
用试剂重复检测4次L系列参考品,建立四参数拟合试剂剂量反应曲线,测量值与标定值的相关系数(r)为0.99997,表明本试剂具有良好的剂量反应关系(图1)。
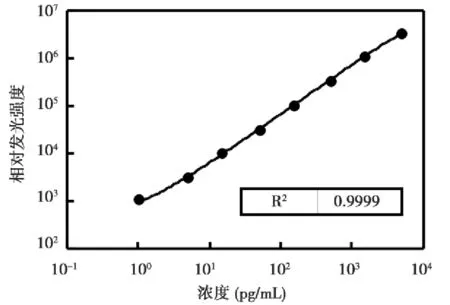
图1 试剂剂量反应曲线Figure 1 Dose-response curve of the reagent
2.3精密度
用3批试剂分别检测精密度参考品CV-1(15 pg/mL)、CV-2(500 pg/mL)。结果显示3批试剂的批内及批间精密度良好(表1)。
2.4抗干扰能力
分别考察溶血、黄疸、高脂、类风湿因子(rheumatoid factor,RF)等不同干扰因素对试剂检测结果的影响。
2.4.1溶血
选取3份临床确诊为肺结核的标本(编号分别为1#~3#),在进行刺激培养前将采集的新鲜血分成2组,其中一组进行正常刺激培养,另外一组进行溶血处理后刺激培养,然后检测每份标本的γ-干扰素含量,从而对检测结果进行判定,结果如表2所示。
由表2可知,正常培养的3份标本检测结果均为阳性,但溶血后对标本进行培养,阳性对照管没有反应,结果判定为不确定,这可能是由于溶血标本中T细胞破裂死亡导致。因此,溶血对本试剂检测结果有较大影响,在标本处理时应避免溶血现象的出现。

表2 溶血对检测的影响Table 2 The influence of hemolysis
2.4.2黄疸
选取3份临床确诊为肺结核和黄疸的标本(编号分别为4#~6#)、3份临床确诊为非结核但有黄疸的标本(编号分别为7#~9#)进行培养,然后检测每份标本的γ-干扰素含量,从而对检测结果进行判定,结果如表3所示。

表3 黄疸对检测的影响Table 3 The influence of jaundice
由表3可知,临床确诊为肺结核和黄疸的标本用本试剂检测均为阳性,非结核但患有黄疸的标本本试剂检测均为阴性,表明黄疸不会对本试剂检测结果造成影响。
2.4.3高脂
选取3份临床确诊为肺结核的高脂标本(编号分别为10#~12#)、3份临床确诊为非结核的高脂标本(编号分别为13#~15#)进行培养,然后检测每份标本的γ-干扰素含量,从而对检测结果进行判定,结果如表4所示。
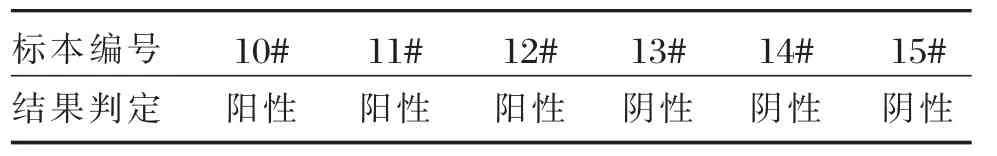
表4 高脂对检测的影响Table 4 The influence of hyperlipemia
由表4可知,3份肺结核标本检测结果为阳性,3份非结核标本检测为阴性,从而表明高脂不会对试剂结果造成影响。
2.4.4类风湿因子
为考察标本中的RF是否会对本试剂的检测结果造成影响,收集3份IFN-γ阳性RF阳性标本(编号为16#~18#),3份IFN-γ阴性RF阳性标本(编号为19#~21#)用本试剂进行检测,结果如表5所示。
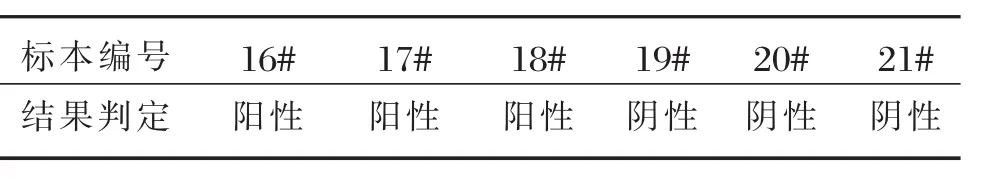
表5 类风湿因子对检测的影响Table 5 The influence of RF
由表5可知,3份肺结核标本检测结果为阳性,3份非结核标本检测为阴性,从而表明类风湿因子不会对试剂结果造成影响。
2.5与同类产品的比较
用本试剂与北京万泰生物药业股份有限公司的结核分枝杆菌相关γ-干扰素检测试剂盒(体外释放ELISA)进行特异性、灵敏度的比较。
用本试剂和ELISA试剂分别检测241份临床标本。由表6结果可知,以北京万泰生物药业股份有限公司的结核分枝杆菌相关γ-干扰素检测试剂盒(体外释放ELISA)的检测结果为对照,本试剂的特异性为98.3%、灵敏度为99.2%。总符合率达到98.8%。
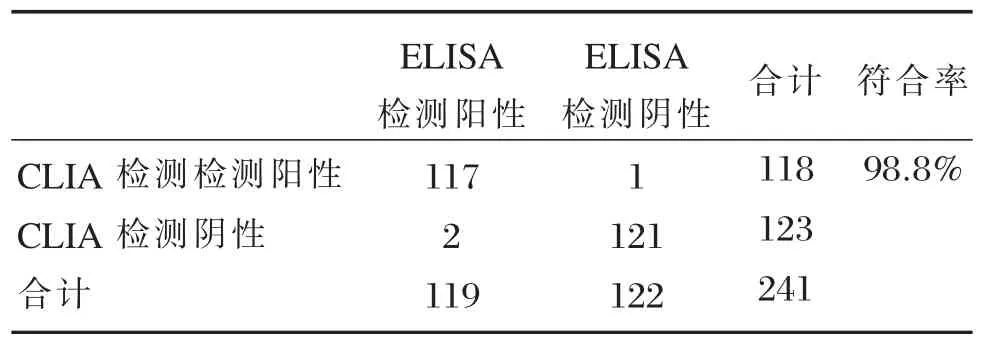
表6 与ELISA试剂盒的符合率Table 6 Coincidence rate with the ELISA kit
用本试剂与ELISA试剂分别检测82份临床血浆,由图2可知,两者的定量值经过直线回归后,得到的线性回归方程为y=0.9930x+0.01128,相关系数r达到0.9833,表明两试剂有良好的相关性。
本试剂与ELISA试剂的主要性能指标对比如表7所示。
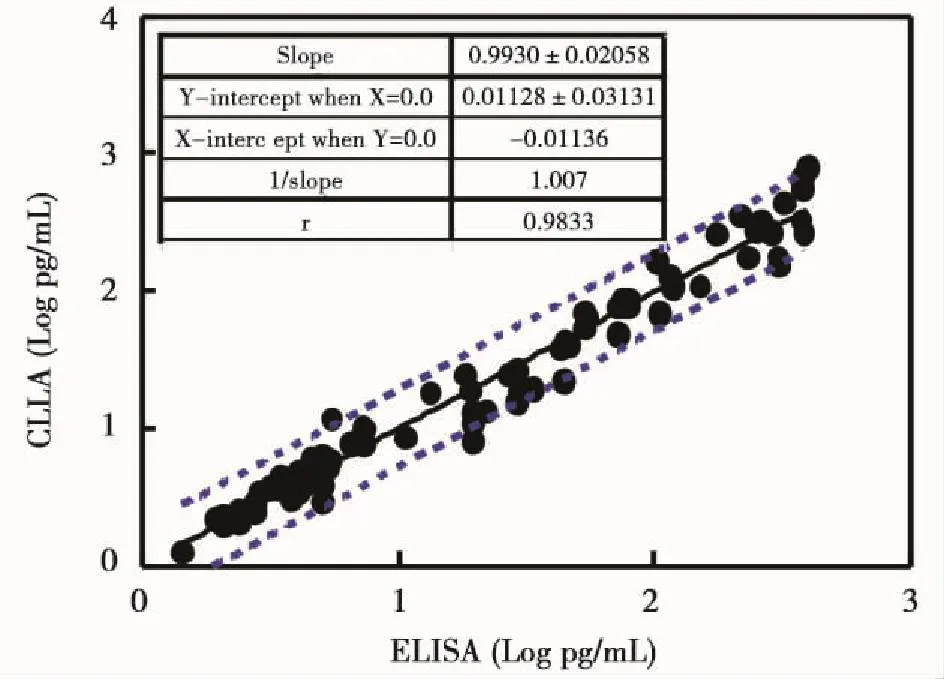
图2 CLIA试剂与ELISA试剂的定量相关性分析Figure 2 The quantitative correlation analysis between CLIA kit and ELISA kit

表7 CLIA试剂与ELISA试剂的比较Table 7 Comparison of the CLIA kit and the ELISA kit
3 讨论
结核病作为可通过空气传播的疾病,其传播能力很强,不易控制。在临床上,TB-IGRA方法在结核诊断与防治上的应用已经越来越被认可并采用[9-11]。
本研究所建立的人结核感染T细胞检测方法基于全自动管式化学发光免疫检测系统进行γ-干扰素释放量的定量检测。全自动化学发光免疫检测系统是一个高度集成和自动化的免疫分析系统,包括了免疫反应及光检测系统,样本、试剂和耗材装载系统,液体管路和电器控制系统,用户操作界面等系统,能够实现检测多种项目的一体化操作,大大提高了临床检测的通量与效率。另外,由于其通过反应释放的光子数来只是分析物的浓度,与传统的ELISA相比,其具有更高的灵敏度,更宽的线性范围及更好的重复性。
在临床应用中,现有采用ELISA方法测定γ-干扰素释放量的商品化试剂盒(北京万泰生物药业股份有限公司)对结果阴阳性的判定中最为重要的一个条件是测试培养管T的γ-干扰素释放量相对于本底对照培养管N的γ-干扰素释放量升高14 pg/mL,而N管的检测值一般是趋近于检测下限的。该ELISA试剂的剂量反应曲线范围为12.5 pg/mL~400 pg/mL,浓度为14 pg/mL样本的检测已经接近其线性范围下限,所以在临床使用中对于操作人员就有较高的要求,对于T管实际γ-干扰素含量在14 pg/mL附近的样本的检测需要足够的准确,轻微的误差就可能引起对样本阴阳性的判定的不同。而本研究所建立的基于全自动管式化学发光免疫检测系统的γ-干扰素释放量的定量检测,其检测的线性范围为1 pg/mL~5 000 pg/mL,能够对绝大多数的临床样本的T管作出准确的定量检测。
本方法与现有采用ELISA方法测定γ-干扰素释放量的商品化试剂盒(北京万泰生物药业股份有限公司)的主要性能对比如表7所示,其灵敏度、线性范围均有大幅提高,且具有良好的抗干扰能力。该方法的建立可为临床检测结核感染提供更加强有力的工具。
参考文献
[1]World Health Organization. Tuberculosis [J]. Saudi Medical Journal, 2013,34(11):1205-1207.
[2]Farris AB, Branda JA. QuantiFERON-TB gold assay for tuberculosis infection [J].Clinical Microbiology Newsletter, 2007,29(17):129-136.
[3]Winthrop KL. The risk and prevention of tuberculosis: screening strategies to detect latent tuberculosis among rheumatoid arthritis patients who use biologic therapy [J]. International Journal of Advances in Rheumatology, 2010,8(2):43-52.
[4]Winthrop KL, Nyendak M, Calvet H, et al. Interferonγ release assays for diagnosing Mycobacterium tuberculosis infection in renal dialysis patients [J]. Clinical Journal of the American Society of Nephrology, 2008, 3(5):1357-1363.
[5]Richeldi L, Losi M, D'Amico R, et al. Performance of tests for latent tuberculosis in different groups of immunocompromised patients[J]. Chest Journal, 2009, 136 (1):198-204.
[6]Piana F, Codecasa LR, Cavallerio P, et al. Use of a T-cell-based test for detection of tuberculosis infection among immunocompromised patients[J]. European Respiratory Journal, 2006,28(1):31-34.
[7]Gámiz-Gracia L, García-Campa觡a AM, Soto-Chinchilla JJ, et al. Analysis of pesticides by chemiluminescence detection in the liquid phase[J]. Trzc Trends in Analytical Chemistry, 2005,24(11):927-942.
[8]Tao X, Wang W, Wang Z, et al. Development of a highly sensitive chemiluminescence enzyme immunoassay using enhanced luminol as substrate[J]. Luminescence, 2014,29(4):301-306.
[9]蒋英,赵蓉,张胜男,等.干扰素释放酶联免疫法(TB-IGRA)用于检测结核分枝杆菌的优越性[J].实用预防医学, 2012,19(1):24-26.
[10]Kleinert S, Tony HP, Krueger K, et al. Screening for latent tuberculosis infection: performance of tuberculin skin test and interferon-γ release assays under real-life conditions[J]. Annals of the Rheumatic Diseases, 2012, 71(11):1791-1795.
[11]Mariette X, Baron G, Tubach F, et al. Influence of replacing tuberculin skin test with ex vivo interferon γ release assays on decision to administer prophylactic antituberculosis antibiotics before anti-TNF therapy[J]. Annals of the Rheumatic Diseases, 2012,71(11):1783-1790.
通讯作者:★张军,E-mail:zhangj@xmu.edu.cn
基金项目:国家高技术研究发展计划(863计划)(2011AA02A101)
