响应面优化黄皮叶中的活性因子超声提取工艺及其抗氧化活性研究
2015-03-10苏志鹏孔繁晟方宇洪杨妙婷刘欣陈泽丹
苏志鹏 孔繁晟 方宇洪 杨妙婷 刘欣 陈泽丹
响应面优化黄皮叶中的活性因子超声提取工艺及其抗氧化活性研究
苏志鹏孔繁晟★方宇洪杨妙婷刘欣陈泽丹
[摘要]目的优化黄皮叶中活性因子总黄酮的超声提取工艺条件,并测定其抗氧化活性。方法以乙醇体积分数、超声时间及料液比为影响因子,以黄皮叶总黄酮得率为评价指标,在单因素试验基础上,采用响应面法优选黄皮叶总黄酮超声提取工艺,并测定黄皮叶总黄酮体外清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-1-picryl hydrazyl,DPPH)自由基、羟自由基和总抗氧化的活性。结果黄皮叶总黄酮的最佳提取工艺条件为乙醇体积分数18%、超声时间73 min、料液比31∶1(mL/g)。在此条件下,黄皮叶总黄酮得率达到(1.300±0.006)%。黄皮叶总黄酮得率大小的主次因素为乙醇体积分数>超声时间>料液比,其中超声时间与料液比因素之间的交互作用显著。黄皮叶总黄酮体外清除DPPH和羟自由基的IC50值分别为0.282 mg/mL、1.152 mg/mL,用三价铁还原抗氧化能力(ferric-reducing antioxidant power,FRAP)法测得1 mg/mL黄酮的FRAP值为533.3 μmol/L。结论该所选工艺合理、可行,可用于黄皮叶总黄酮的超声提取;三种测定方法均说明黄皮叶总黄酮在一定浓度下有抗氧化活性。
[关键词]响应面分析法;提取;总黄酮;黄皮叶;抗氧化活性
作者单位:广东药学院药科学院,广东,广州510000
Optimization of extraction technology from Clausena lansium leaves by response surface and their antioxidant activity study
SU Zhipeng,KONG Fansheng★,FANG Yuhong,YANG Miaoting,LIU Xin,CHEN Zedan
(School of Pharmacy,Guangdong Pharmaceutical University,Guangzhou,Guangdong,China,510000)
[ABSTRACT]ObjectiveTo investigate the extraction of active factors of total flavonoid from Clausena lansium leaves by ultrasound and the antioxidant activity of flavonoid.MethodsCompounds in-Clausena lansium leaves were extracted by ultrasound under different levels of factors,such as alcohol con centration,ultrasonic time and ratio between solid and solvent.Total flavonoids in the compounds were tested.Extraction was optimized by response surface.The antioxidant activity against 1,1-diphenyl-1-picryl hydrazyl(DPPH),the antioxidant activity against hydroxyl radical,and the total antioxidant activity were investigated.ResultsThe optimum extraction conditions were 18%volume fraction of ethanol,73 minutes of ultrasonic time and 31∶1 of solid-to-solvent ratio(mL/g).Under these conditions,the yield of total flavonoid was(1.300±0.006)%.The order for the factors of the yield of total flavonoid were volume fraction of ethanol,ultrasonic time and solid-to-solvent ratio.The interaction between the ultrasonic time and solid-to-solvent ratio was significant.The IC50of the obtained total flavonoid against DPPH and the ion ofhydroxyl were 0.282 mg/mL and 1.152 mg/mL,respectively.The ferric-reducing antioxidant power(FRAP)value of 1 mg/mL flavonoid was 533.3 μmol/L.ConclusionOptimization of extraction technology byresponse surface is convenient and feasible.In some certain concentration of total flavonoids,all of the three methods have showed the antioxidant activity of total flavonoids extracted from the Clausena lansium leaves.
[KEY WORDS]Response surface methodology;Extraction;Total flavonoids;Clausena lansium (Lour.)Skeels leaves;Entioxidant activity
黄皮[Clausena lansium(Lour.)Skeels]是芸香科黄皮属植物,主要化学成分有香豆素类、卡巴唑和酰胺生物碱类、黄酮等。黄皮叶,性味属辛、苦、平,可疏风解表,除痰行气,有治疗温病身热、咳嗽哮喘、气胀腹痛、黄肿、疟疾、小便不利、热毒疥癞等功效,在民间常用于治疗急性黄疸型肝炎、感冒、胃痛、疝气、牛臌胀、哮喘、高血脂等病症[1]。此外,黄小桃等[2]研究发现,黄皮叶有明显的治疗2型糖尿病的作用,能促进胰岛β细胞的修复和生长增殖,增加胰岛素分泌,对受损的胰岛功能具有一定的改善作用,可以缓解由于胰岛β细胞受损而引起的高血糖症状。广东地区是黄皮的一个较大产地,而目前对黄皮叶中黄酮类化合物的研究鲜见报道。从原料的易获得性和对资源综合利用的角度出发,本实验选择广东阳春地区的黄皮叶为研究对象,旨在探讨乙醇-水浸提黄皮叶总黄酮的提取工艺,并采用响应面法优化工艺条件,同时采用体外实验测定其抗氧化活性,以期为合理开发和利用黄皮叶的功能性价值提供实验依据。
1 材料与方法
1.1材料、试剂与仪器
黄皮叶,于2014年6月份采集于广东阳春市双滘镇的种植园,经我校中药学院腾希峰博士鉴定为黄皮叶[Leaves of Clausena lansium(Lour.)Skeels],样品经干燥、粉碎处理;芦丁对照品(批号12040302,纯度≥98%),购自成都曼思特生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-1-picryl hydrazyl,DPPH)(批号A1415038)、三吡啶三吖嗪[2,4,6-Tri(2-pyridyl)-s-triazine,TPTZ](批号K1319026),分析纯,购自上海Sigma公司;硫酸亚铁、氯化钠、氯化钾、30%过氧化氢溶液、水杨酸、亚硝酸钠、无水乙醇等均为市售分析纯。752N型紫外可见光分光光度计(上海仪电分析仪器有限公司);JA2003型电子分析天平(上海恒平科学仪器公司);移液器(大龙兴创实验仪器(北京)有限公司);PHS-3D型pH计(上海精密科学仪器有限公司);KQ-400DB型台式数控超声波清洗仪(东莞市科桥超声波设备有限公司);粉碎机(温岭市林大机械有限公司)。
1.2方法
1.2.1黄皮叶总黄酮的测定
1.2.1.1对照品溶液的制备精密称取25.0 mg芦丁对照品,加入70%乙醇定容至100 mL,得到浓度为0.25 mg/mL芦丁标准溶液,作为对照品储备液。
1.2.1.2供试品溶液的制备称取黄皮叶粉末样品1.0 g,置锥形瓶中,固定提取温度50℃,料液比为40∶1(mL/g),提取时间70 min,超声功率360 W,乙醇体积分数30%,超声提取后再进行减压过滤,得到的滤液用30%乙醇定容至50 mL,即得。
1.2.1.3测定方法及方法学考察[3]精密吸取芦丁对照品储备液适量于25 mL容量瓶中,加入70%乙醇至10.0 mL,再加入5%亚硝酸钠溶液1.0 mL,摇匀,放置6 min;加入10%硝酸铝溶液1.0 mL,摇匀,放置6 min;加入4%氢氧化钠溶液10.0 mL,再加入70%乙醇定容至刻度线,摇匀,放置15 min,于510 nm下测定各浓度样品液的吸光度值(absorbence,A),计算。样品中黄酮含量测定:准确移取3.0 mL的样品液于25 mL的容量瓶中,按照上述方法测定吸光度。根据标准曲线回归方程计算总黄酮质量。总黄酮得率计算公式为:
黄酮得率/%=CV/M×100%(C为提取液浓度,g/mL;V为提取液原始体积,mL;M为黄皮叶质量)
1.2.1.4标准曲线的制备精密吸取芦丁对照储备液0.0 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL、6.0 mL于25 mL容量瓶,按1.2.1.3项的测定方法操作,以各样品液的浓度为横坐标,对应各样品液的吸光度值为纵坐标制定标准曲线。
1.2.1.5稳定性试验取1.2.1.2项的供试品溶液,按1.2.1.3项方法于1 h、4 h、8 h、12 h、24 h、48 h时测定吸光度。并计算其相对标准偏差。
1.2.1.6重现性试验准确称取黄皮叶1.0 g,共5份,按1.2.1.2项制备的供试品液,精密吸取3.0 mL于25 mL的容量瓶中,按1.2.1.3项方法操作,平行试验,于510 nm波长处测定。
1.2.1.7加样回收试验准确称取丁对照品100.0 mg,置于100 mL容量瓶中,以30%乙醇超声、溶解,并稀释至刻度,摇匀,得芦丁贮备液。准确称取黄皮叶粉末1.0 g各5份,置于锥形瓶瓶中,准确加入上述芦丁贮备液10.0 mL,按1.2.1.1项方法操作,精密量取3.0 mL按1.2.1.3项处理,于510 nm波长处测定吸光度,计算回收率。
1.2.2黄皮叶总黄酮提取工艺流程
取干燥的黄皮叶于粉碎机中粉碎,将各试验量与所需量溶剂混合,在不同条件下超声提取,然后过滤浓缩。
1.2.3黄皮叶总黄酮提取条件单因素试验
1.2.3.1乙醇体积分数准确称取黄皮叶1.0 g(经预实验黄皮叶取量为1.0 g~2.0 g时,所测定的样品溶液吸光度在0.2~0.8之间,为便于实验的操作与数据的处理分析等选用质量1.0 g的黄皮叶粉末)固定提取温度50℃,料液比为30∶1(mL/g),超声提取时间60 min,超声功率360 W,考察乙醇体积分数为10%、20%、30%、40%、50%条件下黄皮叶总黄酮得率。
1.2.3.2提取温度准确称取黄皮叶1.0 g,乙醇体积分数用1.2.3.1中的最优结果,固定料液比为30∶1(mL/g),超声提取时间60 min,超声功率360 W,考察提取温度为30℃、40℃、50℃、60℃、70℃条件下黄皮叶总黄酮得率。
1.2.3.3料液比准确称取黄皮叶1.0 g,乙醇体积分数用1.2.3.1中的最优结果,提取温度用1.2.3.2中的最优结果,固定提取时间60 min,超声功率360 W,考察料液比(mL/g)为10∶1、20∶1、30∶1、40∶1、50∶1条件下黄皮叶总黄酮得率。
1.2.3.4提取时间准确称取黄皮叶1.0 g,乙醇体积分数用1.2.3.1中的最优结果,提取温度用1.2.3.2中的最优结果,料液比(mL/g)用1.2.3.3中挑选的结果,超声功率360 W,考察提取时间为40 min、50 min、60 min、70 min、80 min条件下考察黄皮叶总黄酮得率。
1.2.3.5超声功率准确称取黄皮叶1.0 g,乙醇体积分数用1.2.3.1中的最优结果,提取温度用1.2.3.2中的最优结果,料液比(mL/g)用1.2.3.3中的最优结果,提取时间用1.2.3.4中的最优结果,考察超声功率为200 W、240 W、280 W、320 W、360 W条件下考察黄皮叶总黄酮得率。
1.2.4响应面法优化总黄酮提取工艺条件的确定[4]
在单因素的试验的结果基础上,考虑单因素对总黄酮得率影响的显著性和实验条件的可行性,固定总黄酮得率最高的温度(70℃)和超声功率(320 W),选择乙醇体积分数、超声时间、料液比为考察因素,分别用X1,X2,X3表示(下文同),并且每个因素选择3个水平。根据中心组合试验设计原理,采用三因素三水平的三元二次响应面分析方法,优化黄皮叶中总黄酮的提取工艺。试验水平分别以-1,0,1进行编码,各因素与各水平编码结果见表1。

表1 试验设计因素和水平Table 1 Factors and levels of experiment design
1.2.5黄皮叶总黄酮的抗氧化活性试验
按照响应面分析确定的黄皮叶总黄酮提取最佳条件进行提取最佳条件进行提取,提取液浓缩后经苯乙烯型弱极性共聚体的大孔树脂纯化,乙醇洗脱(体积分数50%),所得洗脱液旋转蒸发浓缩低温烘干得黄皮叶总黄酮粗品。配制适宜质量浓度溶液进行抗氧化活性实验。
1.2.5.1DPPH自由基清除率活性的测定[5]配制DPPH自由基溶液0.20 mmol/L及具有一定浓度梯度(0.12 mg/mL,0.24 mg/mL,0.36 mg/mL,0.48 mg/mL,0.60 mg/mL)的黄皮叶总黄酮样品液。取2.0 mL各浓度样品液于试管中,再各加入2.0 mL DPPH乙醇溶液(浓度为0.20 mmol/L),混合均匀,避光放置30 min,用分光光度计在517 nm处测定其吸光度Ai;同时在相同实验条件下测定2.0 mL DPPH溶液与2.0 mL蒸馏水混合后的吸光度A0及2.0 mL各浓度样品液与2.0 mL无水乙醇混合后的吸光度Aj,按下式计算清除率:
清除率(%)=[1-(Ai-Aj)/A0]×100%
用软件SPSS 19.0计算出其清除率的IC50,即自由基被清除一半时所需的样品溶液的浓度。
1.2.5.2羟自由基(·OH)清除活性的测定参照张黎明等[6]的方法。在10 mL试管中依次加入6.0 mmol/L FeSO4溶液2.0 mL、不同质量浓度的总黄酮样品液2.0 mL、6.0 mmol/L的H2O2溶液2.0 mL,摇匀静置10 min,再加入6.0 mmol/L的水杨酸溶液2.0 mL,摇匀,静置30 min后于510 nm处测其吸光度A,用软件SPSS 19.0计算出其清除率的IC50。清除率计算公式为:
清除率Y/%=[1-(Di-Dj)/D0]×100(D0为空白对照;Di为某质量浓度黄酮类组分的吸光度;Dj为无水杨酸时的吸光度)
1.2.5.3三价铁还原抗氧化能力(ferric-reducing antioxidant power,FRAP)值法总抗氧化能力的测定[7-8]标准曲线制作:将醋酸-醋酸钠缓冲液(pH=3.6,300 mmol/L)、10mmol/L TPTZ(40 mmol/L HCL溶液配制)和20 mmol/L FeCL3溶液按体积10∶1∶1配制而成FRAP试剂。取浓度0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1.0 mmol/L FeSO4溶液各150 μL,分别加入4.5 mL FRAP试剂,混匀后37℃水浴条件下反应10 min,测定593 nm处吸光值,制作标准曲线。
不同活性物质还原力的测定:经预实验,配黄酮浓度为0.5 mg/mL,1.0 mg/mL,1.5 mg/mL,2.0 mg/mL,2.5 mg/mL,各取150 μL按上述方法分析测定,由标准曲线查得相同吸光值处对应的FeSO4浓度,还原力用对应的FeSO4浓度μmol/L表示。双蒸水作为空白对照,样品抗氧化能力(μmol/L)FeSO4=样品抗氧化能力-空白抗氧化能力。
2 结果
2.1方法学的考察
2.1.1标准曲线的制备
由试验结果得到总黄酮标准曲线方程为:Y=11.50X-0.0097,r=0.9998,其中Y为样品液的吸光度值,X为样品液的浓度,r为相关系数(correlation coefficient)。结果表明芦丁含量在10 μg/mL~60 μg/mL范围内与吸收值线性关系良好。
2.1.2稳定性试验
试验结果的吸光度的相对标准偏差(relative standard deriation,RSD)=1.040%。表明样品显色后48 h内稳定性良好。
2.1.3重现性试验
试验结果测得总黄酮的平均含量为12.1mg/g (RSD=0.670%),表明本方法重现性良好。
2.1.4加样回收试验
试验结果的平均回收率为98%(RSD=1.160%),说明本测定法可行。
2.2乙醇-水提取条件选择
乙醇体积分数,提取温度,料液比,提取时间,超声功率对黄皮叶总黄酮得率影响的结果分别如图1所示。由图1(A)知,随乙醇体积分数的增大,黄皮叶总黄酮得率呈先升后降的趋势。当乙醇体积分数为20%时,总黄酮得率最高。说明黄皮叶中黄酮苷类等水溶性较好的黄酮类物质含量较高。由图1(B)知,当温度从30℃升至70℃时,总黄酮得率显著增加,在70℃达到最大值,其可能与升高温度,加快黄皮叶中总黄酮的溶出有关。由图1(C)知,当料液比从10∶1增加至30∶1(mL/g)时,总黄酮得率增加,在30∶1时达到最大值。继续升高料液比,总黄酮得率反而下降,可能是料液比增加使杂质溶出增多和影响超声效果,从而降低黄皮叶中总黄酮的溶出与扩散。由图1(D)可知,在70 min内,总黄酮的得率随提取时间的延长而增加,提取时间为70 min时,总黄酮得率最大。继续延长提取时间,黄酮得率下降。可能是过长时间的加热使黄皮叶中总黄酮氧化变性。超声功率对黄皮叶中总黄酮的得率影响见图1(E),320 W内,超声功率升高,黄皮叶中总黄酮得率升高。超声功率为320 W时,总黄酮得率最高,继续升高超声功率,总黄酮得率下降,可能与过高的功率导致黄酮苷类化合物苷键断裂等有关。综合以上因素,确定进行响应面分析的各因素考察范围为乙醇体积分数10%~30%,料液比为25∶1~35∶1(mL/g),超声时间60 min~80 min。固定提取温度70℃,超声功率320 W。
2.3黄皮叶总黄酮提取工艺优化
根据单因素试验结果,采用3因素3水平设计Box-Benhnken试验中心组合试验,响应面分析方案及结果见表2。利用Design-Expert.V8.0.6软件对表2试验数据进行多元回归拟合,得到总黄酮得率响应值的回归方程为:Y=1.30-0.022X1+0.019X2+0.016X3+(5.00×10-3)X1X2-0.010X1X3+0.018X2X3-0.049X12-0.042X22-0.057X32。

图1 各因素对总黄酮得率的影响Figure 1 Effects of the factors on the extraction yield of total flavonoids
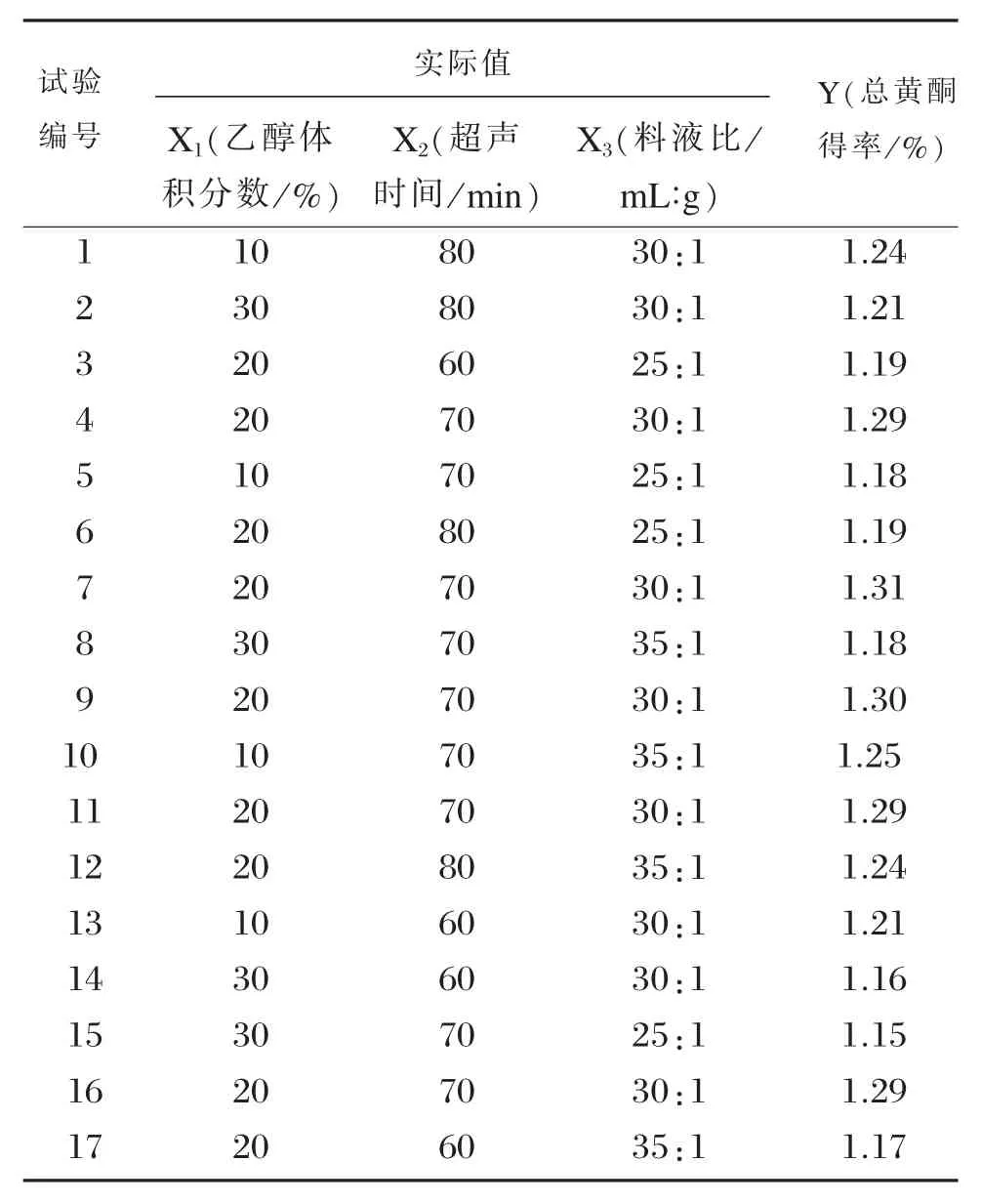
表2 黄皮叶总黄酮得率响应面方案及结果Table 2 Designs and results of the extraction of total flavonoids
上述回归方程的方差分析结果见表3。由表3可知:模型P<0.0001(显著),失拟项P=0.1717>0.05(不显著),说明方程对实验有较好的拟合性,实验误差较小。相关系数r=0.9892和调整系数(adjustment coefficient,Adj)R2=0.9510也表明模型拟合程度较好。变异系数(coefficient of variation,CV)为0.9700%,说明模型的重现性很好,该模型可用于黄皮叶总黄酮提取的工艺条件。从上表各因素显著性水平可知,对黄皮叶总黄酮得率的影响次序为:乙醇体积分数X1>超声时间X2>料液比X3。且乙醇体积分数X1的二次项,料液比X3的二次项对总黄酮得率的影响极显著(P<0.001);乙醇体积分数X1,超声时间X2,料液比X3,超声时间的二次项对总黄酮得率的影响均显著(P<0.010);超声时间X2和料液比X3的交互项(X2X3)对总黄酮得率的影响具有统计学意义(P<0.050)。
根据回归方程得出不同因子的响应面和等高线结果见图2。图2(A)表示乙醇体积分数和超声时间的交互作用对黄皮叶总黄酮得率的影响。从图2(A)可以看出,乙醇体积分数、超声时间对得率的影响都是明显的,但它们的交互作用并不明显(P=0.4293);图2(B)表示乙醇体积分数和料液比的交互作用对得率的影响。其响应面图曲面陡峭,等高线图呈椭圆形。由此可知,乙醇体积分数和液料比对得率的影响是明显的;图2(C)表示超声时间和料液比的交互作用对得率的影响。从图2 (C)可以看出,超声时间和料液比对得率的影响明显,且超声时间和料液比的交互作用显著。当超声时间较低时,得率随料液比的提高变化不大;当超声时间在70 min~73 min时,得率随料液比的增加变化明显,且能达到最大值。
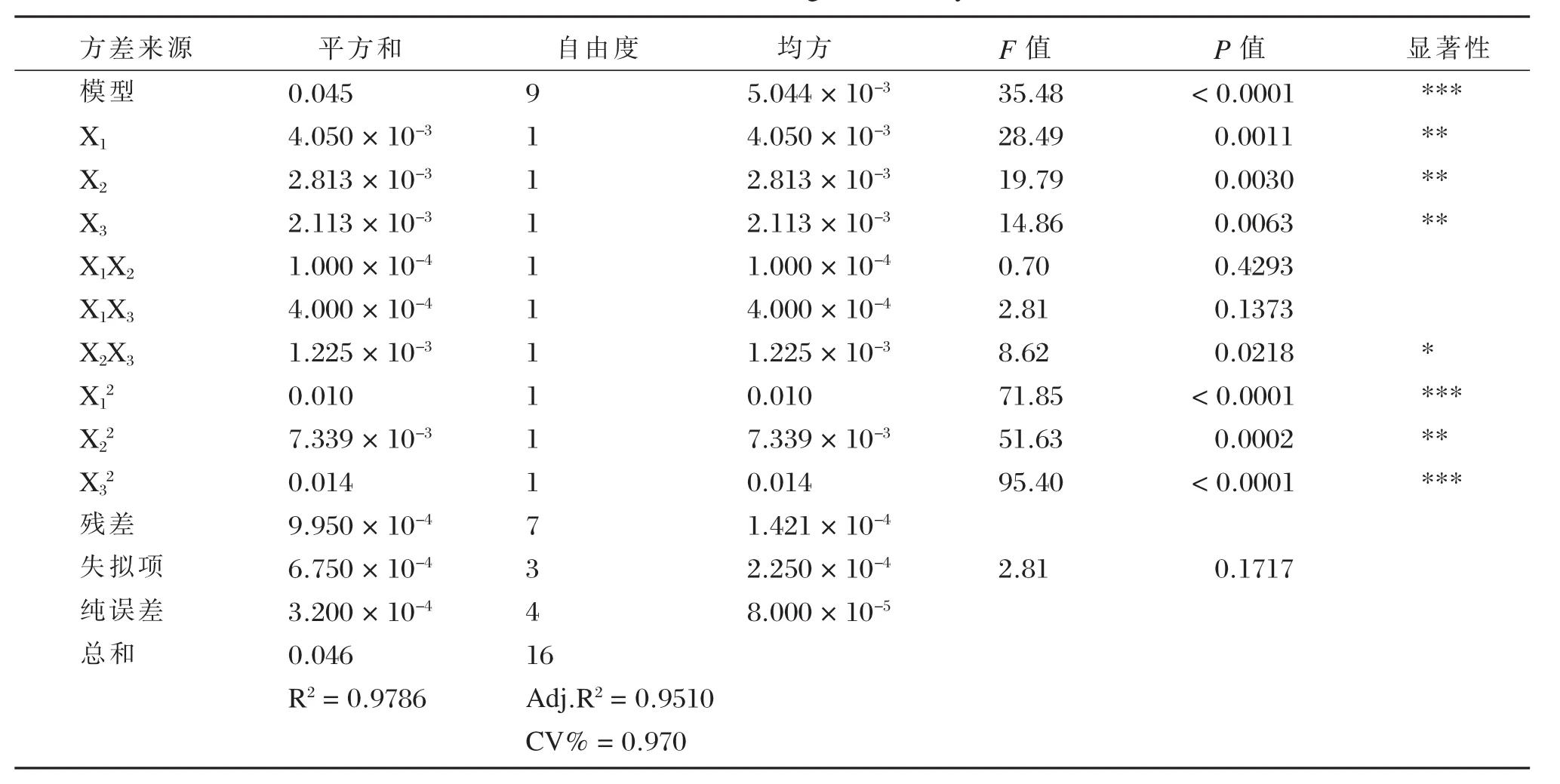
表3 回归统计分析结果Table 3 Results of regression analysis
通过软件Design-Expert V8.0.6软件分析得黄皮叶总黄酮的最佳提取条件:当乙醇体积分数为17.63%、超声时间72.53 min、液料比31.01∶1(mL/g)、提取温度70℃、超声功率320W时,黄皮叶总黄酮得率预测可达到最大值1.302%。考虑到实际操作的可行性,将上述最优提取条件修正为乙醇体积分数为18%、超声时间73 min、料液比31∶1 (mL/g)、超声功率320W。以此同取黄皮叶粉末1.0 g,进行3次重复试验,黄皮叶总黄酮得率平均值为(1.300±0.006)%,与预测值1.302%基本一致,说明了此响应面法得到的回归模型具有较好的可靠性。
2.4黄皮叶总黄酮的抗氧化活性分析
2.4.1对DPPH自由基的清除效果
不同浓度下黄酮、对DPPH自由基的清除率如表4所示,可知随着黄酮浓度的增加,对自由基的清除率逐渐增大,当浓度为0.60 mg/mL时,其清除率为78.97%;总黄酮提取物的IC50为0.28 mg/mL,说明黄皮叶总黄酮类在一定浓度条件下对DPPH自由基具有一定的清除能力。
2.4.2对·OH自由基的清除效果
不同浓度下黄酮对·OH的清除率如图4所示,随着黄皮叶总黄酮质量浓度的增加,对·OH的清除率均逐渐增大,其IC50为1.152 mg/mL,说明黄皮叶中的黄酮类成分在一定浓度条件下对·OH的清除具有清除能力。
2.4.3FRAP值法总抗氧化能力的测定
由试验结果求得三价铁还原抗氧化能力的线性回归方程y=0.0006x-0.0143,相关系数r=0.9986。其表明FeSO4浓度在0 μmol/L~1 200 μmol/L范围内与吸光度有良好的线性关系。不同浓度黄酮的还原能力如表5所示,由图5可知,随着浓度的逐渐增加,FRAP值越高,即其还原能力也逐渐增加[9],并呈现出一定的相关性(r=0.9987)。

A:超声时间和乙醇体积分数;B:乙醇体积分数和料液比;C:超声时间和料液比图2 各因素对得率的响应面分析Figure 2 Interactive effects of the factors on respond surface method analysis

表4 DPPH法测定黄皮叶总黄酮抗氧化能力Table 4 DPPH assay for estimating antioxidant capacity from the flavonoids of Clausena lansium leaves
3 讨论
黄酮是一类在植物界中分布广泛、具有多种生物活性的化合物,经研究发现,天然来源的生物黄酮具有分子量小,能被人体迅速吸收,有明显的抗衰老、抗菌抗氧化、降血脂、降血糖、抗癌防癌及调节免疫功能的作用[10-11]。黄酮含量的测定方法有紫外-可见分光光度法和高效液相色谱法等。本实验采用了紫外-可见分光光度法,该法线性、重现性和稳定性良好,操作简便、可行。响应面法作为一种有效的试验设计方法,近年来不断地应用于中药提取工艺的优化[12]。因它可进行多因素、多水平以及各因素的交互作用研究,并根据综合指标得到最优化的工艺结果,所以这种方法显示出较其他设计方法有明显的优势。本实验采用响应面法优化超声辅助提取黄皮叶总黄酮的工艺,以总黄酮提取率为指标,考察提取过程中乙醇体积分数,超声时间,和料液比对指标的影响。其中超声时间与料液比因素之间的交互作用显著。利用响应面法得到的黄皮叶总黄酮提取工艺参数真实、可靠,具有实用价值。

图4 黄皮叶总黄酮对羟自由基的清除效果Figure 4 Scavenging capacity of total flavonoids extracted from Clausena lansium leaves for hydroxyl free radicals

表5 黄皮叶总黄酮FRAP法还原能力的测定结果Table 5 Determination of total flavonoids in Clausena lansium leaves FRAP reduction ability

图5 黄皮叶总黄酮浓度与还原能力的相关性Figure 5 Relevance between total flavonoid extracted from Clausena lansium leaves and reducing ability
由实验结果可知,黄皮叶总黄酮在一定浓度条件下对·OH,DPPH自由基均具有清除作用,其清除率随质量浓度的增加而增大、具有一定的量效关系,所得的IC50分别为1.152 mg/mL,0.282 mg/mL,甚至比名贵中药,如:铁皮石斛多酚和黄铜的抗氧化性要好[13](氯仿层提取物的·OH,DPPH自由基的IC50分别为1.589 mg/mL,0.394 mg/mL)。抗氧化物质的抗氧化活性主要表现在抑制脂质氧化降解、清除自由基、抑制促氧化剂(如螯合过渡金属)、还原性或者促进机体产生内源性抗氧化物质[如抗超氧化物歧化酶(superoxide dismutase,SOD),触媒(cata-lase,CAT),谷胱甘肽(Glutataione,GSH)]等几方面[14-15]。用化学反应法测定抗氧化活性的方法有很多,大多数方法仅是对某一种自由基的清除活。铁离子还原法(FRAP)法利用Fe3+被还原成Fe2+,从而使其与三吡啶三吖嗪[2,4,6-Tri(2-pyridyl)-s-triazine,TPTZ]形成的复合物吸光度发生变化这一原理来测定样品的抗氧化活性,不是针对某一种自由基的清除活性,而是反映总的抗氧化活性。黄小桃等[2]研究发现黄皮叶具有治疗糖尿病的作用,并能有效提高糖尿病大鼠血清的抗氧化作用,改善活性氧自由基代谢紊乱。而Ma等[16]研究发现黄皮叶具有降血糖、抗氧化活性,同时张福平等[17]也发现黄皮叶中黄酮具有良好抗氧化活性。因此根据本试验结果提示这可能与黄皮叶中黄酮有关,值得进一步深入研究,如对黄皮叶总黄酮提取物进行纯化和分离,进一步确定其中的抗氧化有效成分结构,进行体内活性试验等。
现有研究表明,黄皮叶主要化学成分为氨基酸、多糖及多种黄酮类等化合物。所以,研究黄皮叶中黄酮类化合物的提取工艺及活性的作用,对充分、综合利用该物具有积极意义,且黄皮叶原料较丰富、总黄酮含量较高、黄皮叶总黄酮类清除自由基能力较强、黄酮化合物又具有多种生理活性功能,值得深入开发利用研究。
参考文献
[1]覃国忠,廖曼云.黄皮叶降血脂作用的实验研究[J].广西植物, 1987,7(2):155-158.
[2]黄小桃,李颖仪,郑侠,等.黄皮叶对链脲佐菌素诱导的糖尿病大鼠作用及机制研究[J].中药新药与临床药理, 2014, 25(6):651-656.
[3]张黎明,李春莲.大孔吸附树脂分离纯化山楂叶总黄酮的研究[J].林产化学与工业, 2006,26(1):87-90.
[4]杨静,李爽,钱芳,等.应面法优选黄蜀葵花多糖的提取工艺[J].中国药房, 2013,24(39):3688-3690.
[5]丰永红,于淑娟,李国基. DPPH法测甘蔗提取物抗氧化活性研究[J].甘蔗糖业, 2003, (1):31-33.
[6]张黎明,李瑞超,郝利民,等.响应面优化玛咖叶总黄酮提取工艺及其抗氧化活性研究[J].现代食品科技, 2014,30(4):233-239.
[7]Benzie I, Strain JJ. The ferric reducing ability of plasma(FRAP) as a measure of antioxidantpowerd: the FRAP assay[J]. Analytical biochemistry, 1996,23 (9): 70-76.
[8]Xu JR, Zhang MW, Zhang RF, et al. Correlation between antioxidation and the contentof to-talphenolics and anthocyanin in black soybean acces-sions[J]. Agricultural Sciences in China, 2007,6(2):150-158.
[9]赵文恩,李茜倩. FRAP法测定大枣枣皮红色素的总抗氧化能力[J].郑州大学学报, 2011,32(3):29-30.
[10]曹纬国,刘志勤,邵云,等.黄酮类化合物药理作用的研究进展[J].西北植物学报, 2003,23(12):2241-2247.
[11]Tao Y, Zhang Y, Cheng Y, et al. Rapid screening and identification of α-glucosidase inhibitors from mulberry leaves using enzyme-immobilized magnetic beads coupled with HPLC/MS and NMR[J]. Biomedical Chromatography, 2013,27(2):148-155.
[12]徐金龙,张红梅,徐秀泉.响应面分析法优化牡丹皮中总黄酮的提取工艺[J].中国药房, 2011,22(27):2536.
[13]黄琴,沈阳霞,张成静,等.铁皮石斛多酚黄酮含量及与抗氧化活性的相关性[J].应用与环境生物学报, 2014, 20(3):438-442.
[14]Zhi NX, Zheng XG. Scavenging and antioxidant properties of compound derived from chlorogenic acid in south-china honeysuckle[J]. LWT-Food Science and TechnoLogy, 2008, (41):1189-1203.
[15]Yu HH, Liu XG, Xing RE, et al. In vitro determination of antioxidant activity of proteins fromjelly fish rhopilemaesculentum[J]. Food Chemistry, 2006,148(95): 123-130.
[16]Ma N, Wu K, Huang L. An elegant synthesis of zetaclausenamide[J]. European Journal of Medicinal Chemistry, 2008, 43(4):893-896.
[17]张福平,汤艳姬,刘晓珍,等.黄皮叶黄酮类化合物的抗氧化性研究[J].南方农业报, 2013,44(8):1343-1346.
通讯作者:★孔繁晟,E-mail:kmkfs@163.com
基金项目:2014广东省大学生创新创业训练计划项目·广东药学院创新强校工程资助项目(201410573024)
