无载体放射性碘标记MIBG的制备及初步生物分布
2015-03-10樊彩云邓新荣刘子华李凤林罗志福
樊彩云,邓新荣,刘子华,李凤林,罗志福
(中国原子能科学研究院,北京 102413)
无载体放射性碘标记MIBG的制备及初步生物分布
樊彩云,邓新荣,刘子华,李凤林,罗志福
(中国原子能科学研究院,北京 102413)
无载体放射性碘标记间碘苄胍(no-carrier-added,n.c.a.123/131I-MIBG)在肿瘤、心肌显像和神经内分泌肿瘤的治疗方面有理论上优势。首先合成了以多氟化合物为支持体的标记前体,对该前体进行了放射性碘标记、纯化和初步生物分布实验。结果显示,无载体放射性碘125I标记MIBG在正常小鼠的心、脾、肺和肾上腺中的摄取显著高于目前商用的放射性碘标记MIBG。利用该方法标记后产物不需要使用HPLC进行纯化,适用于大规模临床应用。
间碘苄胍;无载体;多氟化合物支持体
MIBG是肾上腺素能神经元阻滞剂溴苄胺和胍乙啶的类似物,也是神经递质去甲肾上腺素的功能性类似物[1]。MIBG能与肾上腺素受体结合,且具有高度特异性,可与富含肾上腺素受体的组织和器官结合,如肾上腺髓质、心肌以及相关肿瘤。1994年美国FDA批准[131I]MIBG(Iobenguane Sulfate I 131TM,NDA20-084)用于诊断嗜铬细胞瘤和神经母细胞瘤。2008年美国FDA批准[123I]MIBG(AdreViewTM)用于儿童和成年人神经内分泌肿瘤的诊断。目前临床上使用的[*I]MIBG采用同位素交换法制备,得到的产品carrier-added(c.a.)[*I]MIBG中含有大量稳定的MIBG,比活度低,不利于疾病的诊断和治疗,用药量高时还会产生高血压、恶心、头昏等副作用。由于c.a.[*I]MIBG存在弊端,n.c.a.[*I]MIBG的制备和应用研究逐渐得到重视,研究表明,n.c.a.[*I]MIBG的诊断和治疗效果优于c.a.[*I]MIBG[2-13]。与商业化的c.a.[*I]MIBG相比,n.c.a.[*I]MIBG的制备要复杂得多。自1993年以来,相继出现了多种n.c.a.[*I]MIBG的制备方法[14-22],但大多数方法均需要在标记后使用HPLC对标记产物进行纯化,不利于大规模制备和临床应用。由于125I较123/131I易得,本工作拟利用多氟化合物支持体制备n.c.a.[125I]MIBG,并进行初步生物分布研究,该方法的优势在于标记前体的合成和标记后产物的纯化相对简单,将为n.c.a.[*I]MIBG大规模临床研究及应用提供基础。
1 实验材料
1.1 主要仪器
模拟标记产物的分析条件:安捷伦1200高效液相色谱系统,美国安捷伦公司产品;HPLC柱为ZORBAX Eclipse XDB-C18 柱(4.6×150 mm);紫外检测波长为230 nm;洗脱溶剂:20% CH3CN(0.1% H3PO4)-H2O(0.1% H3PO4)溶液,洗脱速度为1 mL/min;MIBG溶解于20% CH3CN(0.1% H3PO4)-H2O(0.1% H3PO4)溶液中,得到浓度为0.1 mg/mL的标准溶液;n.c.a.[125I]MIBG的分析条件:HPLC,Varian公司;GABI型放射性检测器:Raytest公司;C18色谱柱:Hypersil ODS,4.6×250 mm;洗脱剂A为H2O(0.1%TFA),洗脱剂B为CH3CN(0.1%TFA);梯度洗脱程序为:0~30 min,0~100%溶剂B;30~32 min,100%溶剂B;32~35 min,100~0%溶剂B。
实验动物:昆明小白鼠25只,18~20 g,清洁级,北京华阜康生物科技有限公司。
1.2 主要试剂
三(3,3,4,4,5,5,6,6,7,7,8,8-氟辛基)锡溴和氟固相萃取柱:Sigma-Aldrich公司;3-溴苄胺盐酸盐、1,2-二(氯二甲基硅)乙烷、叔丁基锂、1H-吡唑甲咪盐酸盐和FC-72(全氟己烷):Acros公司;MIBG:ABX公司;Na125I溶液:PerkinElmer公司;其他试剂均为分析纯:国药集团化学试剂有限公司。
2 实验方法
2.1 标记前体的合成
n.c.a.[*I]MIBG的制备路线如图1所示。
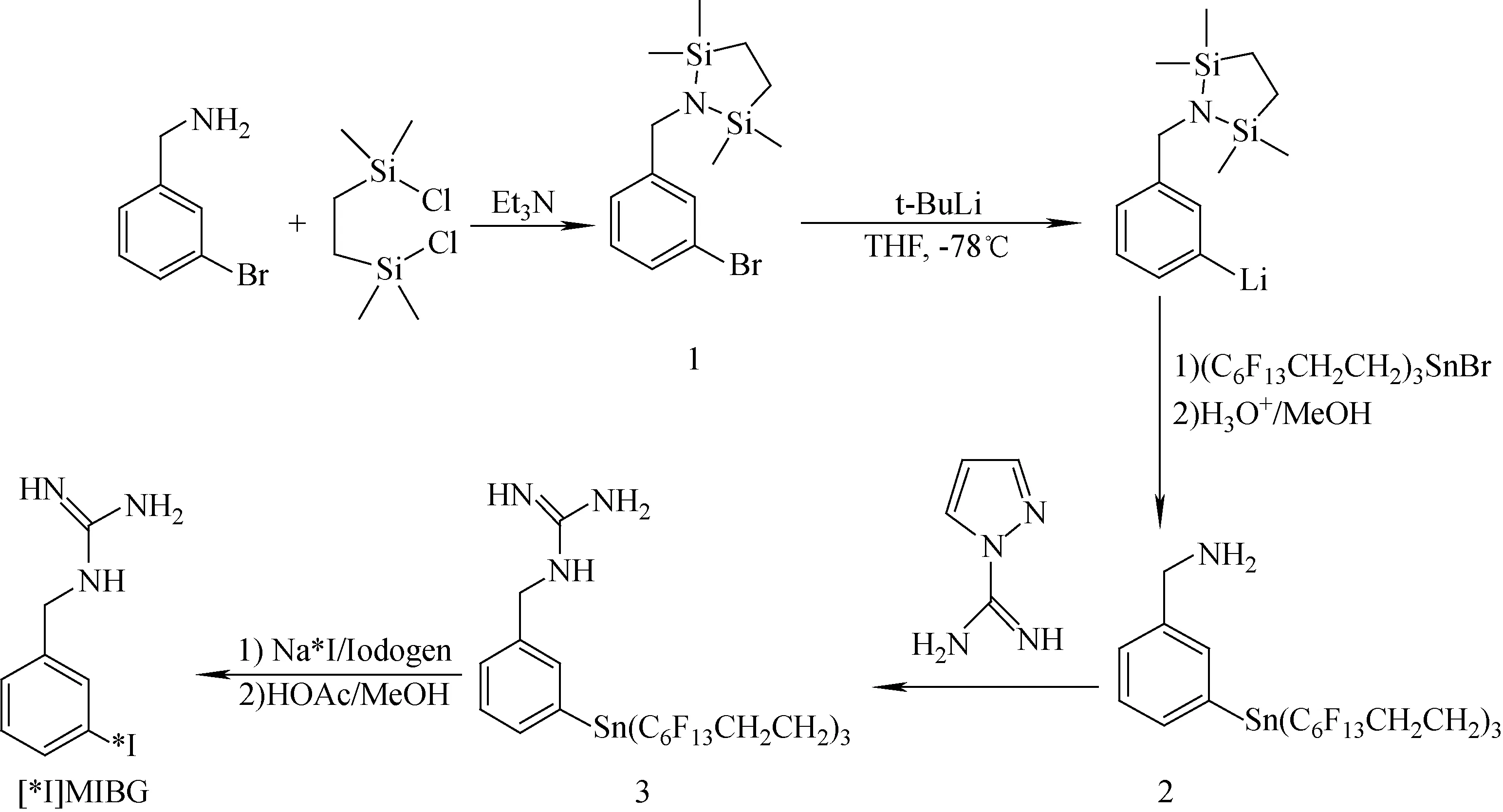
图1 n.c.a.[*I]MIBG的制备路线Fig.1 Preparation of n.c.a.[*I]MIBG
2.1.1 3-三(3,3,4,4,5,5,6,6,7,7,8,8-氟辛基)锡苄胺(化合物2)的合成
3-溴苄胺盐酸盐(0.800 g,3.6 mmol)悬浮于15 mL CH2Cl2中,用10%NaHCO3溶液洗涤,有机相用无水Na2SO4干燥过夜。抽滤,旋蒸除去溶剂,得浅黄色油状物。将此油状物(0.543 g,2.92 mmol)溶于5 mL CH2Cl2,加入Et3N(0.720 g,7.13 mmol),搅拌30 min。然后将1,2-二(氯二甲基硅)乙烷(0.654 g,2.92 mmol)溶解于CH2Cl2,并将其滴入3-溴苄胺中,在冰水浴下搅拌1.5 h后室温搅拌过夜。旋蒸除去溶剂,加入5 mL正己烷,抽滤除去不溶物,旋蒸除去溶剂后得浅黄色油状物。将该产物(200 mg,0.609 mmol)溶于10 mL THF,在-78 ℃下冷却,向其中加入叔丁基锂(1.6 mol/L,0.7 mL),滴加完毕后继续搅拌40 min。将3-三(3,3,4,4,5,5,6,6,7,7,8,8-氟辛基)锡溴(0.688 g,0.555 mmol)溶于4 mL THF并滴入反应液中,然后在-78 ℃下搅拌2 h,然后恢复至室温。向反应混合物中加入5 mL FC-72,搅拌10 min后加入10 mL CH3OH终止反应。分出FC-72相,再用FC-72萃取(5 mL×4),合并FC-72相,旋蒸除去溶剂,得无色油状物。向其中加入20 mL V(CH3OH)∶V(H2O)=9∶1溶液,用1 mol/L HCl调pH至4~5,搅拌过夜。向反应物混合物中加入4 mL 2 mol/L NaOH,搅拌5 min后旋转蒸发除去CH3OH,用FC-72萃取(5 mL×4),合并FC-72相。旋蒸除去溶剂得黄色油状物,用硅胶柱纯化得浅黄色油状物(化合物2)[20]。用核磁共振(1H NMR和13C NMR)和质谱表征结构。
2.1.2 3-三(3,3,4,4,5,5,6,6,7,7,8,8-氟辛基)锡苄胍(化合物3)的合成
将化合物2(100 mg)溶于5 mL CH2Cl2,加入1H-吡唑甲咪盐酸盐(23.15 mg,158 μmol)和Et3N(237 μmol),室温搅拌过夜。旋蒸除去溶剂,向残余物中加入5 mL FC-72,用CH3CN萃取(4 mL×3),旋蒸除去溶剂得浅黄色粘稠液体(化合物3)。用核磁共振(1H NMR和13C NMR)和质谱表征结构。
2.2 模拟标记
非放射性碘标记(模拟标记)MIBG的制备反应如图2所示。将标记前体3-三(3,3,4,4,5,5,6,6,7,7,8,8-氟辛基)锡苄胍溶于甲醇,制成20 g/L的溶液。取该溶液200 μL(3 μmol),加入10 μL乙酸,混匀。向其中加入NaI·H2O(1.7 mg,9 μmol),然后加入Iodogen(1.0 mg,2 μmol)。室温振荡4 min后加入200 μL饱和NaHSO3溶液终止反应。将反应混合物用2 mL水稀释,然后用氟固相萃取(F-SPE)柱纯化。使用前F-SPE柱先用6 mL水淋洗,再用80%的甲醇-水溶液淋洗。产物纯化时先用6 mL水洗脱,再用80%甲醇-1 mol/L乙酸溶液洗脱即可得到产物MIBG。对纯化后的产物进行质谱分析和HPLC分析。
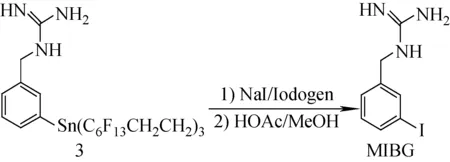
图2 模拟标记Fig.2 Non-radioactive iodination
2.3 n.c.a.[125I]MIBG的制备
将标记前体3-三(3,3,4,4,5,5,6,6,7,7,8,8-氟辛基)锡苄胍溶于甲醇,制成5 g/L的溶液。向涂有Iodogen(20 μg,0.5 g/L)的反应管中加入该溶液100 μL(5 g/L)和5 μL乙酸,混匀。然后向其中加入Na125I溶液100 μL(48.1 MBq),室温振荡4 min后加入100 μL饱和NaHSO3溶液终止反应。用Waterman滤纸为支持体,V(正丁醇)∶V(乙醇)∶V(氨水)(2 mol/L)=6∶1∶2为展开剂进行TLC分析,计算标记率。
将反应混合物用1 mL水稀释,然后用氟固相萃取柱纯化。先用6 mL水洗脱,再用6 mL 80%甲醇-1 mol/L乙酸溶液洗脱即可得到产物n.c.a.[125I]MIBG。纯化后产物的放化纯度用HPLC进行分析和计算。
2.4 n.c.a.[125I]MIBG在小鼠体内的生物分布
昆明小鼠25只,随机分成5组。尾静脉注射0.1 mL n.c.a.[125I]MIBG(约2.4×105Bq),分别在注射0.5、1 、4、8、24 h后处死,取血、甲状腺、心、肝、脾、肺、肾上腺、和肾等器官和组织,称重并用γ-计数器测量放射性计数,然后计算单位组织的放射性摄取百分比。按相同方法进行c.a.[125I]MIBG的生物分布研究。
3 结果与讨论
3.1 标记前体的合成
中间产物化合物2:产量为187 mg,产率27%。1H NMR (400 MHz, CDCl3):δ 7.37(m,3H),7.30(m, 1H),3.90(s,2H),2.31(m,6H),1.84(bs,2H),1.31(t,6H);13C NMR(150 MHz,CDCl3):δ 143.73,136.85,134.81,134.54,129.16,128.58,46.56,27.82,-1.36;MALDI-TOF:1268.2(M+H)+。
终产物3-三(3,3,4,4,5,5,6,6,7,7,8,8-氟辛基)锡苄胍(化合物3):产量为96 mg,产率为93%。1H NMR(400 MHz,CD3OD):δ 7.52~7.36(m,4H),4.43(s,2H),2.42(m,6H),1.37(t,6H);13C NMR(100 MHz,CD3OD):δ 158.78,139.93,137.83,136.97,136.11,130.10,129.20,46.09,28.73,-0.48;MALDI-TOF:1 310.4(M+H)+。
目前,固体聚合物作为标记前体支持体[15]和多氟化合物作为标记前体支持体[20]不必使用HPLC进行纯化,在标记前体的结构中引入较大相对分子质量化合物作为支持体,在标记过程中目标产物[*I]MIBG可以从支持体上脱离下来。利用支持体本身的特点通过简单的柱分离对标记产物进行纯化,该过程不需要相对复杂的HPLC系统,有利于n.c.a.[*I]MIBG的大规模制备和临床应用。采用多氟化合物作为标记前体支持体进行标记前体的合成,由于该化合物是可溶性的,能够利用传统分析技术对中间体和最终化合物进行纯化和鉴定,更有利于得到高纯度的标记前体。
3.2 模拟标记
由HPLC分析结果(图3、图4和图5)可知,在相同实验条件下模拟标记产物的保留时间与MIBG标样的保留时间一致(Rt=4.3 min)。结合质谱鉴定为(两者的分子离子峰均为276.0(M+H)+)目标产物MIBG。同时从模拟标记产物的HPLC谱图上可以看到在Rt=6.2 min处有少量杂质,通过面积计算可以得出目标产物的纯度约为98%,达到了进行标记实验的要求。

图3 模拟标记产物的HPLC谱图Fig.3 UV HPLC chromatogram of non-radioactive iodination product

图4 MIBG标样的HPLC谱图Fig.4 UV HPLC chromatogram of standard MIBG

图5 模拟标记产物和MIBG标样混合样品的HPLC谱图Fig.5 UV HPLC chromatogram of non-radioactive iodination product and standard MIBG
3.3 放射性碘标记
TLC分析结果显示产物的标记率大于90%。HPLC分析表明(图6),标记产物经F-SPE柱纯化后n.c.a.[125I]MIBG的放化纯度大于98%,放化产率约80%。说明对该标记前体进行放射性碘标记后,通过简单的氟固相萃取柱分离就可以对标记产物进行纯化,符合进行生物实验的要求。由此可见,与普通方法相比,该方法不需要使用HPLC分离即可得到高纯度的n.c.a.[*I]MIBG,可以在短时间内制备较大量的n.c.a.[*I]MIBG,更有利于n.c.a.[*I]MIBG的临床研究及应用。
3.4 n.c.a.[125I]MIBG在小鼠体内的生物分布
为了比较n.c.a.[125I]MIBG和c.a.[125I]MIBG在正常生物体内的分布信息,同时进行了n.c.a.[125I]MIBG和c.a.[125I]MIBG在正常小鼠体内的生物分布实验,结果分别如表1和表2所示。并对n.c.a.[125I]MIBG和c.a.[125I]MIBG两组数据进行了统计学分析。

图6 n.c.a.[125I]MIBG的HPLC分析图谱Fig.6 γ-HPLC chromatogram of n.c.a.[125I]MIBG
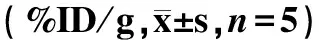
表1 n.c.a.[125I]MIBG在正常小鼠体内的生物分布Table 1 Biodistribution of n.c.a.[125I]MIBG in normal mice
注:1) P<0.05,2) P<0.01
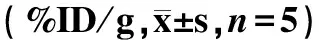
表2 c.a.[125I]MIBG在正常小鼠体内的生物分布Table 2 Biodistribution of c.a.[125I]MIBG in normal mice
从表1和表2可以看出,n.c.a.[125I]MIBG和c.a.[125I]MIBG在正常小鼠的心、脾、肺和肾上腺中的分布存在显著性差异,且n.c.a.[125I]MIBG的心/肝、心/肺放射性摄取比也高于c.a.[125I]MIBG,该结果与文献报道一致[14]。说明n.c.a.[125I]MIBG的高比活度(约81.4 GBq/μmol比c.a.[125I]MIBG的比活度高出104~105倍)使含有肾上腺受体的器官中的放射性摄取提高,同时也提高了心肌和临近器官(肝、肺)的比值。从理论上来说,n.c.a.[123I]MIBG可以提高c.a.[123I]MIBG的显像质量[4-9,13],n.c.a.[131I]MIBG可以增强治疗效果[9-12],降低[131I]MIBG的副作用,并能快速给药。因此,无载体放射性碘标记MIBG可能在临床诊断和治疗方面存在很大优势。目前临床研究的结果支持n.c.a.[123/131I]MIBG的临床应用,但是还需要进一步的临床试验证明其有效性是否与c.a.[123/131I]MIBG不同以及提供安全性方面的信息。
4 结论
本研究利用多氟化合物支持体成功制备了n.c.a.[125I]MIBG的标记前体,并进行了放射性碘标记和初步生物分布研究。HPLC分析表明,标记产物经氟固相萃取柱纯化后n.c.a.[125I]MIBG的放化纯度大于98%。由于该方法不需要使用HPLC分离即可得到高纯度的n.c.a.[*I]MIBG,可以在短时间内制备较大量的n.c.a.[*I]MIBG,更有利于n.c.a.[*I]MIBG的临床研究及应用。
[1] 罗全勇. MIBG及其衍生物的研究进展[J]. 国外医学·放射医学核医学分册,2002,26:216-219.
Luo Quanyong. The recent research progress of MIBG and its derivatives[J]. Foreign Med Sci Sec Radiat Med Nucl Med, 2002, 26: 216-219(in Chinese).
[2] Wafelman A R, Konings MCP, Hoefnagel C A, et al. Synthesis, radiolabelling, and stability of radioiodinated m-iodobenzylguanidine, a review[J]. Appl Radiat Isot, 1994, 45: 997-1 007.
[3] Vaidyanathan G and Zalutsky M. No-carrier-added meta-[123I]iodobenzylguanidine: synthesis and preliminary evaluation[J]. Nucl Med Biol, 1995, 22: 61-64.
[4] Samnick S, Bader J B, Müller M, et al. Improved labelling of no-carrier-added123I-MIBG and preliminary clinical evaluation in patients with ventricular arrhythmias[J]. Nucl Med Commun, 1999, 20: 537-545.
[5] Owens J, Bolster A A, Prosser J E, et al. No-carrier-added123I-MIBG: an initial clinical study in patients with phaeochromocytoma[J]. Nucl Med Commun, 2000, 21: 437-440.
[6] Knickmeier M, Mathejia P, Wichter T, et al. Clinical evaluation of no-carrier-added meta-[123I]iodobenzylguanidine for myocardial scintigraphy[J]. Eur J Nucl Med, 2000, 27: 302-307.
[7] Knickmeier M, Schafers M and Schober O.Two years’ experience using no-carrier-added meta-[123I]iodobenzylguanidine in clinical studies[J]. Eur J Nucl Med, 2001, 28: 941.
[8] Verberne H J, Bruin K, Habraken J B A, et al. No-carrier-added versus carrier-added123I-metaiodobenzylguanidine for the assessment of cardiac sympathetic nerve activity[J]. Eur J Nucl Med Mol Imaging, 2006, 33: 483-490.
[9] Barrett J A, Loyal J L, Hillier S M, et al. Comparison of high-specific-activity ultratrace123/131I-MIBG and carrier added123/131I-MIBG on efficacy, pharmacokinetics , and tissue distribution[J]. Cancer Biother Radiopharma, 2010, 25: 299-308.
[10]Coleman R E, Goldsmith S J, Noto R B, et al. One Year Follow-Up for the Phase I MTD Study of Ultratrace Iobenguane I-131 in Patients with Malignant Pheochromocytoma/Paraganglioma (Pheo)[J]. Abstracts Presented at the 2nd Annual Meeting of the North American Neuroendocrine Tumor Society, Pancreas, 2010, 39: 272.
[11]Matthay K K, Weiss B D, Villablanca J, et al. Dosimetry, toxicity, and response in a phase IIa trial of no-carrier added iobenguane I-131(nca-MIBG): A New Approach to Neuroblastoma Therapy (NANT) study[J]. J Clin Oncol (Meeting Abstracts), 2011, 29: suppl 9512.
[12]Pryma D A, Barrett J A, Coleman R E, et al. Preliminary data from an ongoing phase IIb study of no carrier added131I-iobenguane(nca-MIBG) in patients with malignant pheochromocytoma (Pheo)[J]. J Clin Oncol (Meeting Abstracts), 2011, 29: suppl e21122.
[13]Chin B B, Kronauge J F, Femia F J, et al. Phase-1 clinical trial results of high-specific-activity carrier-free123I-iobenguane[J]. J Nucl Med, 2014, 55: 765-771.
[14]Vaidyanathan G, Zalutsky M. No-carrier-added synthesis of meta-[131I]iodobenzyl guanidine[J]. Appl Radiat Isot, 1993, 44: 621-628.
[15]Hunter C, Zhu X. Polymer-supported radiopharmaceuticals: [131]MIBG and [123]MIBG[J]. J Label Compd Radiopharm, 1999, 42: 653-661.
[16]He Y, Das B, Baruchel S, et al. Meta-[123I]iodobenzylguanidine is selectively radiotoxic to neuroblastoma cells at concentrations that spare cells of haematopoietic lineage[J]. Nucl Med Commun, 2004, 25: 1 125-1 130.
[17]Hunter D H, Goel A, Flanagan R J. Process for the preparation of radiolabeled meta-halobenzylguanidine: EP, 0693476[P]. 1996-4.
[18]Donovan A, Forbes J, Dorff P, et al. A new strategy for preparing molecular imaging and therapy agents using fluorine-rich (fluorous) soluble supports[J]. J Am Chem Soc, 2006, 128: 3 536-3 537.
[19]Vaidyanathan G, Affleck J D, Alstonk L, et al. A tin precursor for the synthesis of no-carrier-added [*I]MIBG and [211At]MABG[J]. J Label Compd Radiopharm, 2007, 50: 177-182.
[20]Donovan A C and Valliant J F. A convenient solution-phase method for the preparation of meta-iodobenzylguanidine in high effective specific activity[J]. Nucl Med Biol, 2008, 345: 741-746.
[21]Dzandzi J P, Vera D R, Valliant J F. A hybrid solid-fluorous phase radioiodination and purification platform[J]. J Labelled Comp Radiopharm, 2014, 57: 551-557.
[22]Hu B, Blecha J, Neumann K, et al. A new efficient synthesis of no carrier added radioiodinated tracers[J]. J Nucl Med, 2014, 55(Suppl 1): 1 181.
Preparation and Preliminary Biodistribution of No-Carrier-Added Meta[*I] iodobenzylguanidine
FAN Cai-yun, DENG Xin-ring, LIU Zi-hua, LI Feng-lin, LUO Zhi-fu
(ChinaInstituteofAtomicEnergy,Beijing102413,China)
No-carrier-added meta-[*I]iodobenzylguanidine((n.c.a.)[123/131I]MIBG) has been considered to be promising diagnostic agents for oncology and cardiology, or as targeted radiotherapeutics for neuroendocrine tumors. The synthesis of a fluorous supported precursor for the purification without HPLC of n.c.a.[*I]MIBG was presented and its structure was determined. The precursor was labeled with radioactive iodine and the preliminary biodistribution of n.c.a.[*I]MIBG was studied. The uptake of n.c.a.[125I]MIBG were significantly higher than that of c.a.[125I]MIBG in heart, spleen, lung and adrenals. This facile preparation method of n.c.a.[*I]MIBG would allow its wider application in clinic.
MIBG; no-carrier-added; fluorous supported; radioactive iodine labeling
10.7538/tws.2015.28.03.0148
2015-03-31;
2015-05-11
樊彩云(1977—),女,河南浚县人,副研究员,放射性药物专业
罗志福,研究员,博士研究生导师,E-mail: luozhifu@ciae.ac.cn
TL92+3
A
1000-7512(2015)03-0148-07
