来昔决南钐[153Sm]注射液质量控制标准
2015-03-10王晓静叶肇云张文在
付 博,王晓静,叶肇云,张 云,张文在
(原子高科股份有限公司,北京 102413)
来昔决南钐[153Sm]注射液质量控制标准
付 博,王晓静,叶肇云,张 云,张文在
(原子高科股份有限公司,北京 102413)
建立了来昔决南钐[153Sm]注射液的质量控制指标及方法,主要包括pH检查、细菌内毒素检查、无菌检查、性状鉴别、含游离依地四膦酸量、来昔决南钐含量、放射性核纯度、放化纯度、放射性浓度。分析方法适用于来昔决南钐[153Sm]注射液的常规检验,为该药的质量控制提供了可靠的分析手段。
放射性药物;来昔决南钐[153Sm]注射液;质量控制
来昔决南钐[153Sm]注射液是一种疗效较好的放射性治疗药物[1-3],已被美国药典收录[4]。其中采用澄明度测定法对本药品进行性状检查,γ能谱法进行核素鉴别,pH计测定法对其进行pH检查,并用柱色谱法进行放化纯度测定,但未进行放射化学性质鉴别,也未对含游离依地四膦酸量、含钐量做出要求。在其细菌内毒素检查项下规定,每毫升不超过 (175/V) EU,其中V是在有效期最大推荐剂量。在无菌检查项下,采用了金黄色葡萄球菌、枯草芽孢杆菌、绿脓杆菌、产芽孢梭状芽孢杆菌、白色念珠菌、黑曲霉菌作为培养基适用性检查和方法验证实验菌种。对于含153Sm核素药物采用校准过的系统装置测放射性比活度。对放射性核纯度的测定,只简单分析了样品中的153Sm和杂质154Eu ,没有对样品中152Eu、155Eu 、156Eu杂质核素进行分析;核素鉴别只对153Sm的70 keV和103 keV两个主要能量进行了分析,没有对41 keV和47 keV两个X射线能量进行分析。现行版中国药典目前未收录来昔决南钐[153Sm]注射液品种,国家药品食品监督管理局已于2000年颁布了新药试行标准WS-790(X-696)-2000[5],并于2005年将该试行标准转正。我国对该新药现已经过长达10年的监督使用,可将其列为中国药典的新品种,并建立相应的药典标准及分析控制方法,本研究对来昔决南钐[153Sm]注射液的各项质控指标的控制方法进行了实验设计并验证,可为中国药典对来昔决南钐[153Sm]注射液的收录提供技术支持。
1 实验材料
1.1 仪器
YD-2型澄明度检测仪:天津市光学仪器厂产品;UV-2450型分光光度计:日本岛津公司产品;AB135-S梅特勒电子分析天平:瑞士梅特勒公司产品;DHP-9272型恒温培养箱:上海一恒科技有限公司产品;自动化4π(LS)符合装置:中国原子能科学研究院;高纯锗γ谱仪:美国奥泰克公司产品;CRC-15W型活度计:美国奥泰克公司产品;AR2000放射性色层扫描仪:美国BIOSCAN仪器公司产品。
1.2 主要试剂
精密pH试纸:上海三爱思科技有限公司产品;系列浊度标准液:美国戴安公司产品;标准比色液:美国赛默飞世尔科技公司;锌标准滴定液为标准品,购于国家标准物质研究中心;氨水、氯化铵、偶氮胂Ⅲ均为分析纯,购于国药集团化学试剂有限公司;来昔决南钐[153Sm]注射液、153SmCl3:原子高科股份有限公司提供;水为去离子水;系列菌种:购于中国药品生物制品检定所;培养基:北京三药科技有限公司产品;内毒素标准品:购于中国药品生物制品检定所;鲎试剂:厦门鲎试剂实验厂有限公司。
2 实验方法
2.1 性状
2.1.1 澄明度测定
取供试品溶液和浊度标准液于玻璃管中,在浊度标准液制备5 min后,在YD-2型澄明度检测仪下,照度为1 000 lx,从水平方向观察比较澄清度[6]。
2.1.2 颜色检查
取来昔决南钐[153Sm]注射液2 mL置于25 mL的纳氏比色管中,加水稀释至10 mL。另取棕红色3号标准比色液10 mL,两管同置白色背景上,自上向下透视。或同置白色背景前,平视观察。比较时可在自然光下进行,以漫射光为光源,供试品管呈现的颜色与对照管比较。
2.2 化学鉴别
1) 用玻璃毛细管将来昔决南钐 [153Sm]注射液和标准品分别点在距色层纸一端2 cm处,加样点直径小于5 mm,平行点样两点,用吹风机吹干。
2) 放入盛有展开剂(水:氨水=50∶2)的层析缸中[7],使纸条(点样一端)浸入展开剂中深约1 cm,展开约10 min,展开剂前沿至10 cm时取出纸条,用吹风机吹干。
3) 将色层纸剪成2 cm×14 cm,在AR2000放射性色层扫描仪上测量本记录放射性计数,测其Rf值,确定其各自在固定相上的位置。
2.3 pH检验
1) 首先将样品溶液点样于广泛pH试纸上,初步测定溶液的pH范围。
2) 根据初步测定的pH范围,选用校准过的精密pH试纸再次滴加样品,0.5 s后对照试纸标准色板,最后确定样品溶液pH。
2.4 放化纯度检验
1) 用玻璃毛细管将来昔决南钐[153Sm]注射液点在距色层纸一端2 cm处,加样点直径小于5 mm,平行点样两点,用吹风机吹干。
2) 放入盛有展开剂的层析缸中,使纸条(点样一端)浸入展开剂中深约1 cm,展开剂前沿至10 cm时取出纸条,用吹风机吹干。
3) 将色层纸剪成2 cm×10 cm,在AR2000放射性色层扫描仪上测量本记录放射性计数。
放化纯度%=[(主峰计数-主峰本底计数)÷
(总计数-总本底计数)]×100%
分别配制两种不同展开剂① V(水)∶V(氨水)=50∶2;② 水∶氨水∶氯化铵=40 mL∶2 mL∶2 g,进行分离度考察,选择分离较好的展开剂体系。
2.5 153Sm含量分析
2.5.1 吸收光谱
在5 mL容量瓶中,加入0.8 mL含153Sm 15 mg/L的来昔决南钐[153Sm]溶液,1.5 mL 2.4 g/L偶氮胂Ⅲ(ARS Ⅲ)溶液,0.5 mL 1 mol/L HCl溶液,加水稀释至刻度,显色5 min。以试剂空白为参比,用1 cm比色皿在分光光度计上,在500 nm~800 nm波长范围内测体系的吸光度,绘制吸收光谱,根据实验结果选择测量波长。
2.5.3 ARS Ⅲ用量的选择
按前述方法,考察2.4 g/L ARS Ⅲ用量分别在0.5、 1.0、1.5、2.0、2.5 mL时体系的吸光度,选择出显色剂的合适用量。
2.5.4 工作曲线
分别取浓度为15 mg/L的来昔决南钐[153Sm]溶液0、0.2、0.4、0.6、0.8 mL于5只5 mL容量瓶中,各加入2.4 g/L ARS Ⅲ溶液1.5 mL, 1 mol/L HCl溶液0.5 mL,加水稀释至刻度,摇匀。以试剂空白为参比,用1 cm比色皿在655 nm处测定吸光度,以153Sm含量为横轴,吸光度为纵轴,绘制工作曲线。
2.5.5 稳定性实验
按上述方法,考察了反应时间在1 h内对显色体系吸光度的影响。
2.5.6 精密度实验
在选定的条件下,配制两批不同浓度的来昔决南钐[153Sm]模拟样品进行精密度实验,平行测定6次153Sm含量,计算相对标准偏差(RSD)。
2.5.7 回收率实验
在所测的两批样品中分别加入含153Sm 3.000、4.500、6.000 μg的153Sm标准溶液,进行回收率实验。
2.6 依地四膦酸(EDTMP)含量的测定
2.6.1 限量测定法
取23 mL 0.005 mol/L锌滴定液于锥形瓶中,加一滴甲基红指示剂,用氨水调溶液颜色由红变黄,加氨-氯化胺缓冲溶液(pH为10.0)10 mL,以铬黑T为指示剂,取1 mL样品溶液加入其中,根据颜色变化判断来昔决南钐的限量浓度[8]。
2.6.2 限量法与滴定法对比
合成了5批不同EDTMP含量的来昔决南钐[153Sm]样品,每批取相同的两份,一份按限量法测定,另一份滴加0.005 mol/L锌滴定液,按上述实验方法进行滴定,验证限量法结果。
2.7 无菌检查
方法验证试验与培养基适用性检查同时进行。取符合直接接种法培养基用量(本实验中,每管培养基的量为7.5 mL)要求的硫乙醇酸盐流体培养基和改良马丁培养基管,分别接种0.5 mL,小于100 cfu的菌液。大肠埃希菌接种4管,金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、生孢梭菌各接种5管,分别接种在硫乙醇酸盐流体培养基。白色念珠菌、黑曲霉分别接种到5管改良马丁培养基。除接种大肠埃希菌的培养基,其余6种菌每种菌2管用于培养基灵敏度检查(兼作阳性对照),大肠埃希菌1管用于阳性对照,7种菌均取3管用于供试品的无菌检查方法验证。
取装量为7.5 mL的硫乙醇酸盐流体培养基和改良马丁培养基,将三个批次供试品分别接种到培养基中,作为供试品检查管,每个供试品每种培养基各接种2管,每管接种0.2 mL供试品。取上述7种菌各3管分别加入三个批次的供试品各0.2 mL,作为供试品阳性对照管。另外取装量为7.5 mL的硫乙醇酸盐流体培养基和改良马丁培养基各5管培养,作为阴性对照。将阴性对照、阳性对照、供试品阳性对照、供试品检查及培养基灵敏度检查各管转至培养箱培养。硫乙醇酸盐流体培养基33 ℃培养,改良马丁培养基25 ℃培养。接种菌液的阳性对照、供试品阳性对照及培养基灵敏度检查管细菌培养3 d,真菌培养5 d,供试品管及阴性对照管培养14 d,逐天观察结果。用于灵敏度检查和对照的7种菌液均用平板计数。金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、枯草芽孢杆菌、生孢梭菌等细菌的计数采用营养琼脂培养基,白色念珠菌、黑曲霉菌等真菌的计数采用玫瑰红钠琼脂培养基。每皿加入1 mL菌液,浇注约20 mL培养基,混匀,冷却凝固后倒置培养。生孢梭菌放入厌氧袋中厌氧培养。细菌培养3 d,真菌培养5 d,观察结果。
2.8 细菌内毒素检查
2.8.1 鲎试剂灵敏度复核
取批号100814,灵敏度为0.5 EU/mL的鲎试剂18支,每支加入0.1 mL细菌内毒素检查用水溶解,置于试管架上,排成5列,其中4列4支,一列2支。4列4支每列每支加入0.1 mL的2λ、λ、0.5λ和0.25λ的内毒素标准溶液;另2支加入0.1 mL检查用水。封口,混匀,放入37 ℃水浴中,保温60 min,将试管从恒温器中轻轻取出,缓缓倒转180°时,若管内形成凝胶,并且凝胶不变形、不从管壁滑脱者为阳性;形成的凝胶不坚实、变形或从管壁滑脱者为阴性。按下式计算反应终点浓度的几何平均值,即为鲎试剂灵敏度的测定值(λc)。
λc=lg-1(∑X/4)
2.8.2 干扰实验
将批号为20101016的来昔决南钐[153Sm]注射液用细菌内毒素检查用水稀释成10倍、20倍、30倍系列,分别添加2λ、λ、0.5λ和0.25λ标准品至供试液,实验阳性对照是否成立,并设立阳性对照、阴性对照。按鲎试剂灵敏度复核实验项下操作,按下式计算阳性对照和供试品阳性对照的反应终点浓度的几何平均值(Es和Et)。
Es=lg-1(∑Xs/4)
Et=lg-1(∑Xt/4)
2.9 放射性活度测量
取来昔决南钐[153Sm]注射液10 μL到聚乙烯样品瓶中,用去离子水将样品稀释到适宜体积,使样品体积与标定时基本一致,将样品瓶放入活度计中测量153Sm的活度。
2.10 核素鉴别和核纯度测量
2.10.1 操作步骤
取样器移取活度约10 mCi的153SmCl3溶液样品转移至聚乙烯样品瓶内。将样品放入吸收套中,在高纯锗γ谱仪上探测器上方15 cm处进行测量,测量时间要足够长,使主要γ特征峰统计误差小于1% 。应用SPAN 98 SYSTEM解谱软件,在一号效率曲线进行谱数据分析,得到153Sm及各杂质核素的活度。
2.10.2 仪器的能量刻度
使用152Eu、241Am、137Cs、60Co等核素进行拟合,在高纯锗γ谱仪上测量、存谱、解谱和能量刻度,使得仪器在该能量下得到准确校准。
2.10.3 核素鉴别
使用0.2毫升的取样器,取20 μL153SmCl3转入塑料瓶内,放入仪器适当位置进行测量,可得到153Sm能量显示。
2.10.4 核纯度检验
按实验方法确定各种核素的活度,某单一核素的活度除以全部核素活度之和,为某核素在样品中的核纯度。
3 结果与讨论
3.1 性状检查
本实验使用供试品溶液与浊度标准液比较确定澄明度,与棕红色3号标准比色液比色确定颜色检查,样品溶液浊度和颜色均浅于标准液。样品对比实验均能得到准确的判定结果,方法简便、可行。
由于样品具有放射性,产品出厂性状检查时,应取供试品隔铅玻璃肉眼粗略观察,待放置10个半衰期后,放射性已基本衰变完全,再采用此法回顾性检查,建议每季度检查一次。
3.2 化学鉴别
分别将SmCl3和来昔决南钐[153Sm]标准品点在色层纸上,在展开剂中展开至12 cm,重复展开实验3次,色谱扫描结果见图1。在以V(水)∶V(氨水)=50∶2为展开剂的系统中展开后,来昔决南钐[153Sm]的Rf为0.9~1.0,153Sm3+的Rf为0.0~0.1。

图1 153Sm3+和来昔决南钐[153Sm]在色层纸上的位置Fig.1 The location of 153Sm3+ and samarium 153Sm at paper chromatography
3.3 pH检验
根据来昔决南钐[153Sm]注射液具有放射性的特点,为避免较多废物的产生,本法采用pH试纸检测法测定产品的pH,该方法操作简单,测定速度快,准确度好,是一种简便、快速测定来昔决南钐[153Sm]注射液pH的方法。
3.4 放化纯度检验
将混合样品分别在四种展开剂体系中展开,考察其分离度,结果列于表1。如表1所示,分离度均在 3.6~3.9之间,符合纸色谱分离要求。体系V(水)∶V(氨水)=50∶2为展开剂、Whatman No.540为固定相进行来昔决南钐[153Sm]的放化纯度分析时分离度最高,配制最简便,故选用此体系为展开条件。
3.5 153Sm含量分析

表1 分离度实验结果Table 1 The result of separations
3.5.1 吸收光谱
体系显色后,吸收光谱扫描结果见图2,从图2可以看出,在波长655 nm处体系的吸光度最大且稳定,故选择655 nm作为测量波长。

图2 吸收光谱Fig.2 The scanning result of absorbing wavelength
3.5.2 ARS Ⅲ用量的选择
2.4 g/L ARS Ⅲ用量对吸光度的影响示于图3。从图3可以看出,2.4 g/L ARS Ⅲ溶液的用量在1.5 mL时,吸光度最大,所以选择2.4 g/L ARS Ⅲ溶液的用量为1.5 mL。
3.5.3 工作曲线
工作曲线示于图4,153Sm浓度在0~2.4 mg/L范围内,工作曲线的线性关系良好,线性回归方程为y=0.076 37x+0.014 59,r2=0.998 99。
3.5.4 稳定性实验
确定了实验条件后,考察了反应时间对显色体系吸光度的影响,该体系显色迅速,并且至少可以稳定1 h。

图3 2.4 g/L ARS Ⅲ用量对吸光度的影响Fig.3 The effect of quantity of ARS Ⅲ
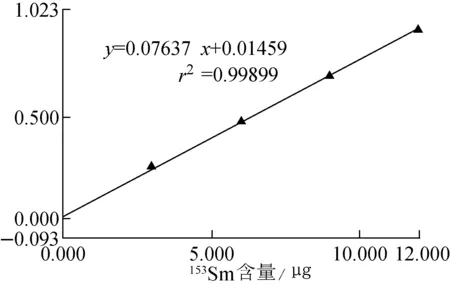
图4 工作曲线Fig.4 The standard work curve
3.5.5 精密度实验
精密度结果列于表2,由表2可见,通过对两批不同浓度的来昔决南钐[153Sm]模拟样品进行的平行6次153Sm含量测定,RSD≤1.9%,精密度良好。
3.5.6 回收率实验
回收率实验结果列于表3,由表3可知,该方法的回收率在94.7%~99.7%之间。
3.5.7 产品检验应用
153Sm含量测定需要样品量较大,放射性辐射较大,考虑到153Sm含量在工艺生产中的控制较为稳定,在产品放行前不必每次都进行检查,建议每半年抽检一次,进行回顾性检验。
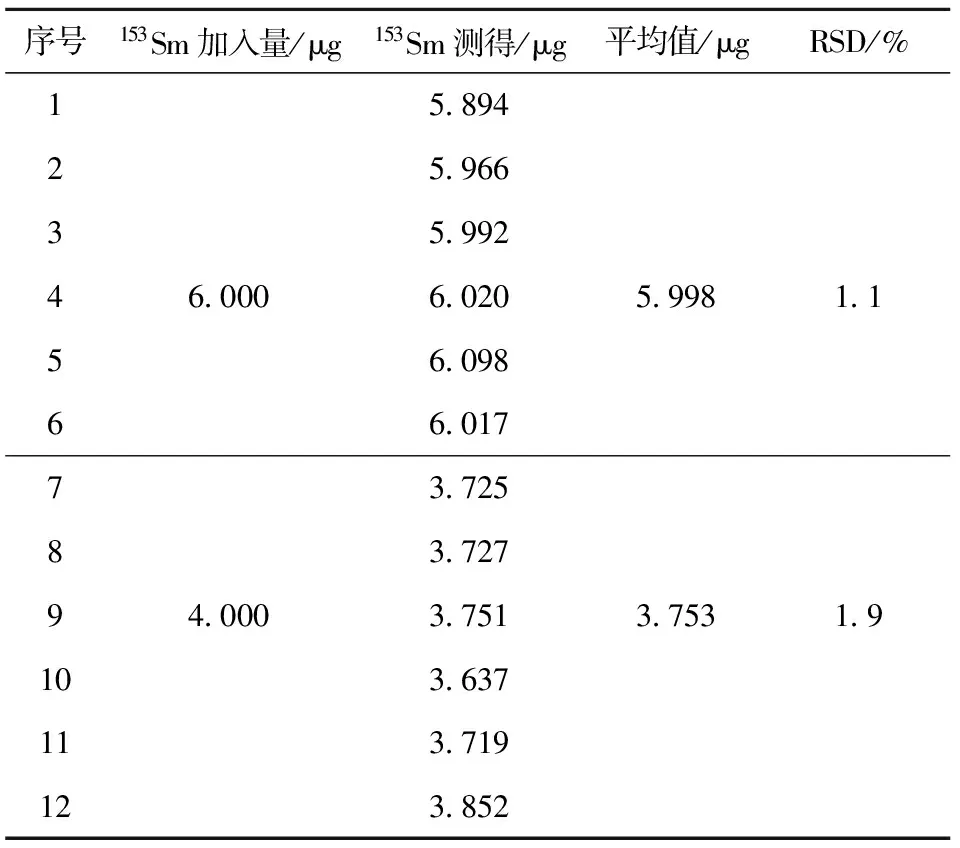
表2 精密度实验Table 2 The result of the precision

表3 回收率实验Table 3 The recovery rate of 153Sm
3.6 EDTMP含量的测定
合成了5批来昔决南钐[153Sm]样品,按上述实验方法限量测定,并进行平行滴定,结果见表4。由表4数据可见,在限量法中若溶液变为纯蓝色,表明游离的EDTMP浓度大于50 g/L,溶液仍呈紫红色,则表明游离的EDTMP浓度小于50 g/L。EDTMP测定在产品放行前液不必每次都进行检查,建议每半年抽检一次,进行回顾性检验。

表4 EDTMP含量测定Table 4 The detection of EDTMP
3.7 无菌检查
无菌检查结果表明,培养基适用性符合规定,菌液计数列于表5,方法学验证列于表6。结果表明,每管培养基中接种菌液的量均小于100 cfu。各批供试品检查均呈阴性,接种了实验菌的各供试品阳性管均生长良好。判定供试品的检验量在检验条件下无抑菌作用或其抑菌作用可以忽略不计,可以照此检查方法和检查条件进行供试品的无菌检查。
3.8 细菌内毒素检查
3.8.1 鲎试剂灵敏度复核
鲎试剂灵敏度复核结果见表7,其中“+”表示鲎试剂与内毒素反应呈阳性,“-”表示呈阴性,表明复核的灵敏度(λc)在规定的允许范围内,即λc为0.5λ~2λ。

表5 菌液计数结果Table 5 The statistics of bacteria liquid
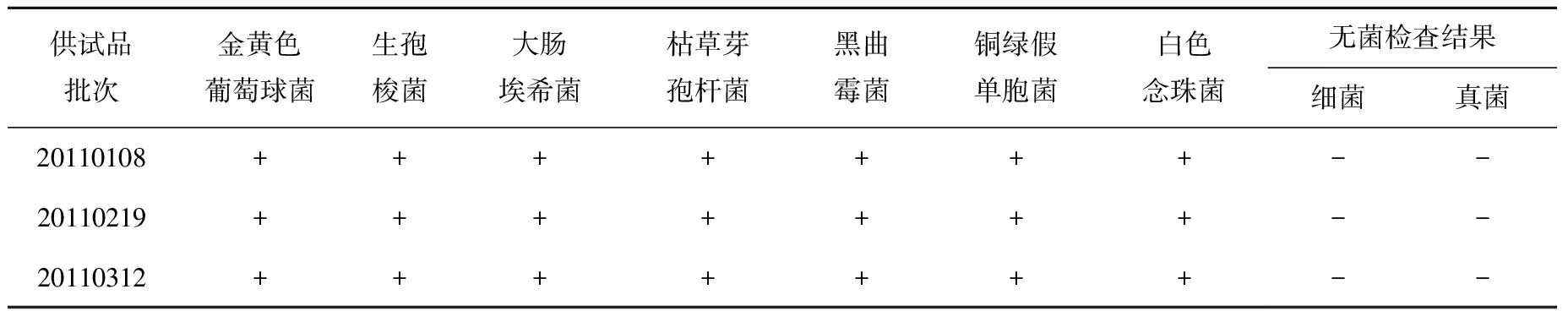
表6 来昔决南钐-153Sm注射液无菌检查方法学验证结果Table 6 The methodological validation of sterility test

表7 鲎试剂灵敏度复核Table 7 Sensitivity check of tachypleus amebocyte lysate(TAL)
3.8.2 干扰实验
干扰实验结果见表8。由表8可知,反应终点浓度,Es= 0.30 EU/mL, 10倍稀释液Et>1 EU/mL,20倍稀释液Et=0.59 EU/mL,30倍稀释液Et=0.50 EU/mL。按药典Et应为0.5Es~2Es判断,10倍稀释液有抑制,30倍稀释液无干扰,20倍稀释液反应终点浓度与鲎试剂灵敏度对照系列终点浓度的2倍接近,故认为最好稀释30倍检查。
3.9 放射性浓度测量
153Sm属于β-(γ)衰变的核素。以自制的自动化4π(LS)符合装置,用4π(LS)β-γ符合方法绝对测量了153Sm溶液的放射性浓度。从153Sm样品中取样10 μL放入液闪瓶经活度计测量放射性浓度为8.25 Ci/L,经4π(LS)β-γ符合方法绝对测量放射性浓度为12.55 Ci/L,即活度计修正系数为:1.52倍。
通过用4π(LS)β-γ符合方法绝对测量153Sm放射性活度,建立标准样品,将该量值传递到活度计,从而得出活度计修正系数,为以后用放射性活度计直接测量153Sm带来方便快捷。
3.10 核素鉴别和核纯度测量
高纯锗γ谱仪测得153Sm下列能量显示:103.18 keV、69.67 keV、41 keV、47 keV,符合153Sm能谱分布,确定其为153Sm核素。对样品核纯度分析结果示于表9。由表9可见,153Sm放射性样品的材料来源152Sm2O3,尽管是富集靶材,但是仍然有极其微量的其他杂质核素存在,并有多个同位素152Eu、154Eu、155Eu和156Eu。产品中153Sm含量应不低于99.0%,其他杂质总量不高于1.0%。

表8 干扰试验Table 8 The test of interference with TAL

表9 153Sm放射性样品的核纯度分析结果Table 9 The radionuclide purity of 153Sm sample
4 结论
建立的来昔决南钐-153Sm注射液的质量控制指标及方法,符合放射性药品的质量控制标准,适合对来昔决南钐-153Sm注射液产品的检验要求。该方法对放射性新药的研发及注册具有重要的参考价值。
[1] Bayouth J E, Maccy D J, Kasi L P, et al. Dosimetry and toxicity of samarium-153-EDTMP administered for bone pain due to skeletal metastases[J]. J Nucl Med, 1994, 35(1): 63-69.
[2] Luis Correa-González, Consuelo Arteaga de Murphy, Pablo Pichardo-Romero, et al.153Sm-EDTMP for Pain Relief of Bone Metastases from Prostate and Breast Cancer and Other Malignancies[J]. Archives of Medical Research, 2014, 45(4): 301-308.
[3] Richard K, Valicenti E T, Charles I, et al. A Phase I Trial of Samarium-153-Lexidronam Complex for Treatment of Clinically Nonmetastatic High-Risk Prostate Cancer: First Report of a Completed Study[J]. International Journal of Radiation Oncology Biology Physics, 2011, 79(3): 732-737.
[4] The United States Pharmacopeial Convention.USP36-NF31[M]. USA: United States Pharmacopeia, 2012: 3536.
[5] 国家食品药品监督管理局国家药品标准WS1-(X-096)-2005Z[S]. 北京:国家食品药品监督管理局,2005.
[6] 国家药典委员会. 中华人民共和国药典[ M ] . 二部. 北京:化学工业出版社,2005:附录181-182.
[7] 柳银黎,尹光荣,付博,等.177Lu-EDTMP放化纯分析方法的建立[J]. 同位素,2010,23(3):163-165.
Liu Yin Li, Yin Guang rong, Fu Bo, et al. Establishment of analysis method for the radiochemical purity of177Lu-EDTMP[J]. Journal of Isotopes, 2010, 23(3): 163-165(in Chinese).
[8] 周清海,罗成竹,单秀娟. 交流示波极谱滴定的研究—EDTMP螯合滴定锌[J]. 广州工业大学学报,1990,2:57-61.
Quality Control Standard of Samarium Sm-153 Lexidronam Injection
FU Bo, WANG Xiao-jing, YE Zhao-yun, ZHANG Yun, ZHANG Wen-zai
(AtomHighTechCO.LTD.,Beijing102413,China)
The quality control indices and analysis methods for Samarium Sm-153 Lexidronam Injection were established including radionuclide purity, sterility test, bacterial endotoxin, radionuclide identification , radiochemical purity, EDTMP, samarium , pH, radioactive. The solution is applicable for the routine inspection of Samarium Sm 153 Lexidronam Injection, It provides a reliable analysis method for the drug quality control.
radiopharmaceuticals; samarium Sm-153 lexidronam injection; quality control
10.7538/tws.2015.28.03.0140
2015-04-30;
2015-05-08
付 博(1984—),男,辽宁朝阳人,工程师,主要从事放射性同位素技术方面工作
TL92+3
A
1000-7512(2015)03-0140-08
