舟山黄海葵粗提物抗人肺癌SPC-A1细胞的活性研究
2015-03-09张亚茹罗李王杨最素赵玉勤余方苗丁国芳浙江海洋学院食品与医药学院浙江省海洋生物医用制品工程技术研究中心浙江舟山316022
张亚茹,罗李王,杨最素,赵玉勤,余方苗,王 飞,丁国芳(浙江海洋学院食品与医药学院/浙江省海洋生物医用制品工程技术研究中心,浙江舟山 316022)
海葵(Sea anemone)又称海菊花,是腔肠动物门珊瑚虫纲海葵目的一种较原始的动物,共有6科37种,广泛分布于温热带海域,主要吸附在岩石或沉积物中[1]。其具有滋阴壮阳、收敛止泻、祛湿杀虫等多种作用[2],早在20世纪70年代就有学者对其进行研究。海葵触手内含有的可溶性细胞蛋白和多肽类化合物,具有神经和细胞毒性[3]。且研究还发现海葵中具有抗肿瘤活性物质,对肿瘤细胞具有杀伤和诱导凋亡的作用[4-6]。舟山黄海葵(Anthopleura xanthograrnmica,下称“黄海葵”)属于海葵科侧花海葵属。据已有研究报道,其体内和触手中含有强心作用的兴奋性肽类毒素和强杀虫活性的多肽,是海洋抗肿瘤药物研发的理想对象[7-8]。
近年来,肺癌的发病率及病死率呈快速增长,患者就诊时往往已是晚期,失去了手术机会,而化疗的毒副作用会影响患者治疗效果和生活质量。从海洋生物中提取低毒高效的抗肿瘤活性物质是抗肿瘤药物研究的热点之一,但有关黄海葵抗肿瘤作用的研究尚未见报道。故笔者通过对黄海葵进行反复冻融、丙酮分级沉淀等方法提取得到黄海葵粗提物,并作用于人肺癌SPC-A1细胞,研究其体外抗SPC-A1细胞的活性,以期为黄海葵的抗肿瘤生物活性研究提供实验依据。
1 材料
1.1 仪器
CF16RX Ⅱ型高速冷冻离心机(日本Hitachi 公司);ZHJH-C12090 型超净工作台(上海智城分析仪器制造有限公司);680型酶标仪(美国Bio-Rad公司);CKX4型倒置显微镜、BX41 型荧光显微镜、CCD-NC6051 型显微摄像系统(日本Olympus公司)。
1.2 药品与试剂
胎牛血清(杭州四季青生物工程材料有限公司,批号:140809);1640培养基(美国Gibco公司,批号:1256837);青霉素(华北制药股份有限公司,批号:F4056201,效价:80 万u/0.48 g);链霉素(山东鲁抗医药股份有限公司,批号:140816,效价:100 万u/g);胰蛋白酶(美国Sigma 公司,批号:1G003907,效价:42 362 U/g);MTT(美国Sigma公司,批号BS0328,纯度>98%);吖啶橙(AO,批号:75168-11-5,纯度:≥95%)、溴化乙锭(EB,批号:1239-45-8,纯度:≥95%)购自杭州昊天生物技术有限公司;其他试剂均为分析纯。
1.3 细胞与动物
人肺癌SPC-A1细胞购置于中国科学院上海细胞所,本实验所用为第5 代细胞。舟山黄海葵,从浙江舟山嵊泗海域采集,经浙江海洋学院赵盛龙教授鉴定为真品。
2 方法
2.1 黄海葵粗提物的制备
将黄海葵在25 ℃的通风环境中给以干净的海水饲喂12 h,备用。取饲养后的活黄海葵于纯水中清洗,去除其表面杂质。取500 g 黄海葵于烧杯中,覆以700 ml 纯水,置于-20 ℃冰柜中冷冻过夜。次日取出室温下自然解冻,待全部融化后,再置于-20 ℃冰柜中冷冻,重复冻融3次。最后,以纱布包裹全部融化的黄海葵样品进行粗过滤,弃去黄海葵体等杂质,取其滤液。滤液在4 ℃、14 000 r/min(离心半径为5.9 cm,下同)条件下离心10 min,收集上清液,即得黄海葵粗提液。
采用丙酮分级沉淀法对黄海葵粗提液进一步提取。在黄海葵粗提液中分别加入-20 ℃预冷过的20%、50%、80%丙酮进行分级沉淀,用玻璃棒搅拌使之迅速沉积。每一步所得的沉淀物在4 ℃、14 000 r/min条件下离心5 min,收集沉淀,冷冻干燥后即得黄海葵粗提物(得率为67%),于-20 ℃保存,备用。
2.2 细胞培养
SPC-A1 细胞在含链霉素、青霉素、10%胎牛血清的1640营养液中培养,在37 ℃、5%CO2的培养箱中孵育,待长满培养基80%以上时,用0.25%胰蛋白酶溶液进行消化传代,取处于对数生长期的细胞进行实验。
2.3 细胞增殖抑制率的检测
采用MTT法。取SPC-A1细胞制成单细胞悬液,进行计数并稀释成细胞密度为1×104ml-1的细胞液,接种至96孔板,每孔200 μl。常规条件下培养24 h 后吸弃营养液,将SPC-A1 细胞随机分为空白对照组(只加入1640 营养液)和药物组,药物组是在1640 营养液中分别加入质量浓度分别为0.625、1.25、2.5 mg/ml的黄海葵粗提物,每组设3个复孔。分别在培养24、48、72 h后,吸弃营养液,每孔加入含有10%MTT的磷酸盐缓冲液(PBS)200 μl,继续培养4 h。吸弃孔中液体,每孔加入二甲基亚砜(DMSO)150 μl,充分振荡10 min。使用酶标仪测定各孔490 nm 波长处的吸光度(A),计算细胞增殖抑制指数(IR),IR(%)=(空白对照组A-药物组A)/空白对照组A×100%,并计算半数抑制浓度(IC50)。
2.4 HE染色观察细胞形态
在6 孔板中放入经泡酸、消毒处理后的盖玻片,以1×105ml-1的细胞密度将SPC-A1 细胞悬液接种培养,24 h 后弃去培养液,分组及给药同“2.3”项下方法。培养48 h 后在倒置显微镜下观察细胞形态并拍照。实验结束取出盖玻片,PBS 洗;95%乙醇固定20 min,PBS 洗;苏木素染色5 min,自来水浸洗使细胞核蓝化,伊红复染30 s;乙醇(50%、75%、95%、100%)依次梯度脱水后使用二甲苯透明2 次,然后中性树胶封片,于光学显微镜下观察并拍照。
2.5 AO/EB 荧光染色观察细胞形态
细胞接种与实验分组同“2.4”项下方法。实验24 h后取出盖玻片,PBS洗2~3次,进行AO/EB染色(AO/EB的配制方法参考试剂操作说明书)。于载玻片上在观察前滴加PBS 40 μl和AO/EB混合液10 μl,擦净盖玻片上残留的PBS,朝下放置有细胞的一面,用荧光显微镜观察并拍照。
2.6 统计学方法
采用SPSS 18.0 统计软件进行单因素方差分析(即t检验)。计量资料以表示,P<0.05表示差异有统计学意义。
3 结果
3.1 细胞增殖抑制率的检测结果
黄海葵粗提物对SPC-A1细胞的增殖抑制率见表1。
表1 黄海葵粗提物对SPC-A1细胞的增殖抑制率(,n=3)Tab 1 Inhibitory rate of A.xanthogrammica crude extract on the proliferation of SPC-A1 cells(,n=3)
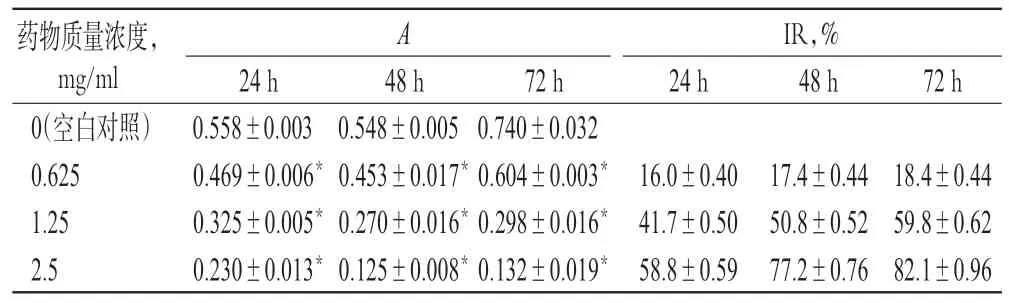
表1 黄海葵粗提物对SPC-A1细胞的增殖抑制率(,n=3)Tab 1 Inhibitory rate of A.xanthogrammica crude extract on the proliferation of SPC-A1 cells(,n=3)
注:与空白对照组比较,*P<0.05Note:vs.blank control group,*P<0.05
表1 显示,在一定的质量浓度作用范围内,增加黄海葵粗提物的质量浓度和延长相互作用的时间,SPC-A1细胞抑制率会逐渐增高,具有显著的时间与剂量依赖性。当作用时间一致时,随着黄海葵质量浓度的增加,其对SPC-A1 细胞的抑制率逐渐增高。作用72 h 后,0.625、1.25、2.5 mg/ml 黄海葵对细胞的抑制率分别达到18.4%、59.8%、82.1%;当黄海葵粗提物质量浓度为2.5 mg/ml,作用时间为24、48、72 h时,细胞抑制率分别为58.8%、77.2%、82.1%。作用24、48、72 h的IC50分别为1.81、1.32、1.18 mg/ml(IC50值越小则表明抑制效果越好)。这表明,黄海葵粗提物对人肺癌SPC-A1细胞的增殖具有抑制作用,且呈时间与剂量依赖性。
3.2 倒置显微镜下SPC-A1细胞形态观察结果
倒置显微镜下SPC-A1细胞形态变化见图1。

图1 倒置显微镜下SPC-A1细胞形态变化(×200)A.正常对照组;B.0.625 mg/ml组;C.1.25 mg/ml组;D.2.5 mg/ml组Fig 1 Morphological changes of SPC-A1 cells observed by inverted microscop(e×200)A.normal control group;B.0.625 mg/ml group;C.1.25 mg/ml group;D.2.5 mg/ml group
图1 显示,空白对照组SPC-A1 细胞生长良好,形态饱满,呈上皮样生长,边界清楚。药物作用后,细胞皱缩,体积缩小变圆,形态不规则,细胞黏着力下降,部分细胞漂浮于培养液中。当药物质量浓度为2.5 mg/ml时,细胞失去了正常形态,部分细胞破裂,培养液中可见明显的细胞碎片及颗粒物,部分细胞坏死。
3.3 HE染色观察结果
HE染色SPC-A1细胞的形态变化观察结果见图2。
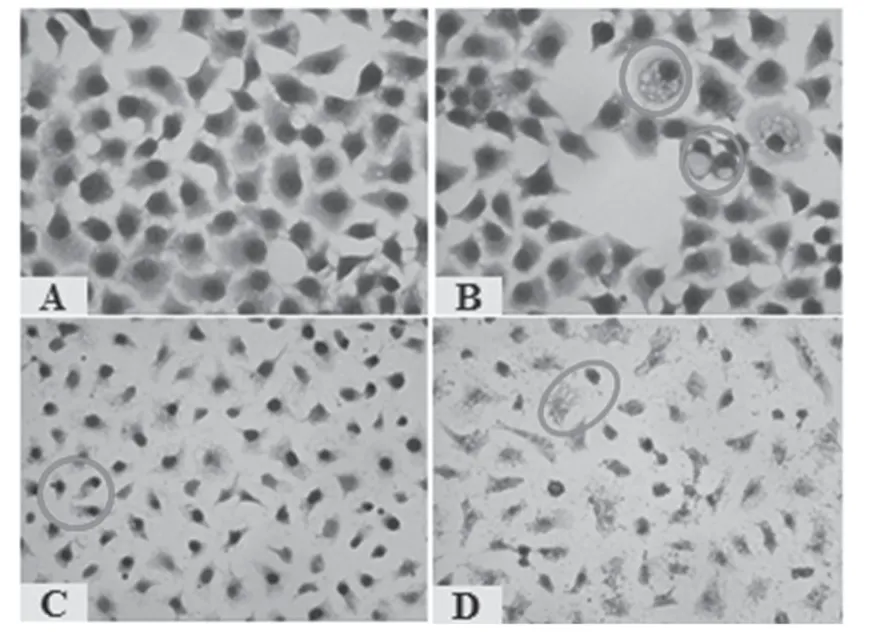
图2 HE染色观察SPC-A1细胞形态变化结果(×400)A.正常对照组;B.0.625 mg/ml组;C.1.25 mg/ml组;D.2.5 mg/ml组Fig 2 Morphological changes of SPC-A1 cells observed by HE staining(×400)A.normal control group;B.0.625 mg/ml group;C.1.25 mg/ml group;D.2.5 mg/ml group
图2 显示,空白对照组SPC-A1 细胞大小均匀,核仁数目多。随着药物浓度的增大,细胞形态呈现出不规则。当药物浓度为0.625 mg/ml 时,胞质出现空泡,核仁数目减少;当药物浓度为1.25 mg/ml时,细胞体积明显缩小,出现胞芽,核固缩,部分细胞核消失;当药物浓度为2.5 mg/ml时,细胞形态各异,大部分细胞核溶解,消失,存在的细胞核也进一步固缩,出现凋亡的形态学变化。
3.4 AO/EB 荧光染色观察结果
AO/EB荧光染色的观察结果见图3。
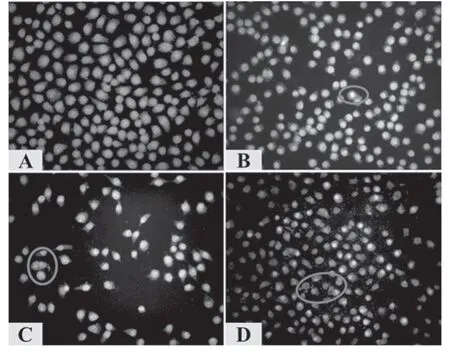
图3 AO/EB 荧光染色结果(×200)A.正常对照组;B.0.625 mg/ml组;C.1.25 mg/ml组;D.2.5 mg/ml组Fig 3Results of AO/EB stainin(g×200)A.normal control group;B.0.625 mg/ml group;C.1.25 mg/ml group;D.2.5 mg/ml group
图3 显示,空白对照组细胞大小均匀,胞核呈现出均匀的绿色荧光。用药后细胞均不同程度发生凋亡的形态学变化,0.625 mg/ml 组呈现出黄绿色荧光;1.25 mg/ml 组的异常细胞显著增多,胞核呈现出较强的黄绿色荧光或黄色荧光;2.5 mg/ml 组细胞体积明显缩小,部分细胞核消失,部分细胞核偏向细胞一侧,核固缩呈月牙形,出现凋亡小体,细胞核被染成桔红色荧光。
4 讨论
海洋生物中蕴藏着大量结构新颖、药用价值独特的新型药物,是巨大的天然药源宝库。目前,已从海洋生物中分离并鉴定出了许多结构新颖的抗肿瘤活性物质,这显示出了巨大的研究开发及应用前景[9-11]。海葵作为我国沿海富有的一种海洋动物,其触手和身体中含有众多的刺细胞,其中有储存着毒液的细胞器——刺丝囊,当海葵遇到物理或化学刺激时,刺丝会刺入猎物身体并释放毒液而麻痹猎物,用于捕抓猎物或抵御敌害。而其中所含的海葵神经毒素、海葵溶细胞素及海葵离子通道抑制剂等生物活性物质,备受学者们的关注[12-13]。
本实验通过反复冻融及丙酮分级沉淀提取方法获得黄海葵粗提物,通过MTT法检测该粗提物对人肺癌SPC-A1细胞的增殖抑制作用,并采用HE 染色和AO/EB 荧光染色观察加药后的细胞形态变化。MTT 法结果表明,该粗提物能抑制SPC-A1细胞的增殖,呈现作用时间与药物浓度的依赖性。加药后的SPC-A1细胞出现细胞体积缩小,细胞周围出现胞芽现象即凋亡小体,细胞质内出现空泡,核仁数目减少,细胞核固缩或溶解消失,这些形态学的变化,说明黄海葵粗提物能抑制SPC-A1 细胞的生长,并诱导凋亡,而肿瘤细胞的凋亡是抗癌药物的重要评价指标。鉴于海葵原料的低价与易得,其抗肿瘤活性物质有望发展成为一种新型的海洋抗肿瘤药物。接下来笔者将对黄海葵粗提物的具体抗癌成分进行进一步分离、纯化、鉴定,并探讨其相关的抗癌机制。
[1]张淑瑜,易杨华,汤海峰,等.海葵目动物化学成分及生物活性的研究概况[J].中国海洋药物,2002,21(3):48.
[2]管华诗,王曙光.中华海洋本草:3册[M].上海:上海科学技术出版社,2009:25.
[3]史文军,秦松,张朝晖,等.海葵化学成分及生物活性研究进展[J].海洋科学,2013,37(12):122.
[4]袁兆新,孙明莉,赵冰,等.海葵毒素对神经胶质瘤细胞的凋亡诱导作用[J].中风与神经疾病杂志,2006,23(5):594.
[5]Ramezanpour M,da Silva KB,Sanderson BJ.Venom present in sea anemone(Heteractis magnifica)induces apoptosis in non-small-cell lung cancer A549 cells through activation of mitochondria-mediated pathway[J].Biotechnol Lett,2014,36(3):489.
[6]胡波.海葵溶细胞素Gigantoxin-4的分离、鉴定和功能研究[D].上海:第二军医大学,2011.
[7]杨林,荣明强,刘少华,等.舟山黄海葵兴奋性毒素AX-1的分离纯化及鉴定[J].中国海洋药物,2012,31(2):25.
[8]刘少华,杨林,章晨,等.舟山黄海葵杀虫活性多肽的初步研究[J].浙江海洋学院学报:自然科学版,2010,29(6):566.
[9]曾名勇,崔海英,李八方.海洋生物活性肽及其生物活性研究进展[J].中国海洋药物,2005,24(1):46.
[10]刘力力,闫征,郭举,等.海鞘素简易结构类似物GJ7-1 和GJ7-2 的抗肿瘤活性及分子靶向研究[J].中国药房,2014,25(29):2 705.
[11]强薇,梅刚.真菌中环二肽及其衍生物的抗肿瘤活性研究进展[J].中国药房,2014,25(21):2 007.
[12]Tabakmakher VM,Monastyrnaya MM,Leichenko EV,et al.Biologically active polypeptides of sea anemones:structure,function,and prospects for application[J].Russian Journal of Marine Biology,2013,39(5):311.
[13]Fedorov S,Dyshlovoy S,Monastyrnaya M,et al.The anticancer effects of actinoporin RTX-A from the sea anemone heteractis crispa radianthus macrodactylus[J].Toxicon,2010,55(4):811.
