N-三甲基壳聚糖包覆的水飞蓟宾脂质体的制备及处方工艺优化
2015-03-09胡翠苹武汉大学人民医院药学部武汉40060武汉大学药学院武汉40064武汉大学基础医学院武汉40064
何 文,胡翠苹,瞿 振(1.武汉大学人民医院药学部,武汉 40060;2.武汉大学药学院,武汉 40064;.武汉大学基础医学院,武汉 40064)
水飞蓟宾(SLB)是从菊科药用植物水飞蓟种子的种皮中提取所得的一种黄酮化合物,具有明显的保护和稳定肝细胞、改善肝功能的作用[1]。其药理作用包括抗肝纤维化、抗脂质过氧化、抗炎、抗肿瘤、免疫调节和降血脂等[2],被广泛应用于治疗各种肝功能紊乱疾病,如肝硬化、肝炎、脂肪肝等[3]。SLB是一种脂溶性的物质,口服生物利用度低[4],严重影响了其药效的发挥。脂质体作为一类新型药物载体,能实现靶向和缓释给药,提高难溶性药物的生物利用度,降低药物毒副作用。N-三甲基壳聚糖(TMC)是壳聚糖的水溶性衍生物,带正电,因其良好的组织相容性和生物可降解性,被广泛用作纳米粒的载体材料[5];同时,带正电荷的高分子载体药物进入体内后,可很快被体内的网状内皮系统吞噬,易于聚集在肝脏[6]。为了提高SLB 的肝靶向性,本研究拟采用季铵化程度约为60%的TMC(简称TMC60)包覆SLB 脂质体(SLBL),形成阳离子脂质体(TMC60-SLBL),并对其处方及制备工艺进行优化,以期为SLB肝靶向制剂的研发奠定基础。
1 材料
1.1 仪器
SPD-20A、LC-20AT 型高效液相色谱仪(日本岛津公司);Zetasizer 3000HS 型激光粒度分析仪(英国马尔文公司);H-1600RW型高速冷冻离心机(武汉世纪超杰实验仪器有限公司)。
1.2 药品与试剂
SLB 原料药(西安飞达生物技术有限公司,批号:FD20140117,纯度:98%);SLB 对照品(中国食品药品检定研究院,批号:110856-201305,纯度:≥98%);TMC60(武汉大学人民医院药剂学实验室自制,批号:20130530,季铵化程度:64.4%);卵磷脂(批号:20130724)和胆固醇(批号:20120627)均购自国药集团化学试剂有限公司;甲醇为色谱纯,氯仿、乙醇等试剂为分析纯。
2 方法与结果
2.1 SLB的含量测定
2.1.1 色谱条件与系统适用性试验[7]色谱柱:Agilent TC-C18(250 mm×4.6 mm,5 μm);流动相:甲醇-水-冰醋酸(54∶46∶0.5),流速:0.8 ml/min;检测波长:288 nm;柱温:40 ℃;进样量:20 μl。分别取适量SLB对照品、TMC60-SLBL、空白TMC60 脂质体样品,经0.45 μm 的微孔滤膜过滤后,进样分析。结果表明,在此条件下,辅料对SLB测定无干扰。
2.1.2 标准曲线的绘制 精密称取在真空干燥箱60 ℃干燥至恒质量的SLB对照品10 mg,置于50 ml量瓶中,加适量甲醇溶解,并用流动相定容,摇匀,制备成200 μg/ml的贮备液。分别精密量取贮备液0.10、0.25、0.50、1.00、2.00、4.00 ml,置于10 ml量瓶中,用流动相定容,摇匀,稀释得到质量浓度为2、5、10、20、40、80 μg/ml 的对照品溶液。用0.45 μm微孔滤膜滤过后,进样测定。以峰面积(y)对质量浓度(x)进行线性回归,得回归方程为y=69 379x+21 315(r=0.999 9)。结果表明,SLB 检测质量浓度的线性范围为2~80 μg/ml。
2.1.3 回收率试验 取空白TMC60脂质体2 ml,置于10 ml量瓶中,精密吸取不同量的SLB贮备液,制备成5、20、60 μg/ml的样品,再用适量甲醇破乳,并加流动相定容摇匀,以离心半径2.5 cm(下同)、12 000 r/min 离心10 min,取上清液经0.45 μm微孔滤膜过滤后,进样测定,计算回收率。结果,平均回收率分别为(99.33±1.00)%、(99.85±0.92)%、(100.00±0.56)%,RSD分别为1.01%、0.92%、0.56%(n=3)。
2.1.4 精密度试验 精密吸取不同量的SLB 贮备液于10 ml量瓶中,用流动相定容并制备成5、20、60 μg/ml 的溶液,于同日内重复测定5 次,连续测定5 d,考察日内、日间精密度。结果,日内RSD 分别为1.22%、0.97%、0.96%(n=5),日间RSD分别为1.63%、1.18%、0.80%(n=5)。
2.1.5 重复性试验 取同一批TMC60-SLBL样品6份,测定并计算SLB含量。结果,含量的RSD为0.42%(n=6),表明方法的重复性良好。
2.2 SLBL制备方法的选择
2.2.1 薄膜分散法 称取卵磷脂20 mg、胆固醇2 mg、SLB 1 mg 于500 ml 茄形瓶中,加入15 ml 氯仿与乙醇的混合溶剂充分溶解;于45 ℃水浴减压蒸馏除去有机溶剂,形成均匀透明的薄膜,继续抽真空除去残余溶剂;加入10 ml 生理盐水水合介质洗膜,于45 ℃恒温水浴水化1 h,得到乳状半透明脂质体溶液,并高速剪切分散10 min,密封置于4 ℃冰箱保存。
2.2.2 复乳法 称取卵磷脂20 mg、胆固醇2 mg、SLB 1 mg 于500 ml梨形瓶中,加入一定体积有机溶剂(体积比为2∶1的三氯甲烷-乙醇)溶解,再加入少量生理盐水,100 W 超声乳化5 min,形成乳白色的W/O 型乳液;再于45 ℃水浴减压蒸馏,除去少量有机溶剂,加入10 ml生理盐水,形成W/O/W型复乳;温度保持不变,压力不变,继续蒸馏除尽有机溶剂,形成乳白色悬浮液状的脂质体,并高速剪切分散10 min,置于4 ℃冰箱保存。
2.2.3 逆向蒸发法 称取卵磷脂20 mg、胆固醇2 mg、SLB 1 mg于500 ml梨形瓶中,加入一定体积有机溶剂(体积比为2∶1的三氯甲烷-乙醇)溶解,再加10 ml生理盐水超声5 min,减压蒸馏,直至形成反胶束凝胶;维持真空,继续减压蒸馏至其塌陷形成乳白色悬浮液状的脂质体,并高速剪切分散10 min,置于4 ℃冰箱保存。
2.3 包封率的测定[8]
取SLBL 混悬液1 ml,加甲醇超声破乳,3 500 r/min 离心10 min,取上清液经0.45 μm 的微孔滤膜过滤后,进样分析,测定SLB总含量Wz。另取SLBL混悬液1 ml,以1 000 r/min离心10 min,除去SLB 结晶,取上层脂质体溶液,于4 ℃下12 000 r/min 离心60 min,收集下层脂质体,用甲醇破乳,离心除去沉淀,经0.45 μm的微孔滤膜过滤后,进样测定,得到包载的SLB含量Wb。计算包封率:包封率=Wb/Wz×100%。“2.2”项下3 种方法制备的SLBL的包封率测定结果见表1。
表1 包封率测定结果(,n=3,%)Tab 1 Result of encapsulation efficiency(,n=3,%)

表1 包封率测定结果(,n=3,%)Tab 1 Result of encapsulation efficiency(,n=3,%)
注:与剪切前比较,*P<0.05Note:vs.before cutting,*P<0.05
经SPSS 21 软件进行t检验,薄膜分散法制备的脂质体的包封率在剪切前后差异无统计学意义(P>0.05),表明薄膜分散法剪切前后的包封率无明显改变;而复乳法和逆向蒸发法制备的脂质体的包封率在剪切前后差异有统计学意义(P<0.05),即高速剪切对此两种方法制备的脂质体的包封率影响较大。可见薄膜分散法制备的SLBL包封率较高,调整粒径后对包封率的影响也较小。因此,最终选择薄膜分散法制备SLBL。
2.4 TMC60-SLBL的制备
称取卵磷脂、胆固醇、SLB 适量,按照“2.2.1”项下方法制备SLBL初悬液;然后取处方量的TMC60(按与脂材的体积比为1∶4 的量)于40 ml 纯水中溶解,将10 ml 脂质体初悬液,以1 ml/min 的速度恒速滴加到上述TMC60 溶液中,搅拌速度为300 r/min;待脂质体完全滴加完毕后,再继续搅拌10 min,即得混悬状包衣脂质体;经高速剪切分散10 min,即得TMC60-SLBL。
2.5 单因素对脂质体包封率的影响
按照文献[8],以脂质体包封率为主要考察指标,考察磷脂质量浓度、磷脂-胆固醇质量比、药脂质量比、水合温度、水合时间、TMC60的质量浓度对包封率的影响。结果表明,包封率随着磷脂质量浓度的增加而增大,可能是由于单位体积脂质材料的增加,形成的脂质体数量也增多,包封药物的量也随之增加。胆固醇能够调节脂质体膜的流动性和影响膜的通透性,在一定范围内,包封率随着胆固醇比例的增大而增大,当胆固醇量过高时,包封率减小[9]。有研究认为,一定条件下,脂质体膜对药物的包封有一个相对饱和值,因此在低于饱和值时,包封率随药脂质量比的增大而增大,超过饱和值时则相反[10]。水合温度对包封率的影响也较大,温度过低,磷脂分子的流动性差,不利于药物的包封;温度过高,易引起磷脂的氧化,导致包封率减小。实验过程中发现,水合时间过长,磷脂会被氧化成深黄色而使脂质体不稳定,短时间内沉淀,同时结合包封率的结果,确定水合时间为1 h。TMC60的质量浓度对包封率无明显影响(P>0.05)。因此,选择对包封率影响较大的磷脂质量浓度、磷脂-胆固醇质量比、药脂质量比、水合温度4 个因素进行正交试验。
2.6 正交试验优化脂质体处方工艺
以磷脂质量浓度(A)、磷脂-胆固醇质量比(B)、药脂质量比(C)、水合温度(D)为因素,以包封率为指标,采用L9(34)正交试验优化处方工艺。因素与水平见表2,正交试验安排与结果见表3,方差分析结果见表4。
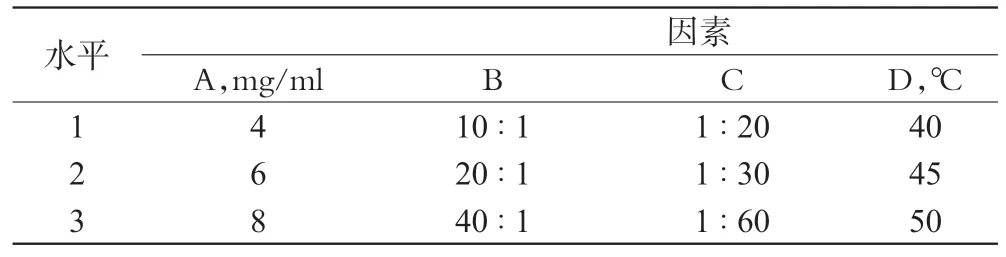
表2 因素与水平Tab 2 Factors and levels

表3 正交试验安排与结果Tab 3 Design and result of orthogonal test

表4 方差分析结果Tab 4 Analysis result of variance
由表3 和表4 可知,各因素对包封率影响大小顺序为C>D>B>A;经方差分析,B、C、D 对包封率有明显影响(P<0.05)。综合考虑,最优处方工艺组合为A2B3C2D2,即磷脂质量浓度为6 mg/ml,磷脂-胆固醇质量比为40∶1,药脂质量比为1∶30,水合温度为45 ℃。
2.7 验证试验
按照最优处方工艺制备3 批TMC60-SLBL,测定包封率。结果,包封率分别为82.23%、84.62%、79.39%,平均包封率为(82.08±2.6)%,RSD为3.17%(n=3),说明本处方工艺所制样品包封率较高,方法重复性较好。
2.8 渗漏率考察[11]
取按照最优处方工艺制备的TMC60-SLBL 适量,放入密封好的西林瓶中,置于4 ℃和25 ℃的条件下贮存,于1、7、15、30 d 后取样1 ml,分别以1 000 r/min 离心10 min,收集下层SLB 结晶。取上层脂质体溶液,于4 ℃下12 000 r/min 离心60 min,收集上层游离SLB,合并两次收集的SLB后进样分析,得到游离药物的量,按公式计算:Q=(m1-m2)/m3×100%,其中Q为渗漏率,m1为贮存放置一段时间后测得的游离药物的量,m2为贮存前测得的游离药物的量,m3为贮存前包封的药量。TMC60-SLBL在4、25 ℃下的渗漏率-时间曲线见图1。

图1 TMC60-SLBL在4、25 ℃下的渗漏率-时间曲线(n=3)Fig 1 Permeability-time curves of TMC60-SLBL at 4 and 25 ℃(n=3)
由图1 可知,脂质体的渗漏率与保存温度密切相关,TMC60-SLBL在4 ℃贮存的稳定性较在25 ℃好。
2.9 粒径及Zeta电位
取按照最优处方工艺制备的TMC60-SLBL 及未包覆TMC60 的SLBL 适量,分别置于样品池中,分散均匀,采用激光粒度仪测定平均粒径和和Zeta 电位。结果,TMC60-SLBL和SLBL 的平均粒径分别为(161.2±2.0)、(131.9±1.9)nm,Zeta电位分别为(36.73±2.84)、(-23.18±1.14)mV(n=3)。
3 讨论
3.1 样品含量的计算
SLB以一对非对映异构体的形式存在[7],在高效液相色谱分析中表现为双峰,2010 年版《中国药典》规定含量测定以两峰面积之和进行定量。
3.2 流动相比例的确定
参照《中国药典》和文献[7],最终将流动相调整为甲醇-水-冰醋酸(54∶46∶0.5)。调整过程中发现,加大冰醋酸的比例可以抑制峰形拖尾,可能是因为SLB 的化学结构中含有较多的羟基,可以与色谱柱中的硅羟基(吸电子基团)产生作用力。酸性环境抑制了硅羟基的电离,使得硅羟基呈分子状态,从而不易吸引SLB中的羟基氢。
3.3 制备方法的确定
本试验前期采用了薄膜分散法、复乳法、逆向蒸发法、乙醇注入法等方法来制备SLBL。但在制备的过程中发现本实验使用的磷脂和胆固醇微溶于乙醇,虽然通过光学显微镜观察,发现有少量脂质体形成,但是不稳定,几个小时后就出现了沉淀,于是舍弃了乙醇注入法。前3种方法都能制备成较稳定的脂质体,通过高速剪切机分散,包封率都出现不同程度的降低,可能是因为高速剪切过程中产生的能量高,导致脂质体氧化,药物发生渗漏;薄膜分散法制备的多为大多层脂质体(MLV)[12],而MLV脂质体层数多,受到高速剪切破坏的程度较小,因此包封率下降程度相对较小,这与文献[12]的结果类似。除此之外,在使用前3种方法制备脂质体的过程中均使用了有机溶剂,而薄膜分散法可以尽可能迅速且完全地除去有机溶剂。有害有机溶剂的限度检查拟在后续研究作补充。
3.4 处方工艺优化
本文通过正交试验筛选出TMC60-SLBL 的最优处方,制得产品包封率高、重现性好;与未包覆的SLBL相比,TMC60-SLBL的Zeta 电位由负变正,具有较高的正电性。有研究表明,Zeta电位的绝对值越大(大于15 mV),粒子间的静电斥力越大,越稳定[13]。本实验中TMC60-SLBL的Zeta电位为(36.73±2.84)mV、粒径较小,表明稳定性良好,为后续实验奠定了基础。
[1]Basiglio CL,Sánchez Pozzi EJ,Mottino AD,et al.Differential effects of silymarin and its active component silibinin on plasma membrane stability and hepatocellular lysis[J].Chem Biol Interact,2009,179(2/3):297.
[2]刘志刚,李雪玲,翁立冬,等.水飞蓟素药理作用研究进展[J].辽宁中医药大学学报,2012,14(10):91.
[3]Burczynski FJ,Wang GQ,Nguyen D,et al.Silymarin and hepatoprotection[J].J Cent South Univ:Med Sci,2012,37(1):6.
[4]El-Samaligy MS,Afifi NN,Mahmoud EA.Increasing bioavailability of silymarin using a buccal liposomal delivery system:preparation and experimental design investigation[J].Int J Pharm,2006,308(1/2):140.
[5]廖德华,罗新,向大雄.以N-三甲基壳聚糖为载体的纳米粒研究进展[J].世界临床药物,2012,33(9):554.
[6]郝爱军,张宁,郭兴家,等.EPR作用及其在抗肿瘤大分子药物研究中的应用[J].中国新药杂志,2012,21(21):2 516.
[7]岑菁,许瑞祥,夏培元,等.RP-HPLC 法测定水飞蓟宾原料药的含量和有关物质[J].中国药房,2014,25(17):1 614.
[8]Kumar N,Rai A,Reddy ND,et al.Silymarin liposomes improves oral bioavailability of silybin besides targeting hepatocytes,and immune cells[J].Pharmacol Rep,2014,66(5):788.
[9]陈博.维A酸脂质体的制备工艺研究[J].中国药房,2014,25(21):1 973.
[10]姚新武,刘长霞,张鹏.响应面法优化龙胆苦苷脂质体的复乳法制备工艺[J].北京化工大学学报:自然科学版,2012,39(2):68.
[11]李学涛,程岚,贾天柱.异长春花碱脂质体的制备及理化性质研究[J].中药材,2011,34(1):119.
[12]郜海涛,顾黎,张鹏英,等.牛蒡寡糖脂质体的制备和性质鉴定[J].科技通报,2010,26(6):863.
[13]喻樊,杨锦明.β-谷甾醇替代胆固醇制备槲皮素脂质体的可行性研究[J].中草药,2013,44(23):3 303.
