正交试验法优选复方苦黄方的水提取工艺Δ
2015-03-09李明春石永坚赵丽艳程艳芹解放军第401医院山东青岛266071
张 哲,李明春,石永坚,赵丽艳,程艳芹(解放军第401医院,山东青岛 266071)
复方苦黄方是解放军第401 医院治疗湿疹的纯中药外用方剂,由苦参、黄柏、蛇床子、防风、苍术等组成,具有祛风胜湿、清热燥湿、解毒止痒之功效。由其制成的洗剂在我院临床使用多年,疗效确切。但由于患者反映该制剂使用及运输保存均不方便,笔者对其进行了再次开发研究,拟将其开发成方便患者使用及保存的凝胶剂。为了最大限度地提取出有效成分,首先对其提取工艺进行优选。笔者在本试验中将方中蛇床子、防风、苍术等经超临界二氧化碳(SFE-CO2)萃取后的药渣与处方量的苦参、黄柏药材相混合,用正交试验设计法,以苦参中的苦参碱与氧化苦参碱含量之和、防风中的升麻素苷与5-O-甲基维斯阿米醇苷含量之和、黄柏中的盐酸小檗碱含量以及浸膏得率为指标,综合评价,优选复方苦黄方的水提取工艺条件,以保证制剂的临床疗效。
1 材料
1.1 仪器
1260型高效液相色谱仪(美国安捷伦公司);LC-10A型高效液相色谱仪(日本岛津公司);KH-100B 型超声波清洗器(昆山禾创超声仪器有限公司);80-1型离心沉淀机(上海浦东物理光学仪器厂);DV215CD 型电子分析天平(美国奥豪斯公司)。
1.2 药材
苦参(批号:070129),为豆科植物苦参Sophora flavescensAit.的干燥根;黄柏(批号:070801),为芸香科植物黄皮树Phellodendron chinenseSchneid.的干燥树皮;防风(批号:0105200113),为伞形科植物防风Saposhnikovia divaricata(Turcz.)Schischk的干燥根;蛇床子(批号:20110506),为伞形科植物蛇床Cnidium monnieri(L.)Cuss 的干燥成熟果实;苍术(批号:001054508),为菊科植物茅苍术Atractylodes lancea(Thunb.)DC.的干燥根茎。以上品种均购自同仁堂药业有限公司青岛分公司,由山东中医药大学张华副教授鉴定为真品。
1.3 药品与试剂
苦参碱对照品(批号:110805-200507,供含量测定用)、氧化苦参碱对照品(批号:110780-201007,纯度:92.3%)、升麻素苷对照品(批号:111522-201008,纯度:93.9%)、5-O-甲基维斯阿米醇苷对照品(批号:111523-201007,纯度:96.5%)、盐酸小檗碱对照品(批号:110713-200910,纯度:97.9%)均购自中国食品药品检定研究院;液相色谱分析用甲醇、乙腈、无水乙醇均为色谱纯;液相色谱用水为高纯水;其余试剂均为分析纯。
2 方法与结果
2.1 正交试验设计
参照复方苦黄方临床使用情况以及中药汤剂煎煮常规方法,为保证试验的可比性和可重复性,在饮片规格、提取次数、滤过、浓缩等条件相同的前提下,经过查阅文献[1]以及预试验,选择对提取结果影响明显的3 个因素即提取时间(A)、加水量(B)以及浸泡时间(C)为考察因素,采用L9(34)正交试验设计表安排正交试验。因素与水平见表1。
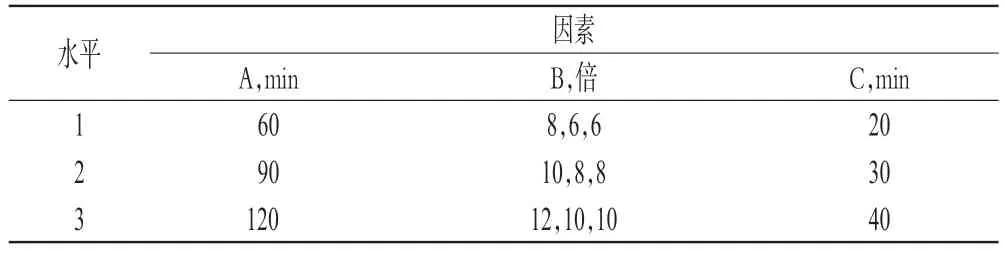
表1 因素与水平Tab 1 Factors and levels
2.2 样品液的制备
准确称量处方量苦参、黄柏药材,共9份,加入其他处方量按相同条件的SFE-CO2法萃取后的药渣,混合均匀后,依照表1及正交试验设计表进行试验。回流提取3次,滤过,合并3次提取液,浓缩定容至600 ml,制得1~9号样品液。
2.3 苦参碱和氧化苦参碱的含量测定[2-5]
2.3.1 色谱条件 色谱柱:依利特Hypersil APS-2(NH2)(250 mm×4.6 mm,5 μm);流动相:乙腈-无水乙醇-3%磷酸(80∶10∶10),流速:1 ml/min;检测波长:220 nm;柱温:30 ℃;进样量:20 μl。
2.3.2 混合对照品溶液的制备 精密称取苦参碱对照品和氧化苦参碱对照品,分别加乙腈-无水乙醇(80∶20)混合溶液溶解、定容,制成质量浓度为1.976 mg/ml的苦参碱对照品贮备液和1.524 mg/ml的氧化苦参碱对照品贮备液。分别取2种对照品贮备液适量,置于同一量瓶中,用乙腈-无水乙醇(80∶20)混合溶液分别稀释定容成含苦参碱29.64、88.92、148.20、207.48、266.76、326.04 μg/ml 和含氧化苦参碱22.86、68.58、114.30、160.02、205.74、251.46 μg/ml的1~6号混合对照品溶液。
2.3.3 供试品溶液的制备 分别精密量取“2.2”项下1~9 号样品液各20 ml,离心(3 000 r/min,离心半径5 cm)25 min;取上清液,用氨试液调pH至10,置于分液漏斗中,用三氯甲烷萃取5 次,每次20 ml;合并三氯甲烷液,置于60 ℃水浴上挥干;用适量无水乙醇溶解残渣,并转移至25 ml 量瓶中,加无水乙醇稀释至刻度,混匀,用0.45 μm 微孔滤膜滤过,取续滤液,即得1~9号供试品溶液。
2.3.4 阴性对照溶液的制备 称取除苦参外的其余处方量药材,照“2.2”和“2.3.3”项下方法,依法制得阴性对照溶液。
2.3.5 系统适用性试验 分别吸取阴性对照溶液、4号混合对照品溶液、1号供试品溶液各20 μl,注入液相色谱仪,按“2.3.1”项下色谱条件测定。结果显示,供试品色谱中,苦参碱保留时间为9 min 左右,氧化苦参碱保留时间为13 min 左右,均与对照品的保留时间一致;主成分峰与杂质峰分离度>2.0,阴性对照无干扰。色谱图见图1。
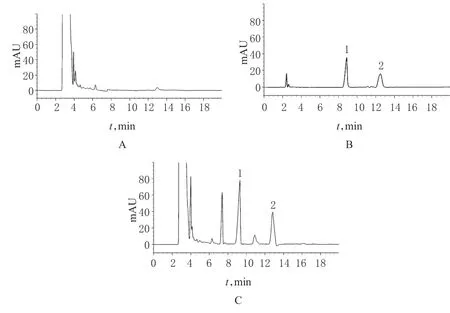
图1 苦参碱和氧化苦参碱高效液相色谱图A.阴性对照溶液;B.混合对照品溶液;C.供试品溶液;1.苦参碱;2.氧化苦参碱Fig 1 HPLC chromatograms of matrine and oxymatrineA.negative control solution;B.mixed reference substance solution;C.test sample solution;1.matrine;2.oxymatrine
2.3.6 线性关系考察 吸取“2.3.2”项下1~6号混合对照品溶液各20 μl,按“2.3.1”项下色谱条件进样测定,记录峰面积。以进样液质量浓度(x)为横坐标,以峰面积值(y)为纵坐标进行线性回归,得苦参碱回归方程为y=512.0x+10.12(r=0.999 9,n=6),氧化苦参碱回归方程为y=536.3x+1.070(r=0.999 9,n=6)。结果表明,苦参碱和氧化苦参碱的检测质量浓度线性范围分别为29.64~326.04、22.86~251.46 μg/ml。
2.3.7 精密度、重复性、稳定性和加样回收率试验 按相关要求分别进行试验。结果,精密度试验中苦参碱和氧化苦参碱峰面积的RSD 分别为0.15%、0.22%(n=6);重复性试验中苦参碱和氧化苦参碱峰面积的RSD 分别为1.06%、1.73%(n=6);稳定性试验中样品液放置12 h 苦参碱和氧化苦参碱含量的RSD 分别为1.32%、1.10%(n=6);加样回收率试验中苦参碱和氧化苦参碱回收率分别为100.98%、98.61%,RSD分别为1.52%、1.25%(n=6)。以上表明含量测定方法符合规定。
2.4 升麻素苷和5-O-甲基维斯阿米醇苷的含量测定
2.4.1 色谱条件 色谱柱:Hypersil GOLD(250 mm×4.6 mm,5 μm);流动相:乙腈-水,梯度洗脱(0 min,乙腈13%、水87%;20 min,乙腈30%、水70%);流速:1 ml/min;检测波长:254 nm;柱温:30 ℃;进样量:10 μl。
2.4.2 混合对照品溶液的制备 分别精密称取经五氧化二磷干燥后的升麻素苷对照品和5-O-甲基维斯阿米醇苷对照品适量,加甲醇溶解,定容,制成质量浓度为471.2 μg/ml 的升麻素苷和519.6 μg/ml的5-O-甲基维斯阿米醇苷对照品溶液。分别精密移取以上2 种对照品溶液适量,用甲醇稀释定容,制成升麻素苷和5-O-甲基维斯阿米醇苷质量浓度分别为7.5、15 μg/ml的混合对照品溶液。2.4.3 供试品溶液的制备 精密量取“2.2”项下1~9 号样品液各1 ml,通过中性氧化铝柱(100~200目,2 g,内径1 cm),用甲醇50 ml洗脱,收集甲醇洗脱液,蒸干,残渣加甲醇溶解并定容至10 ml量瓶中,0.45 μm微孔滤膜滤过,取续滤液,即得1~9号供试品溶液。
2.4.4 样品中升麻素苷和5-O-甲基维斯阿米醇苷的含量测定 取“2.4.2”项下的混合对照品溶液及“2.4.3”项下的1~9号供试品溶液,在“2.4.1”项色谱条件下,分别进样10 μl,记录峰面积,计算升麻素苷与5-O-甲基维斯阿米醇苷含量之和。
经方法学考察,测定升麻素苷和5-O-甲基维斯阿米醇苷含量的方法学符合要求,其具体内容另文发表[6]。
2.5 盐酸小檗碱的含量测定[7-10]
2.5.1 色谱条件 色谱柱:Agilent SB-C18(150 mm×4.6 mm,5 μm);流动相:乙腈-水(每1 000 ml水中加入0.05 mol磷酸二氢钾并用磷酸调pH 至2.5)(25∶75),流速:1 ml/min;检测波长:265 nm;柱温:30 ℃;进样量:10 μl。
2.5.2 对照品溶液的制备 取经五氧化二磷干燥后的盐酸小檗碱对照品,精密称定,加流动相溶解并定容,制成质量浓度为1.997 mg/ml的盐酸小檗碱对照品贮备液。移取对照品贮备液适量,再用流动相稀释定容,分别制成质量浓度为39.94、79.88、119.8、159.7、199.7 μg/ml的1~5号对照品溶液。
2.5.3 供试品溶液制备 精密量取“2.2”项下的1~9 号样品溶液各2 ml,置于10 ml量瓶中,加入适量1%盐酸甲醇溶液超声10 min,放冷,用1%盐酸甲醇溶液定容至10 ml,离心(3 000 r/min,离心半径5 cm),取上清液,0.45 μm微孔滤膜滤过,取续滤液,即得1~9号供试品溶液。
2.5.4 阴性对照溶液的制备 称取除黄柏外其余处方量药材,按照“2.2”项下1 号样品液处理方法和“2.5.3”项下供试品溶液制备方法,依法制得阴性对照溶液。
2.5.5 系统适用性试验 取阴性对照溶液、4号对照品溶液、1号供试品溶液各10 μl,注入液相色谱仪,按“2.5.1”项下色谱条件测定。结果显示,供试品色谱中,盐酸小檗碱保留时间在10 min 左右,与对照品的保留时间一致;主成分峰与杂质峰分离度>2.0,阴性对照无干扰。色谱图见图2。
2.5.6 线性关系考察 吸取“2.5.2”项下1~5号对照品溶液各10 μl,按“2.5.1”项下色谱条件进样测定,记录峰面积。以进样质量浓度(x)为横坐标,以峰面积(y)为纵坐标进行线性回归,得盐酸小檗碱回归方程为y=23.23x-4.755(r=0.999 9,n=5);结果表明,盐酸小檗碱检测质量浓度线性范围为39.94~199.7 μg/ml。
2.5.7 精密度、重复性、稳定性和加样回收率试验 按相关要求分别进行试验。结果,精密度试验中峰面积的RSD 为0.09%(n=6);重复性试验中峰面积的RSD 为1.72%(n=6);稳定性试验中样品溶液放置24 h 含量的RSD 为0.24%(n=6);加样回收率试验平均值为98.6%,RSD 为0.99%(n=6)。以上表明含量测定方法符合规定。
2.6 浸膏得率的测定
精密吸取“2.2”项下1~9 号样品液各10 ml,按2010 年版《中国药典》(一部)“浸出物测定法”(附录ⅩA)项下方法[11],置于已烘干至恒质量的蒸发皿中,水浴蒸干,于105 ℃烘3 h,计算浸膏得率[(浸膏量/10)×(总药液量/药材量)×100%]。
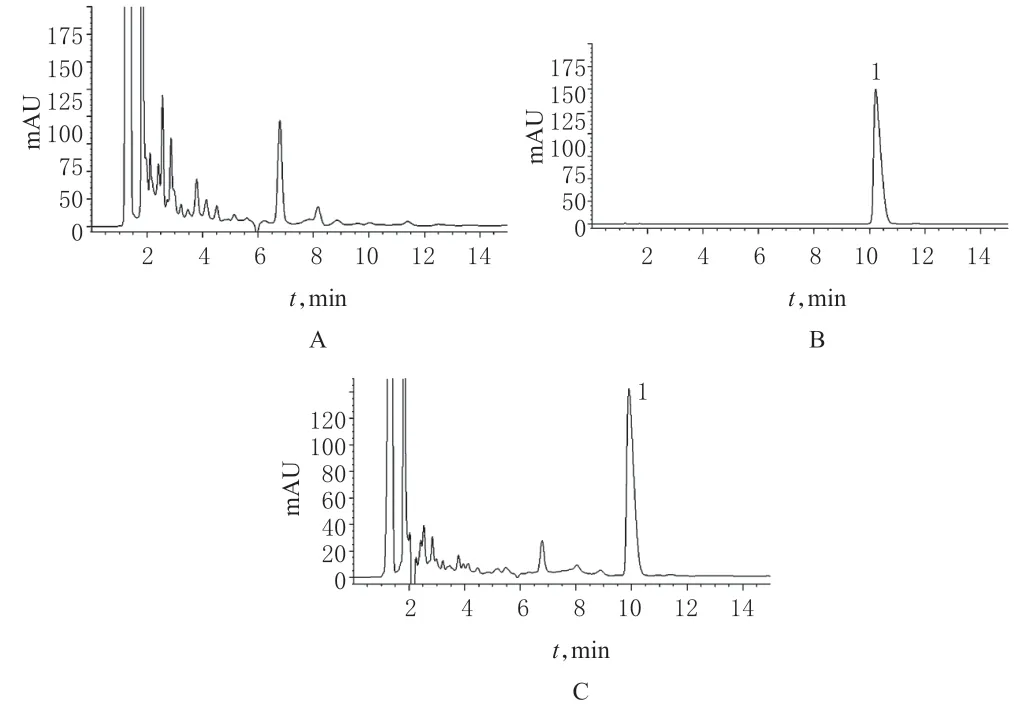
图2 盐酸小檗碱高效液相色谱图A.阴性对照溶液;B.对照品溶液;C.供试品溶液;1.盐酸小檗碱Fig 2 HPLC chromatograms of berberine hydrochlorideA.negative control solution;B.reference substance solution;C.test sample solution;1.berberine hydrochloride
2.7 正交试验结果及方差分析[12]
取“2.2”项下1~9号样品液,分别测定提取液中苦参碱和氧化苦参碱含量之和(Y1)、升麻素苷含量和5-O-甲基维斯阿米醇苷含量之和(Y2)、盐酸小檗碱的含量(Y3),同时计算浸膏得率(Y4)。根据4项指标对提取方法的影响程度,分别给予权重系数0.3、0.3、0.3、0.1。将所得数据标准化后进行综合评价{Y=[(Y1/Y1max)×0.3+(Y2/Y2max)×0.3+(Y3/Y3max)×0.3+(Y4/Y4max)×0.1]×100}。正交试验设计与结果见表2,方差分析结果见表3。
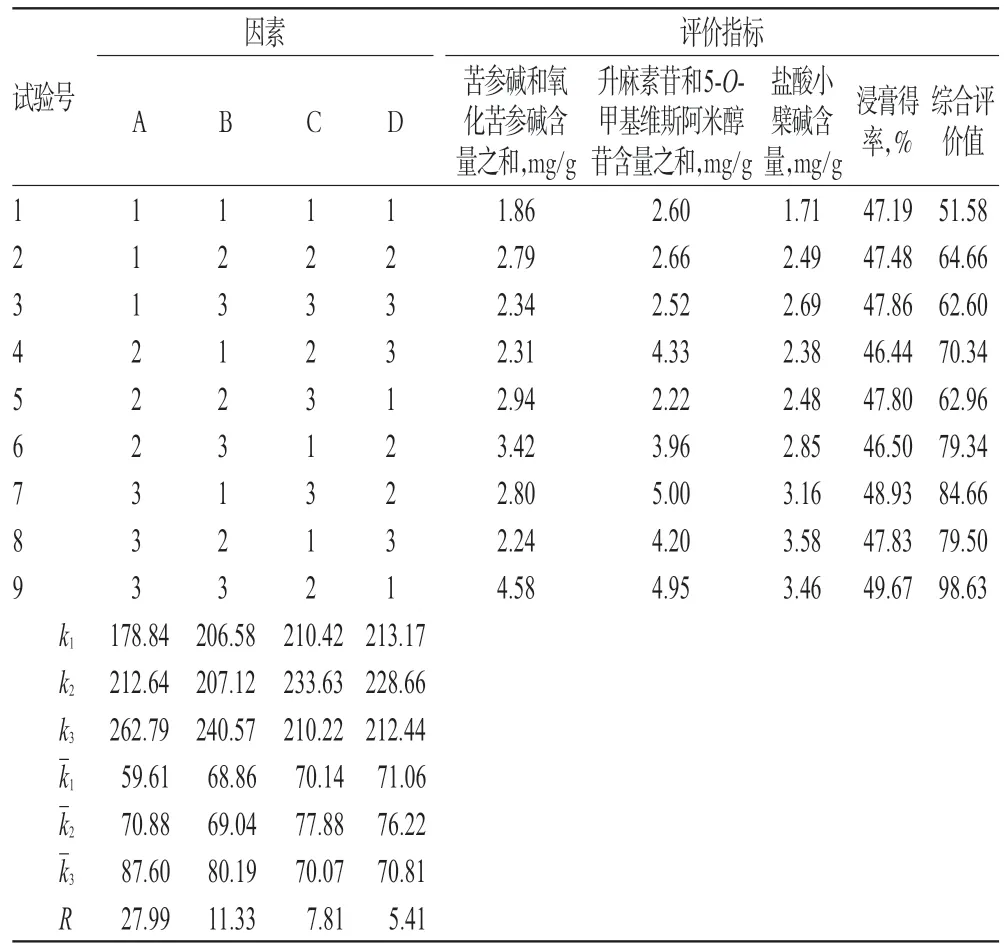
表2 正交试验设计与结果Tab 2 Design and results of orthogonal test
方差分析结果表明,提取时间(A)对综合评价值具有显著性影响(P<0.05);极差分析结果表明,各因素对综合评价值影响的先后次序为提取时间(A)>加水量(B)>浸泡时间(C),各因素水平的强弱顺序为A3>A2>A1,B3>B2>B1,C2>C1>C3。结合操作实际和节约能源的需要,确定优选的工艺参数组合为A3B1C1,即提取时间120 min,加水量8、6、6 倍(以投料的药材和药渣总质量计),浸泡时间20 min。
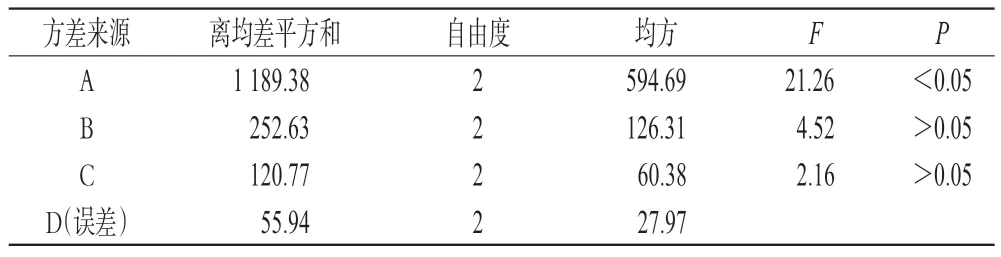
表3 方差分析结果Tab 3 Results of variance analysis
2.8 工艺验证
取处方量苦参、黄柏药材,共3份,分别加入其余处方量的按相同条件的SFE-CO2法萃取后的蛇床子、防风、苍术药渣,混合均匀后,加水浸泡20 min,回流提取3次,加水量分别为8、6、6 倍,每次提取120 min,按照“2.2”项下样品液的制备方法制备3 批样品,分别测定。结果,3 批样品苦参碱和氧化苦参碱的总含量平均值为3.152 6 mg/g,RSD为1.03%(n=3),升麻素苷和5-O-甲基维斯阿米醇苷的总含量平均值为4.977 2 mg/g,RSD为2.27%(n=3);盐酸小檗碱的平均含量为3.345 0 mg/g,RSD 为1.19%(n=3);浸膏得率平均值为49.23%,RSD 为2.43%(n=3)。以上表明由正交试验筛选出来的水提取工艺稳定可行。
3 讨论
预试验曾考察药材吸水率、加水量、浸泡时间、提取时间、提取次数对苦参碱与氧化苦参碱的总量、升麻素苷与5-O-甲基维斯阿米醇苷的总量、盐酸小檗碱的含量和浸膏得率的影响,最终选取对提取效果影响相对较大的3个因素:加水量、浸泡时间、提取时间为考察因素。验证试验结果表明,本正交试验所优选的水提取工艺稳定可行。
在苦参碱与氧化苦参碱的色谱分析中,曾使用甲醇、无水乙醇为供试液的溶剂,使用不同比例的甲醇-水、乙腈-水、乙腈-无水乙醇、乙腈-无水乙醇-3%磷酸为流动相。经过比较,结果以无水乙醇为供试品溶剂,2010 年版《中国药典》(一部)“苦参”含量测定项下[11]流动相条件中的乙腈-无水乙醇-3%磷酸(80∶10∶10)为流动相时,样品峰形对称、与其他杂质峰分离度良好。
在盐酸小檗碱的含量测定中,曾参考2010 年版《中国药典》(一部)中“黄柏”含量测定项下的方法进行检测,但分离效果不好。笔者分析可能是由于本制剂属于复方制剂,其干扰成分与单味黄柏有很大差别所致。笔者在试验中发现,由于黄柏中既含盐酸小檗碱又含小檗碱,在用1%盐酸甲醇溶液定容时,先超声10 min,使小檗碱均转化成盐酸小檗碱,更便于含量测定。在选择测定波长时,取盐酸小檗碱对照品溶液在200~400 nm波长处扫描,显示盐酸小檗碱在265、346 nm波长处均有较大吸收峰,但在265 nm 波长处杂质峰干扰较少。因此,本试验选择265 nm为检测波长。在流动相的选择时,在水相为纯水的条件下,样品峰之间分离度不好,而且会出现严重的拖尾现象。当在水相中加入适量的磷酸二氢钾制备成0.05 mol/L的缓冲盐溶液并调节pH为2.5后,各峰之间的分离度均在1.5以上,达到了分离要求。
[1]沈群.中药研究中的正交设计问题[J].数理医药学杂志,2011,24(1):19.
[2]惠建国,孙秀梅,张兆旺.苦参半仿生提取法与水提取法的比较[J].山东中医药大学学报,2007,31(3):245.
[3]周世玉,周晓英,唐婧坤.高效液相色谱法测定苦参片中苦参碱含量[J].中国药业,2011,20(7):27.
[4]史明,于琳,时晓亚.复方苦参子洗液提取工艺优选的实验研究[J].中医药导报,2011,17(2):68.
[5]巨建云,赵海霞.水提取法制备苦参配方颗粒的工艺研究[J].中药材,2009,32(10):1 625.
[6]程艳芹,李明春,张哲.HPLC法同时测定复方苦黄方水提液中升麻苷、5-O-甲基维斯阿米醇苷含量[J].解放军药学学报,2013,29(4):362.
[7]王洪明,许学丽.HPLC法测定颈复康颗粒中盐酸小檗碱的含量[J].中国药房,2013,24(48):4 586.
[8]李定芬,陈新华,戴剑锋.不同方法对黄柏中盐酸小檗碱的提取比较[J].微量元素与健康研究,2010,27(1):52.
[9]杨跃辉,杨君,姜清华.HPLC法测定水调散中盐酸小檗碱的含量[J].化学与生物工程,2011,28(6):87.
[10]张倩,蔡丽芬,钟国跃,等.RP-HPLC 法同时测定关黄柏中小檗碱、药根碱、巴马汀及黄柏酮含量的方法学研究[J].中国中药杂志,2010,35(16):2 061.
[11]国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:188-189、附录62.
[12]谢林,韩建伟,付聪,等.正交试验优选伤科熏洗汤剂的水提取工艺研究[J].中国实验方剂学杂志,2010,16(13):17.
