白桦开花抑制因子BpFLC与BpSVP酵母表达载体的构建及互作验证1)
2015-03-08郑唐春臧丽娜代丽娟刘彩霞曲冠证
郑唐春 臧丽娜 代丽娟 刘彩霞 曲冠证
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
责任编辑:潘 华。
植物的开花是一个高度复杂而复合的、在一定遗传背景控制下的生理生化及形态发生过程。表现为植物接受环境条件诱导、信号传导、开花决定基因控制及诸多代谢途径的相互制约下,引起花芽分化,进而导致器官发生。根据前期的大量研究,拟南芥中已知有多种遗传途径参与成花转变,例如光周期途径、春化途径、自主途径及赤霉素途径等[1-4]。Flowering Locus C(FLC)和Short Vegetative Phase(SVP)是开花信号整合子的两个核心调节蛋白,它们相互作用能够调节开花信号整合因子。FLC 是MADS-box 转录调节因子,主要在芽尖和根尖表达[5],在春化途径中,FLC 起到关键的作用。拟南芥FLC 突变体和野生型都表现出强烈的春化需求,春化处理后的拟南芥FLC 的表达水平降低,过表达FLC 会导致拟南芥开花延迟[6-7]。SVP 也是开花负调控蛋白,含有保守的MADS-box,它在植物的整个营养体生长阶段中表达,维持营养生长阶段,但在花序分生组织中几乎不表达[8-9]。开花途径整合因子Flowering Locus T(FT)、Suppressor of Overexpression of Constans 1(SOC1)的启动表达,能促进植物开花[10-11]。而FLC 和SVP 蛋白既能在茎尖分生组织中抑制SOC1 基因转录,又能在幼叶中调节FT 基因表达,阻止FT 蛋白等开花信号从叶片向分生组织运转[12]。此外FLC 蛋白还会影响开花协调因子FLOWERING LOCUS D (FD)的表达,削弱分生组织对开花信号的响应[13]。
在1年生的草本植物(如拟南芥、荠菜)中,开花抑制因子FLC 与SVP 已经被克隆,且被证实存在特殊的相互作用[14-15]。然而在多年生的林木中,每年的繁殖期会消耗大量的能量,利用开花抑制因子延缓花期的研究尚未见报道。白桦(Betual platyphylla Suk.)又称桦木,是我国东北地区的主要树种。具有耐贫瘩、耐严寒、生长快等特性[16-17]。白桦全身都是宝。白桦的木材为家具及造纸提供原料,其树皮、汁液等也富含多种宝贵的营养成份,是天然的保健药品。为了延长白桦的营养生长时间,获得高质量的白桦材料,探究白桦的晚花机制至关重要。本文通过克隆白桦开花抑制因子BpFLC 和BpSVP 基因,并构建酵母表达载体,从真核表达水平建立白桦FLC 与SVP 酵的母双杂交体系,为深入分析白桦FLC 与SVP 间的作用域和互作位点的相互作用等提供理论和技术基础。
1 材料与方法
1.1 试验材料
白桦幼叶cDNA 由本实验室保存;E.coli DH5α感受态菌株购自天根生化科技有限公司(北京);酵母双杂交表达载体pGBKT7、pGADT7,对照质粒pGBKT7- 53、pGBKT7 - lam、pGADT7 - T,酵 母 菌Y2Hgold,酵母省缺培养基及转化试剂均购自Clontech 公司(日本);质粒提取、胶回收试剂盒购自OMEGA 公司(美国);PCR 相关试剂、DNA marker、限制性内切酶EcoR I、Nde I,T4 DNA ligase 连接酶购自TaKaRa 公司(日本);胰蛋白胨、酵母提取物、葡萄糖、YNB(无氨基酸酵母氮源)购自Amresco 公司(美国);所用引物合成、测序服务由博仕生物技术有限公司完成(哈尔滨);其他实验试剂为进口或国产分析纯。
1.2 酵母诱饵载体的构建及转化
1.2.1 目的基因的克隆
根据前期的转录组数据,设计特异性引物,BLAST 分析排除异源基因同源性序列,引物序列见表1。以白桦幼叶cDNA 为模板,进行PCR 克隆。反应体系:10×Ex PCR buffer 2.5 μL,dNTP(10 mmol/L)2 μL,Primer-F(10 μmmol/L)1 μL,Primer-R(10 μmmol/L)1 μL,ExTaq DNA 聚合酶(5 U/μL)0.25 μL,cDNA 模板2 μL,加ddH2O 至终体积25 μL。反应条件:95 ℃4 min;94 ℃30 s,58 ℃45 s,72℃1 min 共35 个循环;72 ℃7 min。反应完成后取3 μL 反应产物进行1%琼脂糖凝胶电泳分析。
1.2.2 酵母诱饵表达载体的构建
将PCR 产物利用纯化试剂盒纯化后,用Nde I和EcoR I 限制性内切酶分别酶切目的片段和载体,酶切体系:Nde I 1 μL,EcoR I 1 μL,10×H buffer 2 μL,质粒1 μg,加ddH2O 至终体积20 μL。在37 ℃水浴锅中恒温处理2.5 h。酶切完成后用1%琼脂糖凝胶电泳,用试剂盒胶回收酶切后的目的片段。然后进行目的片段的连接重组,重组体系:10×T4 DNA ligase buffer 1 μL T4 DNA ligase 1 μL,目的片段6 μL,载体2 μL,终体积10 μL。16 ℃过夜,转化大肠杆菌DH5α 感受态细胞,分别涂布含有卡那霉素(pGBKT7 载 体,Kana 50 μg/mL)或 氨 苄 霉 素(pGADT7 载体,Amp 50 μg/mL)的LB 平板培养,37℃恒温培养14~16 h。然后挑取单克隆进行菌液PCR,提质粒进行质粒PCR 和酶切鉴定,最后将阳性克隆送往博仕生物技术有限公司测序鉴定。
1.2.3 酵母Y2Hgold 感受态制备及转化
参考Clontech 公司Gold Yeast Two-Hybrid System 操作手册及本实验室的改良法[18],采用PEG/LiAc 法依次将重组质粒pGBKT7-BpFLC 及pGBKT7-BpSVP 单独分别转化Y2Hgold 感受态细胞,涂布SD/-Trp 单缺培养基。将pGBKT7-BpFLC/pGADT7-BpSVP 和pGBKT7-BpSVP/pGADT7-Bp-FLC 分别共转入Y2Hgold 感受态细胞,平行设置空白载体对照试验。转化完成后,分别涂布SD/-Leu/-Trp(DDO)二缺培养基。30 ℃倒置培养3~4 d,观察转化情况。
1.2.4 酵母诱饵载体的自激活及毒性检验
在SD/-Trp 单缺培养基上随机挑取直径大于2 mm 的单克隆,用50 μL 无菌水重悬后,分别转移至SD/-Trp、SD/-Leu/-Trp/(DDO)、SD/-Trp/-Leu/-His/X-α-gal(TDO/X)、SD/-Leu/-Trp/-His/-Ade/AbA/X-α-gal(QDO/A/X)培养基平板上,30℃培养3~5 d 后观察平板的生长情况及菌落颜色变化,来检测诱饵蛋白有无自激活作用。
挑取经检验的直径大于2 mm 的单菌落,分别接种与5 mL SD/-Trp 液体培养基中,30 ℃230~250 r/min,震荡培养12 h,将过夜菌液以1 ∶100 稀释后接种于100 mL 的SD/-Trp 液体培养基中,在同样条件下继续培养,并分别于培养后0、3、6、9、12、15、18、21、24、27、30 h 后吸取菌液3 mL,以新鲜的SD/-Trp 液体培养基为空白对照,用可见光分光光度计在OD600处测定其吸光度,记录酵母生长情况,分析诱饵蛋白对酵母细胞自身有无毒害作用。
1.2.5 双杂交验证蛋白互作
SD/-Leu/-Trp 二缺培养基上随机挑取直径大于2 mm 的单克隆,用50 μL 无菌水重悬后,进行菌液PCR 检验目的基因。同时取2 μL 分别转移至SD/-Leu/-Trp/(DDO)、SD/-Leu/-Trp/His(TDO)、SD/-Leu/-Trp/-His/-Ade/AbA(QDO/A)、SD/-Leu/-Trp/-His/-Ade/AbA/X-α-gal(QDO/A/X)培养基平板上,30 ℃培养3~5 d 后观察平板的生长情况及菌落颜色变化。

表1 引物序列
2 结果与分析
2.1 BpFLC 和BpSVP 基因的克隆及分析
从白桦幼叶cDNA 中成功克隆出白桦BpFLC和BpSVP 基因(图1)。

图1 白桦BpFLC 与BpSVP 基因的PCR 产物琼脂糖凝胶电泳
其中BpFLC 基因(Gene bank 登录号:KC020112)的ORF 长度为627 bp,编码208 个氨基酸,预测的分子量和等电点分别为23.85 kDa 和9.04;BpSVP 基因(Gene bank 登录号:KP693588)的的ORF 长度为678 bp,编码225 个氨基酸,预测的分子量和等电点分别为25.25 kDa 和6.68。同源性分析结果表明BpFLC蛋白与可可树TcFLC 相似度最高(76%),BpSVP 蛋白与山核桃CcSVP 相似度最高(92%),且SVP 蛋白的保守性高于FLC 蛋白。不同物种间的FLC 结构域分析(http://pfam.sanger.ac.uk/)表明(图2,3):白桦BpFLC 与BpSVP 均属MIKC 型蛋白。二者的M 域(MADS-box)均由51(9-59 aa,PF00319;E-value=4.9e-28)个氨基酸组成,K 结构域(K-box)则分别由100(74-173aa,PF01486;E-value=1.5e-15)和104(69-172aa,PF01486;E-value=1.5e-15)个氨基酸组成。两个蛋白M 域的保守性均高于K 域。信号肽预测(http://www.cbs.dtu.dk/services/SignalP/)表明:BpFLC 与BpSVP 蛋白的N 端均不含信号肽,不属于胞外分泌蛋白或膜蛋白。因此,将BpFLC 与BpSVP完整编码框构建酵母表达质粒,不会因为分泌蛋白而影响到酵母双杂交系统中的蛋白相互作用检测。
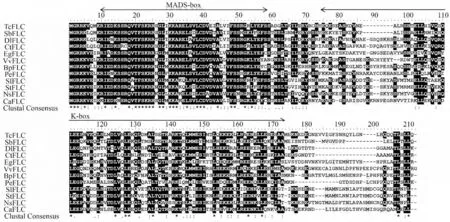
图2 白桦BpFLC 蛋白同源序列比对分析

图3 白桦BpSVP 蛋白同源序列比对分析
2.2 酵母诱饵表达载体的构建及验证
用Nde I 和EcoR I 对BpFLC、BpSVP 基因PCR产物、酵母空载体pGBKT7、pGADT7 同时进行双酶切后,用T4 连接酶连接后转化到大肠杆菌中,分别获得重组载体,暂命名为pGBKT7-BpFLC、pGBKT7-BpSVP、pGADT7-BpFLC、pGADT7-BpSVP。提取质粒利用载体通用引物(见表1)进行PCR 验证(图4)及酶切检验(图5),并对阳性质粒送样测序。测序结果表明BpFLC 和BpSVP 基因已经分别重组到酵母表达载体中,未发生碱基突变,至此酵母诱饵表达载体构建完成。

图4 酵母表达质粒BpFLC 和BpSVP 基因的PCR 产物电泳图
2.3 酵母诱饵表达载体的自激活与毒性检测
酵母转化3 d 后观察平板发现,诱饵载体和空载体对照都在SD/-Trp 上生长,菌落颜色为白色,且长势良好。而DDO、TDO/X、QTO/A/X 平板上都未见菌落生长,说明酵母诱饵表达载体没有自激活作用(图6)。从单缺板上挑取的阳性克隆,与空载体的对照菌在SD/-Trp 液体培养基中测定的OD600处的吸光度表明,两者在OD600处的吸光度随时间先增长后趋于稳定,但两者生长情况变化不显著,整体生长趋势相同,说明重组诱饵载体pGBKT7-BpFLC 和pGBKT7-BpSVP 对酵母自身没有毒害作用(表2)。

图5 酵母重组质粒的双酶切鉴定

图6 酵母诱饵载体的自激活验证

表2 酵母诱饵蛋白载体的毒性检验
2.4 双杂交蛋白互作的验证
在酵母Y2Hgold 菌中分别共转pGBKT7-BpFLC×pGADT7-BpSVP 和pGBKT7-BpSVP×pGADT7-Bp-FLC 及空载体对照pGBKT7-BpFLC×pGADT7 和pGBKT7-BpSVP×pGADT7。结果表明(图7)上述4种组合均能在DDO 平板上正常生长。进一步试验表明,酵母双杂交阴性对照Y2Hgold[pGBKT7-Lam×pGADT7-T],Y2Hgold[pGBKT7-BpFLC×pGADT7]和Y2Hgold[pGBKT7-BpSVP×pGADT7]均不能在TDO、QTO/A、QTO/A/X 生长,说明它们不能激活下游的报告基因。而阳性对照Y2Hgold[pGBKT7-53×pGADT7-T],Y2Hgold[pGBKT7-BpFLC×pGADT7-
BpSVP]和Y2Hgold[pGBKT7-BpSVP×pGADT7-Bp-FLC]均可以在TDO、QTO/A 平板上生长出菌落,说明在这3 个酵母中的报告基因HIS3、AUR1-C 和ADE2 都能够被激活。此外,Y2Hgold[pGBKT7-Bp-FLC×pGADT7-BpSVP]还能够在QDO/A/X 平板上生长,并且菌落呈蓝色,而对照均不能生长(图7)。由此表明:BpFLC 能够与BpSVP 结合,启动了4 个报告基因HIS3、AUR1-C、ADE2、MEL1 的表达。两个基因互换载体后,仍能激活上述4 个报告基因,说明白桦BpFLC 与BpSVP 存在相互作用。
3 结论与讨论
在植物的生命周期中,由营养生长向生殖生长的转变是至关重要的,“开花”是这个转变的开关。生理学和遗传学的分析表明开花是由多种环境因素和内源因素共同作用的结果。开花调节途径中的多种途径共同调节开花途径整合因子,促使顶端分生组织向生殖器官转变[3-4]。本研究中从白桦中克隆的BpFLC 和BpSVP 基因均编码MIKC 型蛋白,属于开花抑制因子。根据在模式植物拟南芥中的研究表明,FLC 在春化途径中起到至关紧要的作用,SVP 参与自主途径、温敏途径和赤霉素途径的调控[10,12,19]。这两个开花抑制因子均能够与开花促进因子FT 和SOC1 的启动子区域结合,调节其转录水平,从而延迟开花时间。最新研究表明一个非生物胁迫应答基因MEE3 能够结合FLC 的启动子区域,激活FLC 的表达[20]。此为还发现SVP 是在拟南芥的茎尖位置通过减少赤霉素合成来调控成花转变的[21]。白桦BpFLC 和BpSVP 这2 个蛋白的MADS-box 都高度保守。K-box 的保守性相对较差[22-23],经过生物信息学预测发现BpFLC 和BpSVP 均含有3 个连续的亲水α 螺旋。Yang 等[24]对K-box 的研究表明,前2个α 螺旋可能在二聚体结构形成中起决定性作用,但其识别的目标序列的特异性位点仍然未知。

图7 酵母中BpFLC 和BpSVP 之间相互作用
早期利用酵母双杂交技术,将拟南芥AtFLC、AtSVP 基因连入酵母表达载体中,在AH109 中进行双杂交验证,结果表明AtFLC 和AtSVP 存在相互作用[14]。利用最新的转录组分析及免疫共沉淀结果也表明AtFLC 与AtSVP 存在直接的作用,且AtSVP也与AtAP1 存在相互作用[25-26]。汤青林等将十字花科的芥菜BjSVP 和BjFLC 也利用酵母双杂交系统,在酵母菌中通过激活了酵母的4 个报告基因AUR1-C、HIS3、ADE2、MEL1,证实芥菜BjSVP 和Bj-FLC 存在相互作用[15]。并且利用pET 原核表达系统,通过蛋白体外表达以及SDS-PAGE,检测到芥菜BjSVP 和BjFLC 能形成稳定的蛋白复合物,推测BjSVP 和BjFLC 确实存在相互作用[27]。本文中白桦BpFLC 和BpSVP 酵母双杂交体系的建立,为这二者间的作用结构域和互作位点的筛选提供了一个可靠的技术平台。虽然酵母双杂交筛选高效、应用广泛,但它也存在固有的技术缺陷,如酵母属低等真核生物,与高等生物体内的蛋白翻译、折叠与加工等生物过程存在差异;再者酵母双杂交仅能检测2 个蛋白间的结合,不能检测多个蛋白间的相互作用;另外蛋白自身的自激活造成的假阳性及毒性、分泌性等假阴性结果也均限制了酵母双杂交的应用[28-29]。为了克服这一技术缺陷,采用其他原理的研究蛋白互作的技术,例如体内免疫沉淀(Co-IP)或双分子荧光互补技术(BiFC),将会揭示蛋白在体内的真实的互作情况,这些也是我们下一步的研究计划,以进一步确认BpFLC 和BpSVP 之间在体内是否存在互作。
综上,本文首次从林木中克隆出开花抑制因子BpFLC 和BpSVP,并利用酵母双杂交验证了BpFLC和BpSVP 存在直接的相互作用。本研究为下一步深入分析白桦FLC 与SVP 间的作用域和互作位点奠定了基础。
[1] Mouradov A,Cremer F,Coupland G.Control of flowering time:interacting pathways as a basis for diversity[J].Plant Cell,2002,14(Supplment):111-130.
[2] Simpson G G,Dean C.Arabidopsis the rosetta stone of flowering time[J].Science,2002,96:285-289.
[3] Boss P K,Bastow R M,Mylne J S,et al.Multiple pathways in the decision to flower:enabling,promoting,and resetting[J].Plant Cell,2004,16(Supplment):18-31.
[4] Blázquez M A,Weigel D.Integration of floral inductive signals in Arabidopsis[J].Nature,2000,404:889-892.
[5] Sheldon C C,Conn A B,Dennis E S,et al.Different regulatory regions are required for the vernalization-induced repression of Flowering Locus C and for the epigenetic maintenance of repression[J].Plant Cell,2002,14(10):2527-2537.
[6] Michaels S D,Amasino R M.Flowering Locus C encodes a novel MADS domain protein that acts as a repressor of flowering[J].Plant Cell,1999,11(5):949-956.
[7] Sheldon C C,Burn J E,Perez P P,et al.The FLF MADS box gene:a repressor of flowering in Arabidopsis regulated by vernalization and methylation[J].Plant Cell,1999,11(3):445-458.
[8] Hartmann U,Höhmann S,Nettesheim K,et al.Molecular cloning of SVP:a negative regulator of the floral transition in Arabidopsis[J].Plant J,2000,21(4):351-360.
[9] Liu C,Zhou J,Bracha Drori K,et al.Specification of Arabidopsis floral meristem identity by repression of flowering time genes[J].Development,2007,134(10):1901-1910.
[10] Li D,Liu C,Shen L,et al.A repressor complex governs the integration of flowering signals in Arabidopsis[J].Dev Cell,2008,15(1):110-120.
[11] Giakountis A,Coupland G.Phloem transport of flowering signals[J].Curr Opin Plant Biol,2008,11(6):687-694.
[12] Lee J H,Yoo S J,Park S H,et al.Role of SVP in the control of flowering time by ambient temperature in Arabidopsis[J].Genes Dev,2007,21(4):397-402.
[13] Abe M,Kobayashi Y,Yamamoto S,et al.A bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex[J].Science,2005,309:1052-1056.
[14] Fujiwara S,Oda A,Yoshida R,et al.Circadian clock proteins LHY and CCA1 regulate SVP protein accumulation to control flowering in Arabidopsis[J].Plant Cell,2008,20(11):2960-2971.
[15] 汤青林,李念祖,丁宁,等.芥菜开花调控蛋白SVP 与FLC 酵母表达载体的构建及其相互作用研究[J].园艺学报,2012,39(6):1175-1182.
[16] 卞丽萍,岳金权,张国珍,等.不同地理种源速生白桦化学组分[J].东北林业大学学报,2001,38(10):12-14.
[17] 李天芳,姜静,杨传平,等.我国白桦育种研究概况[J].江苏林业科技,2008,32(2):47-49.
[18] 郑唐春,臧丽娜,曲冠证,等.柽柳类锌指基因ThZFL 酵母诱饵表达载体的构建及其表达验证[J].东北林业大学学报,2011,39(12):4-8,15.
[19] Michaels S D,Amasino R M.Memories of winter:Vernalization and the competence to flower[J].Plant Cell and Environment,2000,23(11):1145-1153.
[20] Li C N,Zhou Y Y,Fan L M.A novel repressor of floral transition,MEE3,an abiotic stress regulated protein,functions as an activator of FLC by binding to its promoter in Arabidopsis[J].Environ Exp Bot,2015,113(5):1-10.
[21] Andrés F,Porri A,Torti S,et al.SHORT VEGETATIVE PHASE reduces gibberellin biosynthesis at the Arabidopsis shoot apex to regulate the floral transition[J].Proc Natl Acad Sci U S A,2014,111(26):2760-2769.
[22] Pelaz S,Gustafson Brown C,Kohalmi S E,et al.APETALA1 and SEPALLATA3 interact to promote flower development[J].Plant J,2001,26(4):385-394.
[23] Martinez Castilla L P,Alvarez Buylla E R.Adaptive evolution in the Arabidopsis MADS-box gene family inferred from its complete resolved phylogeny[J].Proc Natl Acad Sci U S A,2003,100(23):13407-13412.
[24] Yang Y,Fanning L,Jack T.The K domain mediates heterodimerization of the Arabidopsis floral organ identity proteins,apetala3 and pistillata[J].Plant J,2003,33(1):47-59.
[25] Gregis V,Sessa A,Colombo L,et al.Short vegetative phase,and apetala1 redundantly control agamous during early stages of flower development in Arabidopsis[J].Plant Cell,2006,18(6):1373-1382.
[26] Mateos J L,Madrigal P,Tsuda K,et al.Combinatorial activities of Short vegetative phase and flowering locus define distinct modes of flowering regulation in Arabidopsis[J].Genome Biol,2015,16:31.
[27] 汤青林,许俊强,宋明,等.芥菜开花信号整合子的两个核心转录因子FLC 和SVP 相互作用的体外检测[J].园艺学报,2011,38(12):2317-2324.
[28] Fields S.High throughput two hybrid analysis[J].FEBS J,2005,272(21):5391-5399.
[29] 马晶,赵国强,朱含,等.酵母双杂交系统检测SK2 与RyR2 蛋白的相互作用[J].郑州大学学报:医学版,2011,46(1):45-48.
