外来豚草属植物在不同环境约束下的入侵能力1)
2015-03-08桑倍佳黄栋陆兆华
桑倍佳 黄栋 陆兆华
(中关村中学,北京,100086) (中国科学院植物研究所) (中国矿业大学(北京)恢复生态学研究所)
责任编辑:潘 华。
我国国土跨越50 个纬度和5 个气候带,是生物种类最为丰富的国家之一,多样的气候条件很容易遭受外来植物的侵害[1]。据2000年报道,我国已知外来杂草有23 科108 种[2]。温度、湿度、光照、土壤和植被类型等环境因子对生物入侵过程有着重要的影响,因此,研究环境因子与入侵种之间的关系对控制该物种的入侵十分重要[3]。许多外来植物通过与本地物种的互利共生克服建立、归化甚至成为入侵种过程中的障碍,丛枝菌根(arbuscular mycorrhiza,AM)即是广泛存在于自然界的一种植物与丛枝菌根真菌形成的共生体,能够提高宿主植物对土壤水分、矿质营养等的吸收,进而促进宿主植物的生长发育,提高植物耐盐、耐旱、耐重金属毒害和抗病的能力[4]。温度是物种分布的限制因子之一。例如,某些多年生杂草的越冬能力和冬季最低温度有关。如果气候变暖导致北部地区出现暖冬,则这些杂草在牧区和自然系统中会造成更大的问题。热带和亚热带的入侵植物会更容易向北方扩散。土壤加热试验发现,山区草地的优势种结构发生了改变[5]。也许高海拔和寒冷的北部地区更易受到长期气温变化的影响。本研究选取在我国入侵严重的外来杂草豚草为研究对象,低温是限制外来入侵植物向高纬度和高海拔地区扩散的重要环境因子之一,而豚草能够入侵成功的重要机制之一则是很强的生态可塑性和旺盛的生命力。由于目前豚草在北京郊区已有迅速蔓延趋势,在密云、昌平、海淀、门头沟、丰台、顺义等区县均有发生,面积已达2 千km2。因此,本章通过控制试验模拟北京地区3 个不同海拔地点的温度,研究温度与豚草幼苗生长的关系,探讨温度对豚草向北京周边高海拔地区扩散的潜在影响。同时采用人工去叶胁迫方式模拟豚草的天敌采食,并结合两种天敌的生活习性,探讨天敌采食对豚草生长的影响以及生物防治在实际应用中可能出现的问题。
1 研究区概况
试验地点位于中国科学院北京森林生态系统定位研究站的温室内,该站地处暖温带落叶阔叶林区,试验期间温室内最高温度30.0 ℃,最低温度6.3 ℃。栽培基质为林内去除表面枯落物的0~25 cm 表土(棕壤,pH=6.0~7.0),V(表层土)∶V(河沙)=4 ∶1的比例混匀装入容积为5 L 的花盆,每盆装土5 kg。添加处理前基质养分质量分数:全氮质量分数为0.7 g·kg-1,全碳质量分数为8.2 g·kg-1,铵态氮质量分数为11.37 mg·kg-1,硝态氮质量分数为6.89 mg·kg-1。
2 研究方法
温度胁迫:将采于北京市当地的豚草种子播种到32 孔的育苗盘中,选取刚刚萌发且长势一致的豚草幼苗作为观测对象,每孔仅保留1 株幼苗,其余拔除。栽培基质取自中国科学院北京森林生态系统定位研究站附近的林内,为去除表面枯落物的0~25 cm 表土(棕壤,pH=6.0~7.0)。
将豚草幼苗移入RXZ-300D 智能光照培养箱,使用3 个培养箱模拟北京地区3 个不同海拔地点生长季(5—9月)的平均温度,分别为22.5 ℃(北京市海淀区,平均海拔50 m)、15.1 ℃(中国科学院北京森林生态系统定位研究站,海拔1 150 m)、9.4 ℃(灵山顶峰,海拔2 303 m)。培养期间采用全光照,每天光照时间设置为10 h。定期浇水。
培养20 d 后测量幼苗高度,之后将幼苗整株挖出,在60 ℃下烘24 h,用电子天平(精确度0.001 g)称其质量。
去叶试验:将采于北京当地的豚草种子播种到育苗盘内,6月选取长势一致的幼苗移栽到盆中,移栽2 个月后,于8月底将去叶处理的豚草仅保留一个叶片进行光合作用,其余叶片全部去掉。去除的叶片在60 ℃下烘48 h,用电子天平(精确度0.001 g)称量,在生长季结束后,加入到最终生物量分析中。9月中旬用便携式叶绿素测量仪(SPAD-502 Plus)测定叶片的叶绿素质量分数。10月底收获。
数据处理:采用双因素方差(two-way ANOVA)分析氮素和碳之间的交互作用,单因素方差(oneway ANOVA)和最小显著差异法(LSD)分析豚草在不同氮素水平下各参数的差异,独立样本t 检验分析同一氮素水平下丛枝菌根和灭菌处理之间的差异,所用软件为SPSS 13.0,α= 0.05。用Kaleida-Graph 4.0 软件绘图。
3 结果与分析
3.1 温度变化对豚草幼苗株高和质量的影响
试验中,随环境温度的降低,豚草幼苗的高度显著减少。在热量水平较高的低海拔地区,豚草幼苗生长较快;而在热量水平低的高海拔地区,豚草幼苗可以维持必要的生理功能并缓慢生长,而这种“表现最大化”和“表现维持”可能是植物通过可塑性适应环境的两种方式[6-7]。由表1可知,随着温度的降低,豚草幼苗的株高显著减少(P<0.01),说明低温限制了豚草幼苗期高度的生长,高海拔地区豚草幼苗生长缓慢,植株矮小。当温度从22.5 ℃降低到15.1 ℃时,豚草幼苗的生物量极显著减少(P<0.01),而15.1~9.4 ℃之间,豚草幼苗的生物量没有显著差异。

表1 温度变化对豚草幼苗生物量影响
3.2 去叶对豚草分枝数量和其叶片叶绿素质量分数的影响
3 个氮素水平下,去除叶片对豚草的分枝数都没有造成显著影响。失去叶片的分枝并没有枯落死亡,而是继续生长并再次长出新的叶片,反映了豚草较强的再生能力(表2和表3)。
去除叶片显著降低了豚草的生物量(P<0.05),在对照和碳素添加处理中对豚草的生物量却没有显著影响(表2和表3)。可能原因为:当土壤含氮量较高时,豚草分配到同化器官叶片的生物量较多,此时昆虫采食能对其生长造成很大的负面影响;而当土壤含氮量很低时,豚草分配到叶片的生物量本来就很少,因此采食对其总生物量积累的影响并不显著。
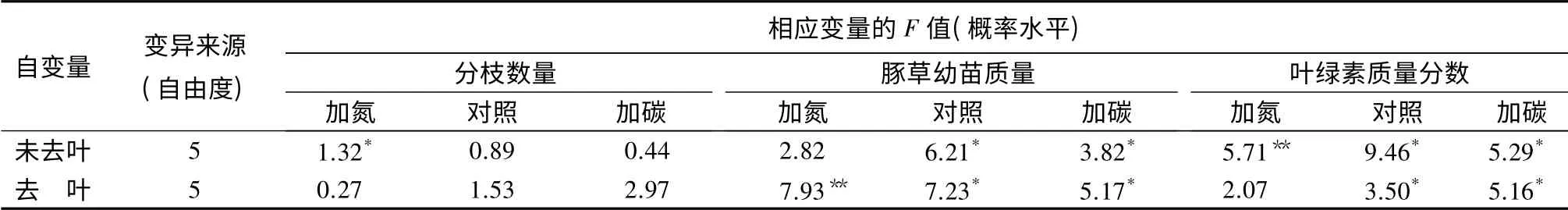
表2 去叶及加入氮和碳元素双因素方差分析中的F 值及概率水平

表3 不同处理对入侵物种影响的差异
3 个氮素水平下,去叶对豚草叶片的叶绿素值都没有显著影响。去叶后,豚草剩余叶片的颜色变深,测得的叶绿素值也略有增加,说明豚草能够通过补偿生长,增加剩余叶片中的叶绿素质量分数以维持必需的光合作用。
4 结论与讨论
豚草幼苗的高度和总生物量随着海拔升高和温度降低显著减少,因此低温可能是限制豚草向高海拔地区扩散的重要环境因子之一。模拟采食试验发现豚草具有很强的再生和补偿生长能力,将此特点与我国目前引入的两种天敌昆虫的生态学特性相结合进行推测得到,如果在豚草进入繁殖期之前,天敌昆虫的采食还没有达到足够强度,则其对豚草的生物控制作用将会被削弱。表型可塑性又称环境饰变,是物种在没有遗传变异的情况下,通过改变自身形态结构或生理而对环境变化作出反应的能力,是外来植物适应入侵地新环境、进而成功入侵的重要机制之一[6]。
模拟采食是研究昆虫—植物种间关系的一种重要方法。但是模拟采食的准确性一直受到很大关注,因为毕竟没有考虑植物、草食者、肉食者和以及寄生物在自然环境下复杂的相互作用[8]。一篇关于模拟采食和实际采食的综述表明,植物对各损伤类型的反应各异,有的相同,有的不同[9],但是,适当考虑这些差异,模拟采食在研究采食作用方面仍然是一个很有用的工具[8]。因此,本章将模拟采食的结果与豚草条纹叶甲以及豚草卷蛾的生态学特性相结合,综合讨论这两种天敌在实际应用中可能出现的问题及解决方法。
豚草条纹叶甲的幼虫、成虫均取食豚草的叶片,成虫还可取食花序,生活史与豚草同步,扩散蔓延速度快,是一种对豚草有强大控制潜力的天敌昆虫[10]。该叶甲被引入我国后,经生物学、生态学特性、控制效果、室内繁殖等一系列研究后,被认为有望在我国北方释放区建立自然种群并成为控制豚草的重要天敌。但是,该叶甲有群集取食的习性,幼虫的活动性差,如果种群密度过高,则很容易因为拥挤而使死亡率升高,产卵量减少,因此在饲养时应注意保持一定的空间间隔,避免互相干扰;田间释放后,应该加强监测,密切留意其种群密度,使其维持在一定的种群数量[11]。此外,该叶甲不取食在我国东北广泛分布的三裂叶豚草[12]。
豚草卷蛾是一种以幼虫钻蛀豚草茎杆,且在茎杆内完成幼虫和蛹期发育的重要天敌昆虫。其幼虫在寄主的茎杆内越冬,越冬滞育主要受短光照诱发,同时需低温或寄主植物衰老的刺激,解除滞育则需要14 h 以上的光照,与降雨无关[13]。从理论上讲,利用豚草卷蛾的越冬代种群在豚草营养生长前期控制植株是最佳时期,此时单个虫瘿即可阻止植株生长,很少开花,容易致死[14]。但是豚草卷蛾发生1代需要28~65 d,而其寄主豚草在雨量充足时一般8周即可开花,当豚草卷蛾达到足够的种群数量时,已失去了对豚草的最佳控制时期。在春季气候干旱的地区,春旱期寄主植物稀少,豚草卷蛾随气温升高而提前解除滞育,种群会因缺乏食物而大量死亡,而7—8月份雨季到来,降雨会抑制成虫羽化,导致豚草卷蛾成虫死亡率很高[15],而且易受到赤眼蜂袭击。可见,使用豚草卷蛾进行生物防治在实际应用中仍有一定困难,有学者提出解决这一困难的途径之一是在局部区域内人为提供寄主植物适宜的生长条件以维持必要的豚草卷蛾种群数量[13]。
综合以上观点,结合本试验的结果推测:在实际应用中,以上两种豚草天敌昆虫如果到8月底种群还没有形成一定规模,达到足够的采食强度,豚草较强的再生能力会严重削弱其控制效果。因此,生物防治法并不是没有缺陷,在使用这两种天敌昆虫对豚草进行防治时,应该加强田间监测,必要时人工干预,才能达到长期控制、一劳永逸的效果。
[1] 衣艳君.我国外来杂草的研究进展与展望[J].国土与自然资源研究,2005(1):83-85.
[2] 强胜,曹学章.中国异域杂草的考察与分析[J].植物资源与环境学报,2000,9(4):34-38.
[3] Alpert P,Bone E,Holzapfel C.Invasiveness,invisibility and the role of environmental stress in preventing the spread of non-native plants[J].Perspectives in Plant Ecology,Evolution and Systematics,2000,12(3):52-66.
[4] Smith M D,Hartnett D C,Wilson G W T.Interacting influence of mycorrhizal symbiosis and competition on plant diversity in tall grass prairie[J].Oecologia,1999,121(4):574-582.
[5] Harte J,Shaw R.Shifting dominance within a Montane vegetation community:Results of a climate-warming experiment[J].Science,1995,267:867-880.
[6] 耿宇鹏,张文驹,李博,等.表型可塑性与外来植物的入侵能力[J].生物多样性,2004,12(4):447-455.
[7] 张常隆,李扬苹,冯玉龙,等.表型可塑性和局域适应在紫茎泽兰入侵不同海拔生境中的作用[J].生态学报,2009,29(4):1940-1946.
[8] Baldwin I T.Herbivory simulations in ecological research[J].Trends in ecology and Evolution,1990,5(3):91-93.
[9] Lehtil K,Boalt E.The use and usefulness of artificial herbivory in plant-herbivore studies.in Weisser,and ecological studies[M].Berlin:Insects and Ecosystem Function Springer-Verlag,2004:173.
[10] Reznik S Y.The effects of feeding damage in ragweed Ambrosia artemisiifolia (Asteraceae)on populations of Zygogramma suturalis (Coleoptera,Chrysomelidae)[J].Oecologia,1991,88(2):204-210.
[11] 万方浩,王韧.豚草条纹叶甲的生态学特征[J].生态学报,1991,11(3):232-236.
[12] 关广清.专食豚草的昆虫:豚草条纹叶甲[J].生物防治通报,1987,3(4):175-178.
[13] 马骏,万方浩,郭建英,等.豚草卷蛾的生态适应性及其风险评价[J].应用生态学报,2003,14(8):1391-1394.
[14] McFadyen R E.The biological control program against Parthenium hysterophorus in Queensland.In:proceeding of the international symposium on biological control of weeds[M].Ottawa:Agriculture Canada,1999.
[15] 丁建清,万方浩.豚草卷蛾的生物学特征及其防治效果[M]//万方浩,关广清,王韧.豚草及豚草综合治理.北京:中国科学技术出版社,1993.
