细胞凋亡的信号通路
2015-03-07谢昆李兴权
谢昆,李兴权
红河学院生命科学与技术学院,云南蒙自661199
细胞凋亡的信号通路
谢昆,李兴权
红河学院生命科学与技术学院,云南蒙自661199
摘要:细胞凋亡是细胞程序性死亡的一种方式,与自噬和坏死有明显的区别。细胞凋亡的信号途径比较复杂,在凋亡诱导因子的刺激下经历不同的信号途径。本文就细胞凋亡的三条信号通路——线粒体途径、内质网途径和死亡受体途径做一综述,以便为人们进一步了解细胞凋亡发生的机制,从而对癌症及其他一些相关疾病的治疗奠定基础。
关键词:细胞凋亡;信号通路;线粒体途径;内质网途径;死亡受体途径
细胞凋亡是细胞程序性死亡(Program cell death,PCD)中特有的一种细胞死亡方式,是细胞在一系列内源性基因调控下发生的自然或生理性死亡过程。Kerr等1972年最早提出了凋亡(apoptosis)和坏死(necrosis)的概念[1],随后Paweletz等对其进行了详细的描述[2,3]。在形态学上,凋亡表现为核浓缩、细胞质密度增高、染色质凝聚、核膜破裂、核内DNA断裂、细胞集聚成团、形成凋亡小体(Apoptosome)等特征,这些凋亡小体最终被巨噬细胞清除,但不会引起周围细胞的炎症反应,另外,凋亡发生在单个细胞之间[4,5]。坏死,通常是由相邻的多个细胞之间发生细胞肿胀,细胞核溶解,细胞膜破裂,细胞质流入到细胞间质中,并伴发一系列的炎症反应,从而与凋亡表现为本质性区别[6,7]。
目前认为,凋亡发生的途径分为三种。第一种是线粒体途径,也称为内源性途径,该途径包括两类,第一类需要通过激活Caspase通路促进凋亡,在一序列凋亡诱导因素刺激下,线粒体中的Cyt C(细胞色素C)释放至细胞质中,从而与Apaf-1 (Apoptosis protease activating factor 1,凋亡蛋白酶活化因子1)结合形成多聚体,形成的多聚体再进一步与凋亡起始分子Caspase-9结合形成凋亡小体,凋亡小体激活Caspase-9,从而激活下游的凋亡执行分子Caspase-3,Caspase-6和Caspase-7等诱导细胞凋亡的级联反应;第二类是不依赖于Caspase途径的,通过线粒体释放AIF(Apoptosis induce factor,凋亡诱导因子)直接诱导凋亡的发生。但是在细胞内,直接检测AIF比较困难,而且AIF的变化不一定能代表凋亡发生的程度,因为引起凋亡发生的途径不一。第二种是死亡受体途径(也称为外源性途径),经由死亡受体(如TNF,Fas等)与FADD的结合而激活Caspase-8和caspase-10,进一步激活凋亡执行者caspase-3,6,7,从而促进凋亡的发生;第三条途径是内质网途径,内质网应激(蛋白质错误折叠或未折叠、内质网胁迫)会导致细胞内钙超载或钙离子稳态失衡一方面激活caspase-12,caspase-12进一步激活caspase-9而促进凋亡的发生,另一方面诱导Bcl-2(B细胞淋巴瘤蛋白)家族中促凋亡蛋白Bax和Bak的激活诱导凋亡[8]。
1 凋亡的线粒体途径
在哺乳动物中,由于凋亡的激活需要线粒体中细胞色素C(CytC)的释放,因此CytC由线粒体膜间隙释放到细胞质中的多少可以作为判断凋亡发生强弱的指标之一。有研究认为,CytC的释放是通过Bcl-2家族调控线粒体膜透化(Mitochondrial outer membrane permeabilization,MOMP),科学家们提出了两个主要的模型来揭示Bcl-2蛋白对MOMP的调控[9],第一种模型认为Bcl-2蛋白通过调节线粒体膜上线粒体渗透性转换孔(Permeability Transition Pore,PTP)的开闭来调控MOMP,从而调节CytC由线粒体膜间隙到细胞质的释放;另外一种模型认为在Bcl-2家族成员中,一些促凋亡蛋白如Bax、Bad等能促进线粒体外膜通道的打开,从而引起线粒体中CytC的释放。最近科学家又提出了第三种模型,认为在凋亡发生过程中,一些相关蛋白会引起线粒体形状和活性发生改变,从而引起CytC的释放。但是无论是哪一种模型,对Bcl-2家族成员中一些抗凋亡蛋白如Bcl-XL,Bcl-w如何抑制凋亡的发生还未研究清楚[10-12]。在细胞受到损伤或者胁迫情况下,将诱导线粒体介导的凋亡,线粒体在凋亡中的作用包括:释放半胱氨酸天冬氨酸蛋白酶(cysteinylasparate specific proteinase,Caspase)激活因子(如CytC)、Bcl-2家族成员中促凋亡蛋白的激活和抗凋亡蛋白的抑制、膜电位的改变等等[13-15]。MOMP除了可以释放CytC之外,还可以诱导Smac(the second mitochondrial derived activator of caspase)的释放,也称为低等电点(PI)的凋亡结合蛋白的直接抑制剂[16],Smac/Diablo在细胞凋亡时随CytC一起释放到胞浆,通过与IAPs(inhibitor of apoptosis proteins)、XIAP(X连锁凋亡抑制蛋白,X-linked inhibitor of apoptosis protein)等相互作用,直接抑制下游caspase并可多途径调节细胞凋亡,从而成为线粒体途径的一部分[17]。因此它本身并不能诱发凋亡,只是解除凋亡抑制的一种方式。研究发现Smac/Diablo比细胞色素C大,并且只有成熟的Smac/Diablo才具有生物活性,因此在其释放前必须有个加工过程。
在线粒体途径中,Bcl-2家族蛋白对凋亡的调控异常重要。在哺乳动物中,Bcl-2家族包括促凋亡蛋白和抗凋亡蛋白两类。促凋亡蛋白包括Bax、Bak、Bok、Bad、Bid、Bim、Bmf、Bik、Hrk、Noxa、Puma等,抗凋亡蛋白包括Bcl-2、Bcl-XL、Bcl-w、Mcl-1、Bcl-B等,所有的Bcl-2蛋白都包括1~4个BH区(Bcl-2 homology,Bcl-2同源区),正常情况下抗凋亡蛋白发挥作用可抑制凋亡的发生,当细胞受到损伤或胁迫时,抗凋亡蛋白功能受到抑制,而促凋亡蛋白发挥作用,从而引起细胞凋亡[18]。
2 死亡受体途径
死亡受体途径即为诱导凋亡的外源性途径,死亡受体家族包括8种,分别是肿瘤坏死因子受体1 (Tumor necrosis factor receptor 1,TNFR1),CD95(也称为APO-1或Fas)、死亡受体3(Death receptor 3,DR3)、死亡受体4(Death receptor 4,DR4也叫TRAILR1)、死亡受体5(Death receptor 5,DR5,也叫TRAILR2)、死亡受体6(Death receptor 6,DR6)、外异蛋白A受体(Ectodysplasin A receptor,EDAR)和神经生长因子受体(Nerve growth factor receptor,NGFR)[19,20],它们共同的特征是都具有相似的、富含半胱氨酸的细胞外结构域,并且都具备一个80 KDa大小的胞内死亡区域(Death domain,DD),DD一般使死亡受体与胞内凋亡机制相连。我们以Fas为例介绍其信号传导通路,FasL(凋亡相关因子配体)和Fas结合后三聚化,激活的受体与FADD(具有死亡功能区的Fas相关蛋白)结合,形成死亡诱导信号复合体(Death inducing signalling complex,DISC),然后募集凋亡起始分子Caspase-8 或Caspase-10,从而级联激活下游Caspase-3,6,7,进而诱导凋亡的发生[21]。在此途径中,FLIP(FLICE抑制蛋白)会抑制Caspase-8的激活[22]。另外,Caspase-8可催化Bid的切割(Bcl-2家族的促凋亡分子),正常情况下Bid存在于胞液中会诱导自噬,而在Fas或TNFR1诱导情况下,激活的Caspase-8和Caspase -10可切割Bid,使Bid抑制凋亡部位断裂(N-端1-60位),暴露出来的C端Bid(tBid),tBid可激活其自身的凋亡活性定位至线粒体外膜,在相关的其他Bcl-2家族成员的参与下可诱导线粒体外膜透化(MOMP),从而促进CytC的释放[8,22,23]。
3 内质网途径
内质网是细胞内重要的细胞器,参与蛋白质翻译后的修饰、折叠和寡聚化,还参与脂质代谢、类固醇激素的合成和钙的储存、信号转导,未折叠或错误折叠蛋白的增多、胞内钙的失衡引起的内质网的应激反应,以及由过强的内质网应激反应诱导的细胞凋亡,这是与死亡受体和线粒体介导的细胞凋亡不同的一条途径[24]。内质网与细胞凋亡相联系表现在两个方面:一是内质网对Ca2+的调控,二是内质网上Caspase的激活。Ca2+是细胞内重要的信号转导因子,对维持细胞内环境稳定、电子传递、信号传递起重要作用。正常情况下细胞内保持稳定的Ca2+浓度,当凋亡发生时细胞内Ca2+浓度升高,一方面Ca2+激活一系列的钙依赖性蛋白酶(如钙蛋白酶Calpains),钙蛋白酶在细胞内能切割一系列自噬相关蛋白(ATG)引发凋亡,如Atg5,Beclin-1等[25,26];另一方面Ca2+可以作用于线粒体,使线粒体膜孔道PTP通透性发生改变,从而促进凋亡。内质网上的Bcl-2家族蛋白能调节内质网中Ca2+浓度,使内质网和细胞质中的Ca2+浓度维持平衡,从而抑制凋亡的发生。
当内质网受到胁迫(如内质网中Ca2+稳态受破坏或内质网内错误折叠的蛋白质积累)作用时,Bcl-2家族蛋白对凋亡的抑制减弱,可激活Caspase-12而参与由内质网途径引起的凋亡,而在线粒体途径或死亡受体途径中起作用的刺激因子则不能够引起Caspase-12的激活。随后新的实验证据表明Ca2+依赖性的钙蛋白酶(Calpain)以及胞质中的Caspase-7能够激活内质网上的caspase-12前体,激活后的Caspase-12可以转运到细胞质中与caspase-9介导的凋亡过程相结合,活化Caspase-3,完成凋亡反应[24]。而Ca2+的释放可参与线粒体途径,是连接内质网途径和线粒体途径在细胞凋亡中的桥梁,内质网通过其表面的IP3R或RyP释放的Ca2+的进入细胞质,细胞质中高浓度的Ca2+促使线粒体膜上Bax激活[27]。Bax是一种促凋亡蛋白,属于Bcl-2家族,常以二聚体或多聚体的形式存在,长期以来人们都认为Bax蛋白激活是导致凋亡的一个重要事件,但直到现在人们还不清楚这一激活过程发生的机制。线粒体内蛋白通过PTP穿孔是凋亡的一个关键步骤。一旦发生这种情况,凋亡就会发生,细胞就会死亡,Bax是导致线粒体膜穿孔的原因,Czabotar等2013年最新发现了Bax在Ca2+刺激下从非活性形式向活性形式的转变过程,他们利用加速器生成的强大X射线光束获得了Bax的晶体结构,当Ca2+浓度升高时,利用与Bcl-2家族BH3区相同的BH3短肽与Bax结合,从而激活了Bax,就像钥匙开启挂锁一样,这些短肽打开了Bax分子,这种开启的Bax可以与其他的Bax分子结合,随后形成较大的Bax复合物,破坏细胞中的线粒体膜,形成PTP孔,当PTP孔打开以后,线粒体中的CytC释放至细胞质中引起凋亡[28]。
4 昆虫细胞中凋亡信号通路的研究进展
在昆虫中对凋亡的信号通路研究较少,大多以果蝇作为模式生物来进行凋亡研究,而在鳞翅目昆虫中,人们对凋亡的研究仅仅集中在凋亡家族成员如昆虫Caspase家族或者是一些凋亡抑制蛋白的研究当中。Wei等证实,经氨基酸饥饿处理的斜纹夜蛾Sl-HP细胞,经杆状病毒处理能诱导凋亡,他们发现,经过上述处理细胞中Caspase-3活性升高,Cyt C由线粒体向细胞质释放[29]。Juliette等对鳞翅目昆虫的EST文库进行了分析,鉴定出了27个种类中共66个编码Caspase样蛋白的序列,进化树分析显示鳞翅目昆虫至少包括5种类型的Caspase,根据与果蝇的同源性分析,他们推断Lep-Caspase-5和Lep-Caspase-6是凋亡的起始分子,而Lep-Caspase-1, Lep-Caspase-2和Lep-Caspase-3为凋亡的执行分子并且它们的序列之间具有部分重叠,Lep-Caspase-4的功能未知。在家蚕(Bombyx mori.)中缺少Lep-Caspase-2蛋白,故Lep-Caspase-2可能是夜蛾科(Noctuidae)特有蛋白[30],它们与哺乳动物Caspase-3功能一致,都具有切割含DEVD序列底物的功能。在昆虫细胞的凋亡途径中,影响凋亡发生的蛋白主要包括两类:天冬氨酸特异性半胱氨酸蛋白酶Caspase类和与哺乳动物相似的Bcl-2家族类蛋白(图1)。在哺乳动物中,凋亡的起始分子是Caspase-2、Caspase-8、Caspase-9、Caspase-10,果蝇中与之对应的是Dredd、Dronc和Strica三种蛋白分子,在其它昆虫如家蚕、埃及伊蚊(Aedes egypti)中也有这些蛋白,他们同哺乳动物一样能激活下游的Caspase凋亡执行分子,在果蝇中Caspase凋亡执行分子是Drice、Dcp-1、Decay和Damm,他们与哺乳动物中Caspase-3、Caspase-6、Caspase-7同源,目前认为果蝇的Drice与哺乳动物中caspase-3同源性较高,Drice能被Dronc激活引发细胞凋亡[31]。在鳞翅目昆虫中,如草地夜蛾中Sf-Caspase-1和斜纹夜蛾中Sl-Caspase-1与哺乳动物Caspase-3和果蝇Drice同源,它们在N端都包括一段很短的prodomain,能切割含DEVD序列的底物,它们的活性能被P35(泛胱天肽酶抑制蛋白)和IAP(凋亡抑制剂)抑制,在家蚕中同样存在Bm-Caspase-1分子,但目前还没有关于其生物信息学方面的分析[30]。
在果蝇中Buffy和Debcl蛋白与哺乳动物Bcl-2家族成员中Bok蛋白高度同源,研究证实Debcl具有促凋亡功能,而Buffy既有促凋亡也有抗凋亡功能。正常情况下Buffy抑制Debcl蛋白的活性,从而抑制凋亡,但当细胞受到损伤或者胁迫时,Buffy解除对Debcl的抑制,启动Dronc的活性。Dronc与哺乳动物Caspase-9同源,在果蝇中Dronc作为启动凋亡的初级应答原件与凋亡蛋白酶活化因子1(Apoptosis protease activating factor 1,Apaf-1)结合后进一步激活下游的Caspase凋亡执行分子(Effector caspases),从而诱导凋亡[32-34]。在果蝇中还有一类叫RHG蛋白的分子,包括Reaper、Hid 和Grim三种,研究证明在缺失了这三种蛋白的果蝇突变体在胚胎发育期就会出现死亡[35]。在正常细胞中,RHG抑制凋亡抑制蛋白(Caspase inhibitor proteins,DIAP1)活性,在凋亡因子刺激情况下,RHG通过泛素化途径降解DIAP1,解除其对凋亡的抑制作用,从而触发凋亡的发生[36-40](图2)。
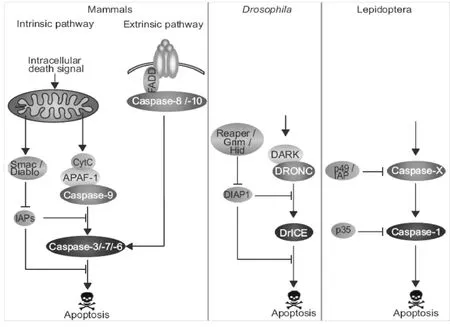
图1 哺乳动物,果蝇,鳞翅目昆虫中凋亡的途径[30]Fig.1ApoptoticpathwayinMammals,DrosophilaandLepidoptera[30]
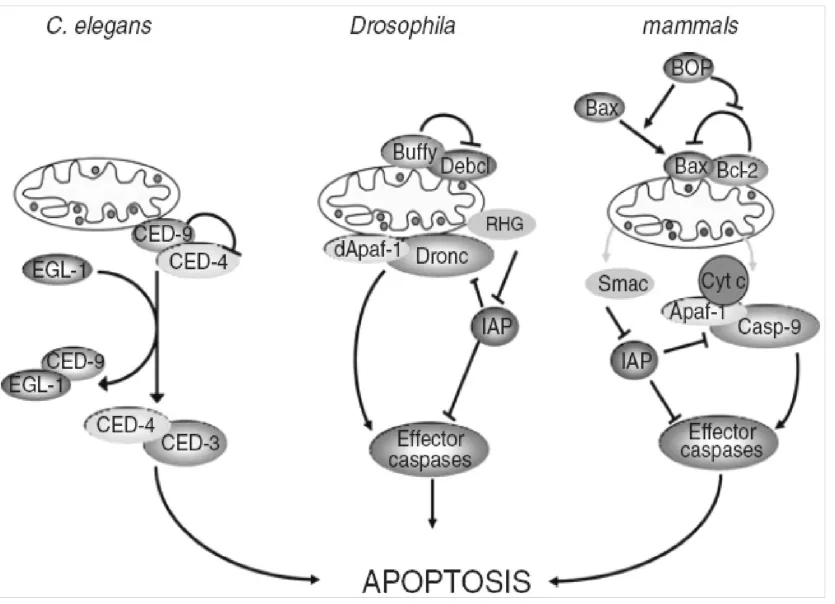
图2 线虫,果蝇和哺乳动物中调控凋亡的线粒体途径[32]Fig.2Mainregulatorsofthemitochondrialapoptoticpathwayin C.elegans,DrosophilaandMammals[32]
5 结语
细胞信号通路是一个异常复杂的网络,目前认为凋亡通路主要有死亡受体途径、线粒体途径和内质网途径三条,三条途径中除了线粒体途径中的AIF途径,其它途径都可经过Caspase的激活实现凋亡。另外,根据激活路径不同,凋亡途径又可分为外源性途径和内源性途径,外源性途径即死亡受体途径,内源性途径包括线粒体途径和内质网途径。在外源性途径中,当死亡受体和配体结合后可以通过Caspase-8的活化进一步激活下游的Caspase-3或其他的Caspase来诱导细胞凋亡,也可以通过活化的Caspase-8激活Bcl-2家族中的Bid进而通过线粒体途径诱导凋亡。而在内源性途径中,Caspase-8的下游包含了Bcl-2家族的调节分子,如果抑制凋亡的分子作用增强,即使存在Caspase-8的活化,也不能继续激活下游的分子,Caspase-3当然不会有变化。在凋亡的三条通路中,细胞可能走其中一条通路,也可能两条,甚至三条,而这些通路的启动时间各不相同,各个通路间相互交叉又相互联系,例如在线粒体信号途径和死亡受体信号途径中,死亡受体途径中的Caspase-8可以作用于Bid,切割Bid后产生15KDa的C末端片段tBid,tBid可以从胞质中转移到线粒体上,促进细胞色素C的释放[41]。
在昆虫凋亡通路的研究中,很少有证据表明昆虫也具有这三条通路,而且对这些凋亡通路中参与的蛋白也研究甚少,是否具有像哺乳动物一样的Caspase家族和Bcl-2家族蛋白还值得进一步研究和证实。人们以果蝇为模式生物研究了在凋亡通路中起重要作用的一些蛋白如Dronc、Drice、Dark、Buffy、Debcl、DIPA等[5]。这些蛋白与哺乳动物中Caspase家族和Bcl-2家族蛋白的功能相似,但是许多调控昆虫凋亡途径的蛋白还有待于我们进一步去证实。
总之,三个途径中有许多蛋白是控制凋亡发生的关键蛋白,这些关键蛋白又由许多相关蛋白调控,还有参与其中的许多蛋白或者是信号传导通路还未研究清楚,如内质网途径中Caspase-12是如何被激活的?Ca2+信号是如何调节Bax和Bak活性的?是否还有其它蛋白参与到Ca2+信号调控中等等一些问题需要去研究。因此,研究清楚这些复杂的凋亡调控蛋白和信号转导通路对细胞的生死调控具有重要意义。如果能发现所有的调控凋亡的分子在疾病中的作用,分析其功能,并研究出能发挥或抑制这些分子功能的药物,那么就可加速癌细胞自杀,从而提高免疫细胞的生命力,进而对癌症及其他一些相关疾病的治疗起到非常重要的作用。
参考文献
[1] Kroemer G, Galluzzi L, Brenner C. Mitochondrial membrane permeabilization in cell death[J]. Physiological reviews, 1972,87(1):99-163
[2] Kerr JF. History of the events leading to the formulation of the apoptosis concept[J]. Toxicology, 2002,181:471-474
[3] Paweletz N. Walther Flemming: Pioneer of mitosis research[J]. Nature Reviews Molecular Cell Biology, 2001,2(1):72-76
[4] Elmore S. Apoptosis: a review of programmed cell death[J]. Toxicol Pathol, 2007,35(4):495-516
[5] Min F, Dong WX. The mitochondrial pathways of apoptosis[J]. Journal of Beijing Medical University, 2002,1:157-183
[6] Hirsch T, Marchetti P, Susin SA, et al. The apoptosis-necrosis paradox. Apoptogenic proteases activated after mitochondrial permeability transition determine the mode of cell death[J]. Oncogene , 1997,15(13):1573
[7] Zeiss C. The apoptosis-necrosis continuum: insights from genetically altered mice[J]. Veterinary Pathology Online, 2003, 40(5):481-495
[8] Ghavami S, Hashemi M, Ande SR, et al. Apoptosis and cancer: mutations within caspase genes[J]. J Med Genet, 2009,46(8):497-510
[9] Desagher S, Martinou J-C. Mitochondria as the central control point of apoptosis[J]. Trends Cell Biol, 2000,10(9):369
[10] Autret A, Martin SJ. Emerging role for members of the Bcl-2 family in mitochondrial morphogenesis[J].Mol Cell,2009, 36(3):355-363
[11] Jourdain A, Martinou JC. Mitochondrial outer-membrane permeabilization and remodelling in apoptosis[J]. Int J Biochem Cell Biol, 2009,41(10):1884-1889
[12] Wasilewski M, Scorrano L. The changing shape of mitochondrial apoptosis. Trends in Endocrinology & Metab olism, 2009,20(6):287-294
[13] Autret A, Martin SJ. Bcl-2 family proteins and mitochondrial fission/fusion dynamics[J]. Cellular and molecular life sciences, 2010,67(10):1599-1606
[14] Tanner EA, Blute TA, Brachmann CB, et al. Bcl-2 proteins and autophagy regulate mitochondrial dynamics during programmed cell death in the Drosophila ovary[J]. Development, 2011,138(2):327-338
[15] Wang C, Youle RJ. The role of mitochondria in apoptosis[J]. Annu Rev Genet, 2009,43:95-118
[16] Waterhouse NJ, Ricci JE, Green DR. And all of a sudden it's over: mitochondrial outer-membrane permeabilization in apoptosis[J]. Biochimie, 2002,84(2):113-121
[17] Shi Y. Caspase activation, inhibition, and reactivation: a mechanistic view[J]. Protein science, 2004,13(8):1979-1987
[18] Zhou F, Yang Y, Xing D. Bcl‐2 and Bcl‐xL play important roles in the crosstalk between autophagy and apoptosis[J]. FEBS Journal, 2011,278(3):403-413
[19] Ashkenazi A, Dixit VM. Death receptors: signaling and modulation[J]. Science, 1998,281(5381):1305-1308
[20] French LE, Tschopp J. Protein-based therapeutic approaches targeting death receptors[J]. Cell Death & Differentiation, 2003,10(1):117-123
[21] Lavrik I, Golks A, Krammer PH. Death receptor signaling[J]. J Cell Sci, 2005,118(2):265-267
[22] Irmler M, Thome M, Hahne M, et al. Mattmann C. Inhibition of death receptor signals by cellular FLIP[J]. Nature, 1997,388(6638):190-194
[23] Kantari C, Walczak H. Dual philosophy in death receptor signalling[J]. Open Cell Signal J, 2011,3:27-34
[24] Breckenridge DG, Germain M, Mathai JP, et al. Regulation of apoptosis by endoplasmic reticulum pathways[J]. Oncogene,2003, 22 (53):8608-8618
[25] Wirawan E, Lippens S, Berghe TV, et al. Beclin1: a role in membrane dynamics and beyond[J]. Autophagy, 2012,8(1):6-17
[26] Yousefi S, Perozzo R, Schmid I, et al. Calpain-mediated cleavage of Atg5 switches autophagy to apoptosis[J]. Nat Cell Biol, 2006,8(10):1124-1132
[27]王虎,蔡定芳.Ca2+与内质网途径的细胞凋亡[J].国际病理科学与临床杂志,2006,26(4):2-285
[28] Czabotar PE, Westphal D, Dewson G, et al. Bax Crystal Structures Reveal How BH3 Domains Activate Bax and Nucleate Its Oligomerization to Induce Apoptosis[J]. Cell, 2013,152(3):519-531
[29] Wei W, Gai Z, Ai H, et al. Baculovirus infection triggers a shift from amino acid starvation-induced autophagy to apoptosis[J]. PLoS One, 2012,7(5):e37457
[30] Juliette C, Yannick P, Heiko V, et al. A comprehensive characterization of the caspase gene family in insects from the order Lepidoptera[J]. BMC Genomics,2011:12
[31] Cooper DM, Granville DJ, Lowenberger C. The insect caspases[J]. Apoptosis, 2009,14(3):247-256
[32] Brachmann CB, Jassim OW, Wachsmuth BD, et al. The Drosophila Bcl-2 family member dBorg-1 functions in the apoptotic response to UV-irradiation[J]. Current biology, 2000,10(9):547-550
[33] Galindo KA, Lu WJ, Park JH, et al. The Bax/Bak ortholog in Drosophila, Debcl, exerts limited control over programmed cell death[J]. Development, 2009,136(2):275-283
[34] Sevrioukov EA, Burr J, Huang EW, et al. Drosophila Bcl‐2 proteins participate in stress‐induced apoptosis, but are not required for normal development[J]. Genesis,2007,45(4):184-193
[35] White K, Grether ME, Abrams JM, et al. Genetic control of programmed cell death in Drosophila[J]. Science,1994, 264(5159):677
[36] Bergmann A. The role of ubiquitylation for the control of cell death in Drosophila[J]. Cell Death & Differentiation, 2009,17(1):61-67
[37] Chai J, Yan N, Huh JR, et al. Molecular mechanism of Reaper-Grim-Hid-mediated suppression of DIAP1-dependent Dronc ubiquitination[J]. Nature structural biology, 2003,10(11):892-898
[38] Goyal L, McCall K, Agapite J, et al. Induction of apoptosis by Drosophila reaper, hid and grim through inhibition of IAP function[J]. EMBO J,2000,19(4):589-597
[39] Wilson R, Goyal L, Ditzel M, et al. The DIAP1 RING finger mediates ubiquitination of Dronc and is indispensable for regulating apoptosis[J]. Nat Cell Biol, 2002,4(6):445-450
[40] Yoo SJ, Huh JR, Muro I, et al. Hid, Rpr and Grim negatively regulate DIAP1 levels through distinct mechanisms[J]. Nat Cell Biol, 2002,4(6):416-424
[41] Li H, Zhu H, Xu C, et al. Cleavage of BID by caspase 8 mediates the mitochondrial damage in the Fas pathway of apoptosis[J]. Cell, 1998,94(4):491-502
The Signal Pathway of Apoptosis
XIE Kun, LI Xing-quan
Department of Life Science and Technology/Honghe University, Mengzi 661199, China
Abstract:Apoptosis is a process of programmed cell death which distinguishes from autophagy and necrosis. The signal pathways of apoptosis are complex and different under apoptosis induced factor stimulating. Three kinds of signal pathways of apoptosis including Mitochondrial pathway, Endoplasmic Reticulum pathway and Death Receptor pathway were summarized in this review in order to make people further comprehend the mechanism of apoptosis,so that it should make a basis for us all to treat cancer and other related diseases.
Keywords:Apoptosis; signal pathway; Mitochondrial pathway; Endoplasmic Reticulum pathway; Death Receptor pathway
作者简介:谢昆(1975-),男,云南富民人,博士研究生,研究方向为动物生物化学与分子生物学. E-mail:xk_biology2@126.com
基金项目:云南省科技厅应用基础研究面上项目(2010ZC151)
收稿日期:2013-03-07修回日期: 2014-09-11
中图法分类号:R329.2+8
文献标识码:A
文章编号:1000-2324(2015)04-0514-05
