水分胁迫对油茶容器苗生理特性的影响
2015-03-07袁德梽
袁德梽
重庆三峡职业学院,重庆万州404155
水分胁迫对油茶容器苗生理特性的影响
袁德梽
重庆三峡职业学院,重庆万州404155
摘要:选择“湘林5号”一年生油茶容器苗为试验材料进行水分胁迫处理,设置8个水分处理组,研究水分胁迫下容器苗的生理特性。结果表明,叶片相对电导率、MDA和可溶性糖含量整体上表现出逐渐上升的趋势,并都在胁迫70 d时达到最大值,分别为56.357%、13.654 mmol•g-1和0.295 mg•g-1。POD活性、SOD活性、CAT活性、根系活力表现出先上升后下降的趋势,叶绿素含量表现出逐渐下降的趋势,在胁迫70 d降至最低值0.552 mg·g-1。说明在水分胁迫的前期对于油茶苗的影响很小;在胁迫的中期,油茶苗表现出较为复杂的变化过程;在胁迫的后期对油茶影响严重。因此,“湘林5号”具有一定抗旱能力,但持续干旱影响油茶苗生长,应及时浇水。
关键词:水分胁迫;油茶容器苗;生理特性
油茶(Camellia oleifera)在我国已有3000多年的栽培历史,是我国特有的一种木本油料树种,用途极其广泛[1]。主要集中在长江以南地区种植,由于我国山地面积较大、山区人口较多、经济条件较差,在山区种植油茶既能改善生态环境,又能推动山区经济发展,因此种植面积逐年增大。但在油茶种植中极易遭受干旱,致使油茶造林不成林,或低产低效,给广大油茶栽植者带来巨大损失[2],因此有关水分与油茶生长的研究日益受到重视。已有的研究集中在水分对油茶容器苗的保存[3]、油茶苗的移栽[4,5]、苗木培育成活率的影响[6]等方面,有关从生理指标的层面逐步系统研究水分胁迫对油茶苗影响的报道较少,因此,本项研究以栽培较为广泛的“湘林5号”一年生油茶容器苗为研究对象,调查叶片相对电导率、POD活性、SOD活性、CAT活性、MDA含量、叶绿素含量、根系活力、可溶性糖含量等指标,试图从维持细胞膜稳定性、保护酶活性、膜脂过氧化作用、物质代谢等角度研究水分胁迫对油茶容器苗生理特性的影响,为摸清水分影响油茶生长发育的机理奠定理论基础。
1 试验地概况
本实验在重庆市彭水苗族土家族自治县鞍子镇冯家村油茶田中进行,该村位于东经107°48'06″~108°36'58″之间,北纬28°57'43″~29°51'05″之间,海拔约500 m。属中亚热带湿润季风气候区,年均气温17.6℃,最低温13℃,最高气温18℃,年均降雨量1200 mm。试验地土壤主要为红壤,经测定发现土壤pH值4.8~5.1,有机质含量达18 g·kg-1以上,碱解氮含量达70.5 mg·kg-1,速效磷含量达12.6 mg·kg-1,速效钾含量达20.4 mg·kg-1,土层厚度75 cm以上。
2 材料与方法
2.1供试苗木
“湘林5号”一年生油茶容器苗,由重庆市林业科学研究院提供,苗木长势较一致,无病虫害。
2.2试验设计
选取油茶容器苗共250株,先一次性浇透水至容器袋底部渗水为止,置于穴盘内备用。处理的方法为不进行浇水,对油茶苗进行水分胁迫,共7个处理,包括胁迫10 d、20 d、30 d、40 d、50 d、60 d、70 d,每个处理5株容器苗,另取5株容器苗作对照,设3次重复,对照组正常每隔5 d浇水1次,其余的管理方法一致。
2.3项目指标测定
试验组10 d后开始测量,每隔10 d对处理与对照测定既定的指标,即土壤含水率(称重法)[7]、容器苗的叶片相对电导率、POD活性(愈创木酚)、SOD活性(NBT法)、CAT活性(过氧化氢法)、MDA含量(硫代巴比妥酸法)、叶绿素含量(丙酮乙醇法)、根系活力(甲烯蓝法)、可溶性糖含量(蒽酮法)[8]等指标,并持续至70 d。
2.4数据处理
本研究所得数据采用DPS7.05软件进行处理,Microsoft Excel 2003制图。
3 结果与分析
3.1水分胁迫下的土壤含水率
水分胁迫下的土壤含水率见表1,由此表可见随着胁迫时间的延长土壤含水率不断下降,处理10 d达56.08%,20 d达47.85%,30 d达44.17%,最后下降至24.44%,随着土壤含水率的不断下降,水分胁迫程度逐渐加强。

表1 水分胁迫下的土壤含水率变化Table 1 Change of soil moisture on water stress
3.2水分胁迫下的生理指标变化
3.2.1水分胁迫下的叶片相对电导率变化植物体在遇到逆境伤害时细胞膜会破裂,细胞内容物外渗,电导率上升,因此叶片相对电导率常用作植物抗逆的指标[9]。水分胁迫下的叶片相对电导率变化见图1,可以发现叶片相对电导率在10 d处理时与对照相同,均为33.325%,在20 d处理时达33.365%,较对照有所升高,之后逐渐上升,处理的叶片相对电导率均远远高于对照,在70 d处理时达到最高,为56.357%,而对照的变化幅度较小在32.695%~34.001%之间,变化较小。
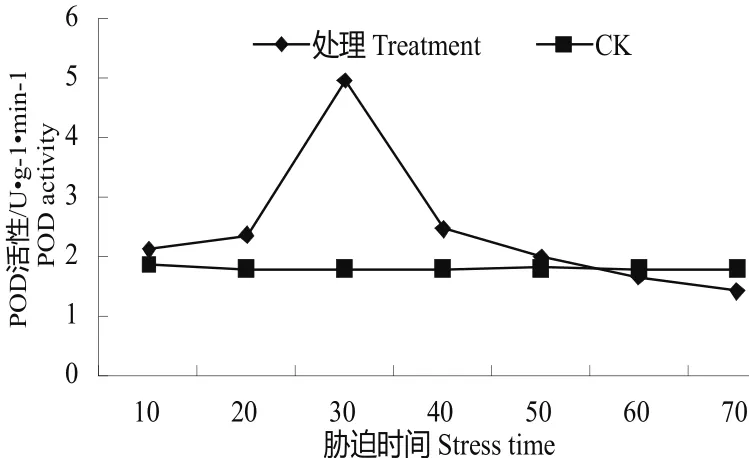
图1 水分胁迫下的叶片相对电导率变化Fig.1 Change of relative leaf conduction rate on water stress
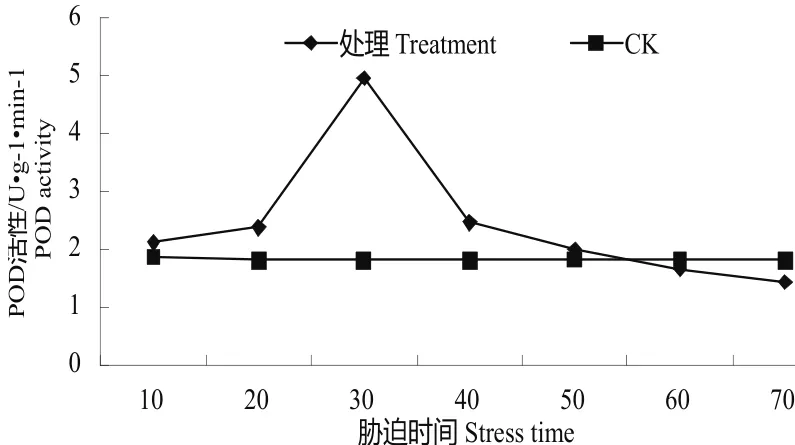
图2 水分胁迫下的POD活性变化Fig.2 Change of POD activity in water stress
3.2.2水分胁迫下的POD活性变化植物体在水分胁迫过程中产生过氧化氢,该物质能对细胞的氧化,对机体由有损害,POD作为一类解毒物质,能分解过氧化氢,减缓细胞的损伤[10]。经过水分胁迫,油茶容器苗的POD活性变化见图2,由此图可知在10 d处理时POD活性较对照有所升高,达2.111 U•g-1•min-1,在20 d时,进一步升高,达2.365 U•g-1•min-1,在30 d时达到最高,达4.956 U•g-1•min-1,之后POD活性下降,降至2.456 U•g-1•min-1,在60 d、70 d处理时较对照低,分别达1.654 U•g-1•min-1、1.423 U•g-1•min-1。对照的的POD活性在1.8 U•g-1•min-1左右,基本保持不变。
3.2.3水分胁迫下的SOD活性变化SOD广泛存在于植物体中,是一类活性较高的酶。在植物体衰老或逆境胁迫时,细胞内会产生大量的超氧自由基、羟自由基,破坏细胞膜,使细胞内溶物外渗,SOD能清除超氧自由基、羟自由基的酶,维持细胞膜的稳定性[9]。水分胁迫下的SOD活性变化见图3,由此图可知,经过70 d的水分胁迫之后,处理的SOD活性表现出先升高后降低的趋势,而对照的SOD火活性则维持在100.321 U•g-1~105.32 U•g-1之间,变化的幅度较小。在胁迫处理的开始,即10 d时,处理的SOD上升至100.414 U•g-1,仅比对照高出0.09%,在20 d处理时则大幅升高至152.365 U•g-1,比对照高51.87%,在30 d处理时达到最高,达214.32 U•g-1,在40 d、50 d处理时缓慢下降,分别降至200.354 U•g-1、199.654 U•g-1,在60、70 d时急剧下降至152.365 U•g-1、95.324 U•g-1,尤其在70 d处理时较对照低。
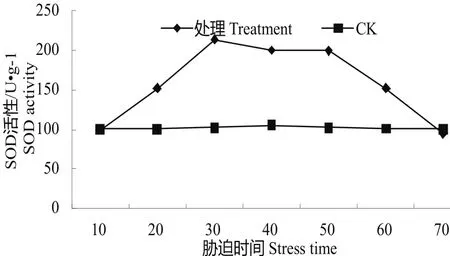
图3 水分胁迫下的SOD活性变化Fig.3 Change of SOD activity in water stress
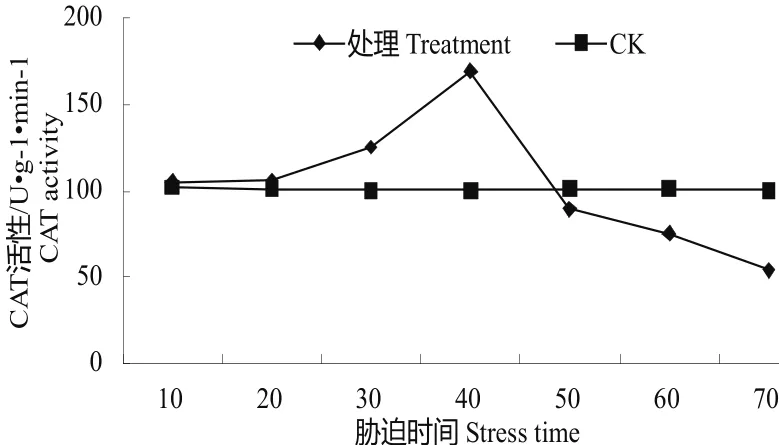
图4 水分胁迫下的CAT活性变化Fig.4 Change of CAT activity in water stress
3.2.4水分胁迫下的CAT活性变化CAT能清除超氧自由基、羟自由基的酶,维持细胞膜的稳定性,作用与SOD类似[9]。经70 d水分胁迫,油茶容器苗的CAT活性变化见图4,可以发现处理的CAT活性变化呈先上升后下降的趋势,而对照的表现基本成水平的直线,变化的幅度较小,在100.321 U•g-1•min-1-102.321 U•g-1•min-1之间。在10 d处理时,容器苗的CAT仅上升至105.32 U•g-1•min-1,20 d缓慢上升至106.214 U•g-1•min-1,在30 d、40 d处理时出现大幅度的上升,上升至125.365 U•g-1•min-1、169.331 U•g-1•min-1,其中40 d时达到最大值,之后开始下降50 d处理时下降至89.354 U•g-1•min-1,较对照低,之后60、70 d处理时进一步下降,分别降至75.254 U•g-1•min-1、54.211 U•g-1•min-1。
3.2.5水分胁迫下的MDA含量变化MDA是植物在逆境中膜脂过氧化作用的产物,通常用于判断细胞膜的损伤程度[9]。油茶容器苗在水分胁迫下的MDA含量变化见图5,由此图可知,处理的MDA含量呈逐步上升的趋势,由10 d处理的4.374 mmol·g-1,达70 d处理的13.654 mmol·g-1,而对照的变化快最小,维持在4.365 mmol·g-1~4.562 mmol·g-1之间。在10 d处理时处理较对照仅上升0.21%,在20 d时达5.321 mmol·g-1,在30、40 d时分否学会升至6.987 mmol·g-1、7.001 mmol·g-1,自后上升的幅度明显加大,50 d、60 d、70 d分别达8.656 mmol·g-1、10.325 mmol·g-1、13.654 mmol·g-1、分别较对照高89.74%、129.44%、203.56%。
3.2.6水分胁迫下的叶绿素含量变化叶绿体是参与光合作用的的主要色素,其与抗旱性有关[9]。水分胁迫对油茶容器苗叶绿素含量的影响见图6,可以发现处理各阶段的叶绿素含量均较对照降低,对照的变化幅度较小,在1.325 mg·g-1~1.362 mg·g-1之间,在10 d处理时处理的叶绿素含量为1.361 mg·g-1,与对照差异不大,随着处理的延长,处理的含量逐步降低,20 d时达1.254 mg·g-1,30 d时达1.165 mg·g-1,至70 d时最低,达0.552 mg·g-1,远低于对照的水平。
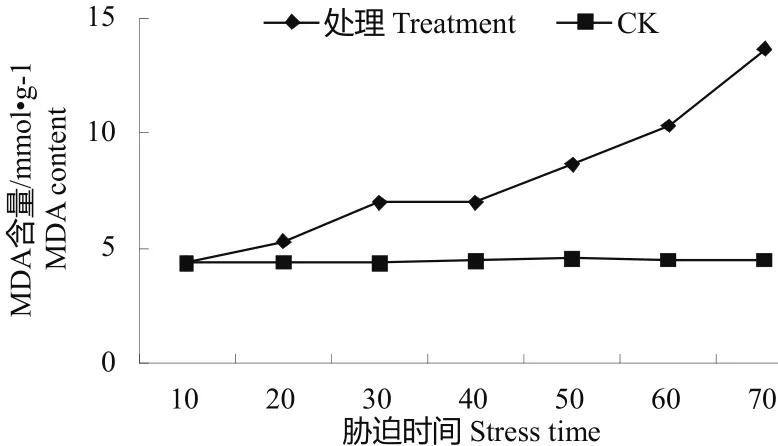
图5 水分胁迫下的MDA含量变化Fig.5 Change of MDAcontent in water stress

图6 水分胁迫下的叶绿素含量变化Fig.6 Change of chlorophyll content in water stress
3.2.7水分胁迫下的根系活力变化根系是植物体吸收养分的重要器官,逆境下的根系活力与水分胁迫的关系密切[9]。水分胁迫下油茶的根系活力变化见图7,由此图可知处理的根系活力呈现上升后下降的趋势,对照基本呈水平直线,变化的幅度很小。在10 d的处理时。根系活力为0.259 m2,之后在20 d时达最高,为0.296 m2,在30 d时开始下降,在50 d时下降至0.258 m2,略高于对照,在60、70 d时下降至对照以下,分别达0.213 m2、0.195 m2。
3.2.8水分胁迫下的可溶性糖含量变化可溶性糖在植物细胞属渗透调节物质,在胁迫试验中是重要参考指标[9]。水分胁迫下的可溶性糖含量变化见图8,可见可溶性糖含量在整个处理时期内呈逐渐上升的趋势,每一个时期均较对照高,对照维持在0.11 mg·g-1~0.13 mg·g-1之间,基本不变。在开始处理时,处理的含量仅略高于对照,10 d时达0.123 mg·g-1,在20 d处理之后,大幅度升高,在30 d时达0.195 mg·g-1,较对照升高50%,在40 d处理时达0.216 mg·g-1,在70 d时达最高,为0.295 mg·g-1,较对照升高145.83%。
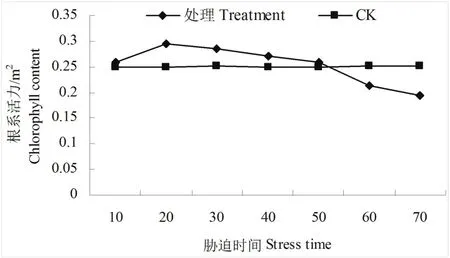
图7 水分胁迫下的根系活力变化Fig.7 Change of root activity in water stress
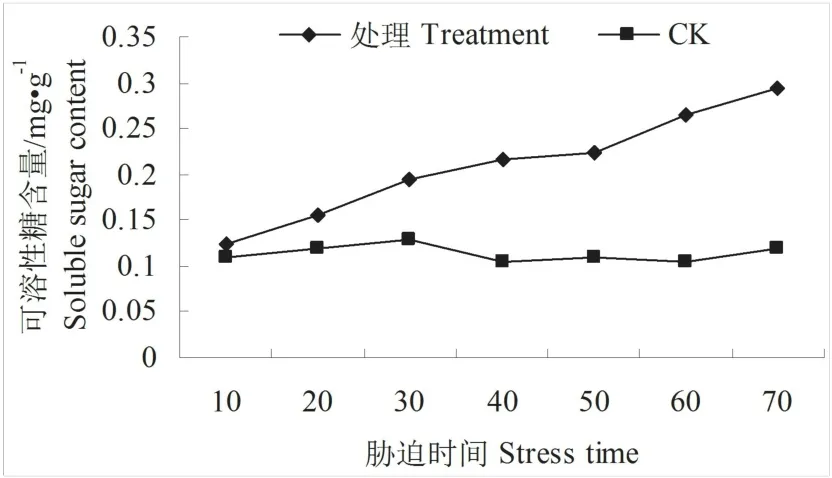
图8 水分胁迫下的可溶性糖含量变化Fig.8 Change of soluble sugar content in water stress
3 讨论
3.1水分胁迫对率叶片相对电导率的影响
用相对电导率在植物水分亏缺下测定电解质渗出率的变化程度,以研究其与抗旱能力的关系已有很多报道[11-13],均认为在水分胁迫下的,相对电导率会逐渐升高,本实验得出的结论与上述结论相同,说明在水分胁迫下细胞膜受损害越严重,透性越大,电解质外渗较多,同时水分降低,其浓度积累提高,使电导率上升。
3.2水分胁迫对保护酶活性的影响
POD、SOD、CAT均能维持细胞膜的稳定性,一般认为在其活性在水分胁迫时表现出的变化趋势为先升高降低[4,14],本研究的结论与上述报道相同,可见在处理开始时,由于受到水分的胁迫,使油茶容器苗的细胞膜受到一定程度的伤害,油茶容器苗因此产生一定的抗逆反应,POD、SOD、CAT的活性上升,试图杀灭有害物质,保持细胞膜的稳定性,但随着时间的延长,胁迫的加剧,上述酶类的活性下降,接近失活。
3.3水分胁迫对MDA含量的影响
MDA与水分胁迫的关系报道较多,马书燕等[15]报告,以柔枝松幼苗为研究对象,水分胁迫发生后时MDA含量逐渐上升,赵雅静等[16]也得出相同的结论。本研究的结论与之一致,说明幼苗在10 d处理时已受到水分胁迫,细胞膜受到伤害,膜脂过氧化作用加剧,细胞内产生了大量MDA,随着处理时间的延长,伤害进一步加剧,使MDA含量出现大幅度的增加。
3.4水分胁迫对叶绿素含量的影响
通常认为植物随着水分胁迫的加剧,叶绿素含量会不断的减少[17,18]。本研究的结论与上述结论一致,其原因是随着水分胁迫处理时间的延长,叶绿素开始分解,含量降低,叶片的颜色退绿,影响电子传递,进而使光合作用减弱,影响了油茶正常的生长。
3.5水分胁迫对物质代谢的影响
根系活力、可溶像糖含量能表征植物体物质代谢的情况,左文博等[19]对小麦的研究表明,干旱胁迫下小麦根系活力表现出先上升后下降的变化过程,可溶性糖含量则表现出持续上升,胡晓健等[20]对马尾松苗的研究中也发现干旱胁迫下可溶性糖含量表现出持续上升。这与作者的研究结论一致。其原因可能是在水分胁迫的前期,根系活力为适应胁迫,最先出一定的抗逆机制,有一定的上升,但随着处理时间的延长,胁迫加剧,根系受到的伤害较严重,活力呈下降的趋势。同时水分胁迫能使积累的淀粉转化为可溶性糖,增加了细胞汁液的浓度,增强了细胞防脱水能力,维持细胞的正常代谢。
综上所述,说明在水分胁迫的前期对于油茶苗的影响很小。在胁迫的中期,这一时期油茶苗表现出了较为复杂的变化过程。在胁迫的后期油茶苗受伤害较重。数据上,则表现出剧烈的变化,保护酶活性、叶绿素、根系活力迅速地降至最低点,直至失活,MDA含量、可溶性糖含量均有较大幅度的增长。说明“湘林5号”是一类有一定抗旱能力的树种,但有一定的耐旱极限,如遇到40d以上的干旱,应补充水分。
参考文献
[1]庄瑞林.中国油茶[M].北京:中国林业出版社,1988
[2]黎章矩,曾燕如,戴文圣.油茶低产低效的内外影响因子调查[J].林业科技开发,2009,23(5):26-31
[3]胡娟娟,曹志华,束庆龙,等.失水程度及基质重对油茶容器苗生长和生理特性的影响[J].安徽农业大学学报,2012,39(2):243-246
[4]曹志华,张四七,刘春,等.油茶移栽苗失水程度对生理生化特性的影响[J].安徽农业大学学报,2011,38(3):444-447
[5]张诚诚,曹志华,胡娟娟,等.水分胁迫对油茶容器苗生理生化特性的影响[J].安徽农业大学学报,2013,40(4):623-626
[6]曹志华,胡娟娟,束庆龙,等.水分胁迫对油茶容器苗生理特性及成活率的影响[J].经济林研究.2011,29(4):60-64
[7]沈其荣.土壤肥料学通论[M].北京:高等教育出版,2008
[8]张宪政,陈凤玉,王荣富.植物生理学[M].第І版.沈阳:辽宁科学技术出版社,1994
[9]赵可夫.植物抗性生理研究[M].第І版.济南:山东科学技术出版社,1992
[10]南芝润,范月仙.植物过氧化氢酶的研究进展[J].安徽农学通报,2008,14(5):27-29
[11]艾尼莫明.几种植物细胞膜的差别透性及其与抗旱性的关系[J].干旱区研究,1994,11(1):57-61
[12]曹铁森,许明宪.水分胁迫对梨幼树叶水势的影响[J].西北农业大学学报,1992,20(1):91-93
[13]刘彦琴,张丰雪,杨敏生.电导率在白杨杂种无性系耐旱性鉴定中的应用[J].河北林果研究,1997,12(4):301-305
[14]孙群,胡景江.植物生理学研究技术[M].杨凌:西北农林科技大学出版社,2006
[15]陈庆华.干旱胁迫对大豆苗期叶片保护酶活性和膜脂过氧化作用的影响[J].安徽农业科学,2009,37(14):6396-6398
[16]赵雅静,翁伯琦,王义祥,等.植物对干旱胁迫的生理生态响应及其研究进展[J].中国稻麦科技,2009(2):45-50
[17]王新建,何威,杨淑红,等.干旱胁迫下4种楸树嫁接苗叶绿素含量的变化[J].经济林研究,2008,26(1):20-24
[18]黄承建,赵思毅,王龙昌,等.干旱胁迫对苎麻叶绿素含量的影响[J].中国麻业科学,2012,34(5):208-212
[19]左文博,吴静利,杨奇,等.干旱胁迫对小麦根系活力和可溶性糖含量的影响[J].华北农学报,2010,25(6):191-193
[20]胡晓健,喻方圆,刘建兵,等.干旱胁迫对不同种源马尾松苗木针叶内可溶性糖含量的影响[J].南京林业大学学报(自然科学版),2009,33(5):55-59
Effects of Water Stress on Physiological Characteristics of Camellia oleifera Seedlings
YUAN De-zhi
Chongqing Three Gorges Vocational College, Wanzhou 404155, China
Abstracts: Seedlings of Xianglin No.5 were chosen as experimental materials, which were grown in 8 substrates with different water contents, and the difference of physiological characteristics of Camellia oleifera seedlings was analyzed. The results that under water stress condition the relative leaf conduction rate, MDA content and soluble sugar content were increasing in general and reached the highest values of 56.357%,13.654 mmol·g-1, 0.295mg·g-1, respectively in 70 d. POD activity, SOD activity, CAT activity, root activity at first increased, then decreased, while the chlorophyll content was decreasing to the lowest value of 0.552 mg·g-1in 70 d. In conclusion, C.oleifera seedlings grew well under the early water stress, under the mid water stress seedlings showed a more complex process of change; under the late stage stress the seedlings seriously injured. It is important that C. oleifera seedlings of Xianglin No.5 is in drought tolerance, but it should be watered on time; otherwise their growth will be affected.
Keywords:Water stress; Camellia oleifera seedlings; physiological characteristics
作者简介:袁德梽(1968-),男,重庆万州人,本科,副教授.从事植物生理研究及高职高专教育管理工作. E-mail:ydz098765@163.com
收稿日期:2013-06-12修回日期: 2013-08-23
中图法分类号:S794.4
文献标识码:A
文章编号:1000-2324(2015)04-0509-05
