甜瓜果实八氢番茄红素脱氢酶基因(CmPDS)的克隆与表达
2015-03-07赵军林丛红滋苏长跃于喜艳王秀峰
赵军林,丛红滋,苏长跃,于喜艳,王秀峰
山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,农业部黄淮地区园艺作物生物学与种质创制重点实验室,山东泰安271018
甜瓜果实八氢番茄红素脱氢酶基因(CmPDS)的克隆与表达
赵军林,丛红滋,苏长跃,于喜艳,王秀峰*
山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,农业部黄淮地区园艺作物生物学与种质创制重点实验室,山东泰安271018
摘要:以甜瓜自交系‘M01-3’果实cDNA为模板,采用RT-PCR和RACE技术,克隆了甜瓜果实八氢番茄红素脱氢酶(PDS)基因cDNA全长序列,命名为CmPDS(基因注册号:KC507802)。序列分析表明,该基因有开放阅读框1731 bp,编码576个氨基酸,与其他植物PDS氨基酸序列具有较高的同源性,尤其与黄瓜、南瓜、苦瓜PDS氨基酸序列高达92.6% ~ 87.8%。荧光定量分析表明,该基因在甜瓜不同器官中均有表达,在叶片和授粉后25 d的果实中表达量较高,在根中表达量最低;随果实发育成熟,该基因表达量呈现先升高后降低趋势。
关键词:甜瓜; PDS基因;克隆;表达
甜瓜(Cucumis melo L.)是一种世界广泛栽培的园艺作物,是世界公认的十大健康水果之一,其果实含大量碳水化合物、柠檬酸和类胡萝卜素,可消暑清热、生津解渴[1]。甜瓜果肉颜色主要有黄色、橙色、绿色和白色,形成甜瓜果肉颜色的色素主要是叶绿素和类胡萝卜素[2],类胡萝卜素是广泛存在于植物及微生物中的一大类色素,能赋予植物花和果实黄色、橙色和红色等颜色[3]。光合作用中,类胡萝卜素具有吸收光能,以非辐射的方式耗散过剩能量,保护反应中心的重要作用。营养方面,类胡萝卜素具有增强免疫、抗氧化、增进细胞间联接交流、预防、延缓及治疗癌症的功能;类胡萝卜素还是维生素A的前体[4-7],人体自身不能合成类胡萝卜素,主要依赖饮食供应。
八氢番茄红素脱氢酶(Phytoene desaturase, PDS)是类胡萝卜素合成途径中重要的限速酶,催化八氢番茄红素向ζ-胡萝卜素转化。Chamovitz等从抗达草灭的组囊藻R2突变体中分离到发生了点突变的PDS,继而从非突变体中获得正常PDS,之后他们以此基因为探针分离到大豆和番茄PDS[8-10]。Yan P等人克隆了番木瓜PDS,该基因全长2096 bp,包含一个长为1716 bp的CDS区,并研究发现随番木瓜果实成熟,该基因的表达量增加[11]。到目前为止,番茄、烟草和拟南芥等植物中PDS研究已有报道,而甜瓜胡萝卜素代谢相关基因的研究主要集中在上游的八氢番茄红素合成酶(PSY)基因,对参与脱氢反应的酶基因研究较少。本试验旨在以厚皮甜瓜自交系‘M01-3’为材料,克隆甜瓜PDS全长序列,并且进行分析,为进一步研究该基因在甜瓜果实发育过程中的生物学功能奠定基础。
1 材料与方法
1.1试验材料
供试材料为本实验室选育的白色果肉厚皮甜瓜自交系‘M01-3’。于2012年2月25日播种育苗,4月1日定植于山东农业大学园艺实验站日光温室内,开花后人工授粉,严格控制自交,常规栽培管理。
质粒和大肠杆菌DH5α为本实验室保存;限制性内切酶、T4连接酶、胶回收试剂盒、反转录试剂盒、pMD18-T和荧光定量试剂盒等购自大连宝生物公司;引物由上海生工生物工程技术服务有限公司合成;其他试剂为国产分析纯。
1.2基因克隆与生物信息学分析
根据自交系‘M01-3’果实发育期(30 d左右),取授粉后15 d迅速生长的甜瓜果实,采用LiCl沉淀法[12]提取总RNA,以提取的总RNA为模板,用大连宝生物公司的RNA PCR(AMV)Ver2.1反转录试剂盒反转录得到cDNA。
根据其他植物PDS序列(黄瓜:XM_004156918;南瓜:JN253178;苦瓜:AY494790)设计引物P1和P2(表1)扩增中间片段。根据中间片段序列测序结果设计1条3’上游基因特异引物GSP1,与通用引物B26扩增3’端序列。PCR扩增条件为:94℃4 min;94℃45 s,56℃45 s,72℃90 s,30个循环;72℃10 min。
用末端转移酶TdT给cDNA加尾,根据中间片段序列设计基因特异性引物GSP2和GSP3,与通用引物AUAP和AAP(表1)做巢式PCR扩增5’端序列。巢式PCR扩增条件:用GSP2与AUAP做第1轮PCR:94℃4 min;94℃45 s,60℃50 s,72℃90 s,20个循环;72℃10 min;以第1轮PCR产物为模板,用GSP3与AUAP做第2轮PCR:94℃4 min;94℃45 s,58℃50 s,72℃90 s,30个循环;72℃10 min。
对得到的序列拼接,在两端UTR区设计引物HP1和HP2(表1)扩增PDS全长。PCR条件:95℃5 min;95℃45 s,58℃45 s,72℃2 min,30个循环;72℃10 min。
利用DNAMan、Bioedit、MEGA4、Tmpred、SPOMA等分子生物学软件对克隆的甜瓜PDS全长序列进行分析。

表1 PCR引物Table 1 Primers used in PCR
1.3实时荧光定量PCR
采用Trizol法分别提取盛花期甜瓜根、茎、叶、花以及不同发育时期果实总RNA,反转录合成cDNA,进行实时荧光定量PCR扩增。内参基因参照Hui Hao等[13]选择actin gene(GenBank:FJ763186)。内参引物序列为EF-R和EF-F;目的基因引物序列为PDS-R和PDS-F(表1)。
反应程序为:94℃3 min;94℃10 s,60℃30 s,72℃10 s,40个循环,参照Livak和Schmittgen[14]的方法计算目的基因的相对表达量。
2 结果与分析
2.1甜瓜果实PDS基因的克隆
以甜瓜果实总RNA反转录的cDNA为模板,利用P1和P2扩增中间片段,得到约1200 bp的条带(图1,A),与目的条带大小相仿。经测序比对,该片段即为目的片段,全长1216 bp。
用GSP1和通用引物B26扩增,得到约400 bp的条带(图1,D),与目标条带长度相近,经测序比对,该片段即为3’端片段,长395 bp。
用GSP2和通用引物AAP做第1轮PCR,电泳检测未出现目标条带。以第1轮PCR扩增产物为模板,用GSP3和通用引物AUAP做第2轮PCR,电泳检测显示在600 bp处获得特异性条带(图1,B)。经测序比对,该序列与中间片段序列有135 bp重叠,证明该片段为甜瓜果实PDS 5’端。
用HP1和HP2扩增,得到约1900 bp特异条带(图1,C),测序比对确定该序列为目的基因。
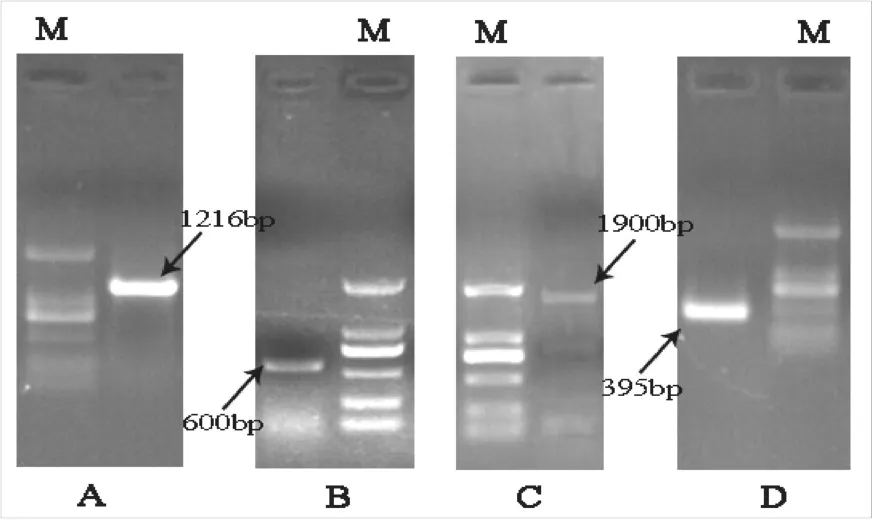
图1 甜瓜PDS的PCR扩增Fig.1 Agarose gel electrophoresis for the cloning of PDS from melon
2.2CmPDS序列分析
将获得的1906 bp甜瓜PDS全长序列,命名为CmPDS。将该cDNA序列提交GenBank,登录号为KC507802。该cDNA包含1个完整的开放阅读框(126~1856),编码576个氨基酸。
经BLAST分析,CmPDS cDNA序列与黄瓜PDS的同源性高达97%,与南瓜为96%,与苦瓜为92%,与花蓖麻、番木瓜、甜橙、番红花等同源性在79% ~ 83%之间。
推导的氨基酸序列分子量为64 kDa,pI为7.1。利用Tmpred软件对其在质体膜上可能的跨膜拓扑学模型的分析预测表明,CmPDS在104 ~ 123(20)个氨基酸之间(图2)有1个跨膜区(大于500为有意义的跨膜区)。在54 ~ 154部位有1个AIRC(AIR carboxylase)结构域。
利用SOPMA程序对CmPDS的二级结构进行预测,结果显示该蛋白的二级结构由20.34%的不规则卷曲、18.92%的延伸链、40.28%的α-螺旋和11.46%的β-转角构成。α-螺旋和不规则卷曲构成了该蛋白二级结构的主要成分。

图2 CmPDS跨膜结构分析Fig.2 Analysis of transmembrane region of CmPDS
2.3CmPDS氨基酸序列比较和进化树分析
利用DNAMan将CmPDS cDNA序列推导的氨基酸序列与数据库中已登录的其它高等植物的PDS氨基酸序列进行同源关系比较,结果显示,参比植物PDS编码的氨基酸序列存在较高的同源性(图3)。CmPDS编码的氨基酸序列与黄瓜、南瓜、苦瓜、草莓、番木瓜、柿、葡萄、番茄和拟南芥PDS编码的氨基酸同源性分别为92.6%、88.6%、87.8%、77.9%、77.1%、77.3%、76.8%、74.6%和76.6%。
利用BioEdit和MEGA4软件,将CmPDS cDNA序列推导的氨基酸序列与数据库中已登录的22种高等植物的PDS氨基酸序列构建(bootstrap)neighbor joining(NJ)树。结果显示,CmPDS编码的氨基酸序列先与黄瓜归为一类,说明在参比的22种植物中,甜瓜和黄瓜的亲缘关系最近,其次是南瓜和苦瓜,而与水稻、文心兰等亲缘关系较远(图4)。

图3 不同植物PDS氨基酸序列同源性比较Fig.3 Alignment of predicted amino acid sequence of PDS from different plant

图4 不同植物PDS氨基酸序列进化树分析Fig.4 Phylogenetic trees of the deduced amino acid sequences of plant PDS by MEGA5
2.4CmPDS在甜瓜不同器官和果实不同发育时期的表达分析
用荧光定量方法对CmPDS表达模式进行了研究。结果表明CmPDS在甜瓜根、茎、叶、花和果实中均有表达,在叶片中表达量最高,根中表达量最低(图5);在果实发过程中,以授粉后25 d的果实CmPDS表达量为最高,接近自然成熟时,表达量降低(图6)。
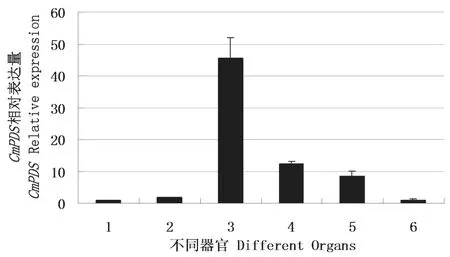
图5 甜瓜不同器官CmPDS表达量Fig.5 Expression of CmPDS in different organs

图6 不同发育时期甜瓜果实CmPDS表达量Fig.6 Expression of CmPDS in different stages of fruit development
3 讨论
在高等植物中,类胡萝卜素是在质体中通过类异戊二烯途径合成的[15]。近年来,对类胡萝卜素生物合成的关键限速反应研究较多,同时对相关编码酶的基因做了较多研究,其中包括:牻儿基牻牛儿基焦磷酸合成酶(GGPS)、八氢番茄红素合成酶(PSY),八氢番茄红素脱氢酶(PDS)、ζ–胡萝卜素脱氢酶(ZDS)[16]。PDS是类胡萝卜素合成途径中的重要限速酶,催化八氢番茄红素两步脱氢生成ζ–胡萝卜素,ζ–胡萝卜素再经ZDS催化进一步脱氢生成番茄红素[17]。本试验成功克隆了甜瓜CmPDS全长,该cDNA全长1906 bp,具有完整的开放阅读框(第126 ~ 1856个bp),共1731 bp,编码576个氨基酸。该序列完整的开放阅读框推导的氨基酸序列与黄瓜、南瓜、苦瓜、草莓、番木瓜、柿、葡萄、番茄和拟南芥PDS编码的氨基酸同源性分别为92.6%、88.6%、87.8%、77.9%、77.1%、77.3%、76.8%、74.6%和76.6%。经氨基酸疏水性分析发现,本试验克隆的CmPDS所推导的氨基酸序列有一个显著的长20个氨基酸的跨膜区,该跨膜区上游的氨基酸序列保守性比较差,而下游序列与其他植物PDS所编码的氨基酸序列的同源性较高。
作为代谢的限速酶,PDS在植物胡萝卜素代谢中起重要作用。以往研究表明,在以类胡萝卜素为主要色素的植物中,PDS表达随果实的发育成熟而上调[11]。本试验研究表明甜瓜CmPDS在果实发育成熟过程中也表现上调的趋势,但在完全成熟时表达量降低,可能因为果实接近自然成熟时类胡萝卜素的分解代谢增强。类胡萝卜素能作为脱落酸和独脚金内酯的合成底物被代谢掉,也能被类胡萝卜素裂解双加氧酶催化分解,生成多种与果实香气相关的物质[18],而且CmPDS表达量的这种变化趋势和已报道的该甜瓜品种类胡萝卜素含量变化趋势相符合[14]。有研究证明,PDS表达受色素含量的调控,白色组织的PDS mRNA含量要远高于绿色组织[19],但本试验发现CmPDS在绿色组织叶片中的表达量最高,可能原因是叶片中光合作用强,类胡萝卜素代谢旺盛。类胡萝卜素既能吸收可见光做为碳同化的能源,又能通过叶黄素循环耗散掉过剩的能量。也有研究证实PDS受到沉默时,植物叶片会发生白化现象,色素含量改变,光合作用受阻[20-26],这与本试验中CmPDS在叶片中的表达量最高的结果相符合。
本研究结果表明,CmPDS在叶片光合作用和果实类胡萝卜素积累中起重要作用,在此基础上可望分离CmPDS果实特异性启动子并转化甜瓜,为CmPDS在甜瓜品质育种中的应用奠定基础。
参考文献
[1] Lester GE, Eischen F. Beta-carotene content of postharvest orange-fleshed muskmelon fruit: effect of cultivar, growing location and fruit size[J]. Plant Foods Hum. Nutr., 1996,49:191-197
[2] Tadmor Y, Burger Y, Katzir N, et al. Melon Plants Comprising Tetra-cis-Lycopene: US, 2012/0324597 A1[P].2012-12-20
[3] Christopher IC, Barry JP. Source to sink: regulation of carotenoid biosynthesis in plants[J]. Trends in Plant Science, 2010,15(5):266-274
[4] Aluru M, Xu Y, Guo R, et al. Generation of transgenic maize with enhanced pro-vitamin Acontent[J]. J. Exp. Bot., 2008,59(13):3551-3562
[5] Butrum RR, Clifford CK, Lanza E. NCI dietary guidelines: rationale. Am[J]. J. Clin. Nutr., 1988,48:888-895
[6] DellaPenna D, Pogson BJ. Vitamin synthesis in plants: tocopherols and carotenoids[J]. Annu. Rev. Plant Biol, 2006,57:711-738
[7] Paine JA, Shipton CA, Caggar S, et al. Improving the nutritional value of Golden Rice through increased pro -vitamin A content[J]. Nat. Biotechnol., 2005,23(4):482-487
[8] Bartley GE, Viitanen PV, Pecker I. Molecular cloning and expression in photosynthetic bacteria of a soybean cDNA coding for phytoene desaturase, an enzyme of the carotenoid biosynthesis pathway[J]. Proc Natl Acad Sci USA, 1991,88:6532-6536
[9] Chamovitz D, Pecker I, Hirschberg J. The molecular basis of resistance to the herbicide norflurazon[J]. Plant Mol Biol, 1991,16:967-974
[10] Pecker I, Chamovitz D, Linden H. A single polypeptide catalyzing the conversion of phytoene to ζ-carotene is transcriptionally regulated during tomato fruit ripening[J]. Proc Natl Acad Sci USA, 1992,89:4962-4966
[11] Yan P, Gao XZ, Shen WT, et al. Cloning and expression analysis of phytoene desaturase and ζ-carotene desaturase genes in Carica papaya[J]. Mol Biol Rep, 2011,38:785-791
[12] Wang Yan, Li Zhen, Liu Xiao-xia, et al. A Comparative Study on Three Methods for the Extraction of Total RNA from Pinus bungeana[J]. Agricultural Biotechnology, 2011,12(5):663-665
[13] Hao Hui, Ma Leyuan, Cong Hongzi, et al. Isolation and characterization of a muskmelon cDNA encoding Lycopene Beta-cyclase[J]. Gene, 2011,503:147-151
[14] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using realtime quantitatiggve PCR and the 2-ΔΔCT method[J]. Methods, 2001,25:402-408
[15] Lichtenthaler HK, Schwender J, Disch A, et al. Biosynthesis of isoprenoids in higher plants chloroplasts proceeds via a mevalonateindependent pathway[J]. FEBS Lett, 1997,40(3):271-274
[16]黄彬城,季静,王罡,等.植物类胡萝卜素的研究进展[J].天津农业科学,2006,12(2):13-17
[17] Breitenbach J, Sandmann G.ζ-Carotene cis isomers as products and substrates in the plant poly-cis carotenoid biosynthetic pathway to lycopene[J]. Planta, 2005,220(5):785-793
[18] Ibdah M, Azulay Y, Portnoy V, et al. Functional characterization of CmCCD1, a carotenoid cleavage dioxygenase from melon[J]. Phytochemistry, 2006,67(15):1579-1589
[19] Giuliano G, Bartley GE, Scolnik PA. Regulation of carotenoid biosynthesis during tomato development[J]. Plant Cell, 1993,5:379-387
[20] Busch M, Seuter A, Hain R. Functional analysis of the early steps of carotenoid biosynthesis in tobacco[J]. Plant Physiol, 2002,128:439-453
[21] Kumagai MH, Donson J, Della-Cioppa G, et al. Cytoplasmic inhibition of carotenoid biosynthesis with virus-derived RNA[J]. Proc Natl Acad Sci USA, 2005,92:1679-1683
[22] Masclaux F, Charpenteau M, Takahashi T, et al. Gene silencing using a heat-inducible RNAi system in Arabidopsis[J]. Biochem Biophys Res Commun, 2004,321:364-369
[23] Tao X, Zhou X. A modified viral satellite DNA that suppresses gene expression in plants[J]. The plant J., 2004,38:850-860
[24] Wang T, Iyer LM, Pancholy R, et al. Assessment of penetrance and expressivity of RNAi-mediated silencing of the Arabidopsis phytoene desaturase gene[J]. New Phytol, 2005,167:751-760
[25] Silvia T, Theres EK, Beat K. RNA interference-based gene silencing as an efficient tool for functional genomics in hexaploid bread wheat[J]. Plant Physiol, 2006,142:6-20
[26] Guo HS, Fei JF, Xie Q, et al. A chemical-regulated inducible RNAi system in plants[J]. Plant J, 2003,34:383-392
Cloning and Expression of Phytoene Desaturase Gene (CmPDS) from Fruit of Muskmelon
ZHAO Jun-lin, CONG Hong-zi, SU Chang-yue, YU Xi-yan, WANG Xiu-feng*
College of Horticulture Science and Engineering/Shandong Agricultural University, State Key Laboratory of Crop Biology, Key Laboratory of Biology and Genetic Improvement of Horticultural Crops(Huanghuai Region), Ministry of Agriculture, Tai’an 271018, China
Abstract:A full-length cDNA encoding Phytoene desaturase(PDS), named as CmPDS (GenBank: KC507802), was isolated from the fruit of‘M01-3’of Muskmelon(Cucumis melo L.) by RT-PCR and RACE. The cDNA has an open reading frame of 1731 bp and encodes a polypeptide of 576 amino acids. Sequence analysis showed that deduced CmPDS protein was highly homologous to other PDS proteins from different species, especially with Cucurbita moschata, Momordica charantia and Ricinus communis, that the identity of amino acid sequence was up to 92.6% ~ 87.8%. Real time PCR analysis indicated that CmPDS expressed in different organs. The transcription levels of CmPDS in leaves and fruit of 25 d after pollination were higher than that in stems, roots and tubers respectively. With the development of fruit, the expression of the gene rised but reduced in the end.
Keywords:Cucumis melo L.; PDS gene; cloning; expression
*通讯作者:Author for correspondence. E-mail:xfwang@sdau.edu.cn
作者简介:赵军林(1989-),男,硕士研究生,研究方向为蔬菜学. E-mail:zhaojlin2012@163.com
基金项目:现代农业产业技术体系建设专项资助(CARS-25)
收稿日期:2013-09-06修回日期: 2013-09-20
中图法分类号:S652
文献标识码:A
文章编号:1000-2324(2015)04-0481-06
