干旱胁迫对不同种源油蒿幼苗的生长和形态可塑性的影响1)
2015-03-07王林龙李清河
王林龙 李清河
(国家林业局林木培育重点实验室(中国林业科学研究院林业研究所),北京,100091)
徐军 朱雅娟
(中国林业科学研究院沙漠林业实验中心) (中国林业科学研究院荒漠化研究所)
责任编辑:潘 华。
表型可塑性是同一基因型对不同环境条件响应而产生不同表型的特征[1-4],即生物通过改变形态、生理及发育等性状来适应环境变化的能力[5-8]。有研究表明,不同种群植物间的表型可塑性可能存在差异[9-12],而且不同环境因素也可能会引起不同种群植物特征可塑性的差异[13-15]。目前,国内关于表型可塑性研究中,主要集中不同物种在异质性大的非生物因子上,如光照、温度、水分和营养等[15-17],而对不同种源油蒿的形态可塑性的研究相对较少。
油蒿(Artemisia ordosica Krasch),是我国特有优良固沙半灌木植物,分布在内蒙古、宁夏、陕西和甘肃等温带沙地,分布中心在鄂尔多斯高原。我国温带半干旱区的沙地中,油蒿具有很强的适应性,并成为植被演替过程中最重要的物种之一[18]。经过野外观察发现,油蒿在沙漠、沙地及草原与荒漠过渡带都有分布,其长势存在差异,因此选取毛乌素沙地、库布齐沙漠、草原荒漠过渡带3 个种源地的油蒿为材料,进行不同水分处理,了解不同种源油蒿对干旱胁迫的形态可塑性响应,为我国干旱、半干旱地区引种提供理论依据。
1 材料与方法
从库布齐沙漠、毛乌素沙地、草原和荒漠过渡带3 个地点(分别以DEOR,WSOR 和HYOR 表示)采集一定数量具有代表性的母株种子(采集地基本概况见表1),并于2014年4月中旬在中国林业科学研究院温室内进行营养钵(长宽高规格为5 cm ×5 cm×5 cm,基质为V(蛭石)∶ V(珍珠岩)∶ V(草炭土)=1∶ 3∶ 6)育苗,待幼苗出现后,选取生长状况一致的植株移栽到花盆(长宽高规格为15 cm ×15 cm×20 cm),基质为V(蛭石)∶ V(珍珠岩)∶ V(草炭土)=2∶ 3∶ 5。待植株完全成活后,以称质量法进行水分处理,并隔期观测数据。3 个种源(DEOR,WSOR,HYOR)和3 种水分处理(CK,轻度干旱,重度干旱)随机组合成9 个试验组。水分处理过程中,待移栽的植株成活后,每隔3 d 浇水一次,并进行称质量,确保土壤含水量为5%、15%、30%,直至2014年9月底破坏性采样结束。为了减小试验环境差异,将9 个试验组系统放置在中国林业科学研究院温室苗床上。

表1 不同种源油蒿种子采集地的降水量和蒸发量
叶片形态的测定:参照Pigliucci[4]等方法进行植株形态性状测定。相对生长率(RGR)=(lnMt2-lnMt1)/(t2-t1)(M 指植株干生物量,t 表示不同时间);根冠比(R/S)=根生物量/地上生物量,比叶面积(ASL)=叶面积/叶生物量;表型可塑性指数(PI)=(处理中某一性状的最高值-最低值)/最高值;平均表型可塑性指数(PIm)是植株3 个形态性状表型可塑性指数的平均值,反映不同种源油蒿对干旱胁迫的相对平均形态适应能力。
数据处理:对以上各项指标采用双因素方差分析和单因素方差分析及多重比较(Duncan 法),比较不同种源油蒿的形态性状对干旱胁迫的响应差异。所有分析在SPSS 19.0 软件下完成,图表采用Microsoft Excel 2007 软件进行绘制。
2 结果与分析
2.1 不同种源油蒿形态性状对干旱胁迫的可塑性
由表2可知,种源与干旱胁迫强度对相对生长率无显著影响,而种源与干旱胁迫强度的交互作用对相对生长率影响显著(P <0.05)。其中不同种源油蒿的相对生长率相差不大,表现为库布齐沙漠油蒿最大,毛乌素沙地次之,草原荒漠过渡带最小(表3)。不同干旱胁迫强度下,油蒿的相对生长率由大到小表现为对照组、中度干旱胁迫、重度干旱胁迫,其中重度干旱胁迫与对照组之间,油蒿的相对生长率存在显著差异(表4)。
不同种源油蒿间根冠比存在显著差异(P <0.05),不同干旱程度胁迫对油蒿的根冠比存在极显著影响(P <0.001),而不同种源与水分的交互作用对油蒿根冠比不存在显著影响。不同种源油蒿的根冠比大小相似,表现为库布齐沙漠与草原荒漠过渡带油蒿根冠比相近,但均小于毛乌素沙地油蒿(表3)。不同干旱程度胁迫下,油蒿根冠比由大到小表现为重度干旱、中度干旱、CK,其中重度和中度干旱胁迫下油蒿根冠比,显著大于对照组油蒿(表4)。
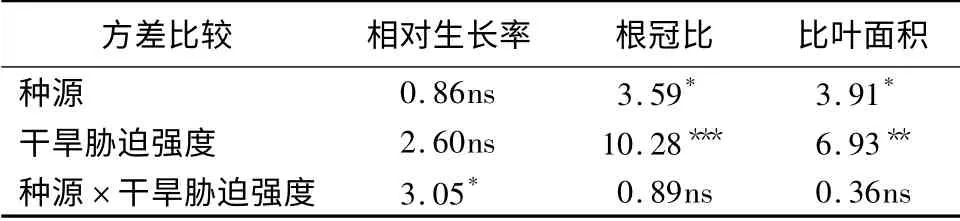
表2 不同种源和干旱胁迫强度对油蒿形态性状的方差分析(F 值)

表3 不同种源间油蒿相对生长率、根冠比和比叶面积的比较

表4 不同水分条件油蒿相对生长率、根冠比和比叶面积的比较
不同种源油蒿的比叶面积存在显著差异(P<0.05),不同干旱胁迫强度对油蒿的比叶面积存在极显著影响(P <0.01),而不同种源与干旱胁迫强度的交互作用对油蒿根冠比不存在显著影响。不同种源油蒿比叶面积,表现为毛乌素沙地最大,草原荒漠过渡带次之,库布齐沙漠最小,其中毛乌素沙地油蒿的比叶面积显著大于库布齐沙漠沙漠油蒿(表3)。不同干旱胁迫程度下,表现为重度干旱油蒿比叶面积显著小于中度干旱与对照组油蒿,且中度干旱油蒿比叶面积小于对照组油蒿(表4)。
2.2 不同种源油蒿的形态平均表型可塑性
由表5可以看出,不同种源油蒿相对生长率、根冠比和比叶面积的表型可塑性指数间不存在显著性差异。其中,相对生长率和根冠比可塑性指数表现为库布齐沙漠油蒿最大,草原荒漠过渡带油蒿次之,毛乌素沙地油蒿最小,但比叶面积的表型可塑性指数表现为草原荒漠过渡带油蒿最大,库布齐沙漠油蒿次之,毛乌素沙地油蒿最小(表5)。3 个不同种源油蒿的平均表型可塑性指数,表现为库布齐沙漠油蒿显著大于毛乌素沙地油蒿,这可能是毛乌素沙地油蒿比叶面积显著大于库布齐沙漠油蒿所引起的结果,且两者油蒿比叶面积大小相差较大,而草原荒漠过渡带油蒿的比叶面积与库布齐沙漠和毛乌素沙地油蒿无显著差异。

表5 不同种源油蒿的相对生长率、根冠比和比叶面积的表型可塑性指数
3 结论与讨论
植物形态和生存环境之间是一种相互协同进化和适应的关系,形态可塑性是植物的一种自适应行为[19-20]。植物通过生长率的变化、生物量分配及光合器官构件调整来增加对所处逆境的抵抗能力,从而保证其正常生长和发育。植物形态可塑性是植物适应不同环境的主要方式,可以提高植物的抗逆性,同时对植物的分布和演替都具有重要的作用。
相对生长率是植物形态学、生理学和解剖学特征的一个综合反映[21]。3 个种源地油蒿的相对生长率相差不大。而随着干旱程度加剧,油蒿的相对生长率呈减小趋势,这与Maes[22]和莫雅芳[23]等人的研究结果相一致。在干旱环境条件下,植物土壤水分含量低,不能满足植物生长所需,影响植物正常的光合作用,即对植物的生长起到抑制作用,造成植物的相对生长率较低的结果。
生物量分配是植物对不同环境适应的主要对策之一[24-25]。3 个种源地油蒿根冠比也相差不大,表现为毛乌素沙地油蒿根冠比大于草原荒漠过渡带和库布齐沙漠油蒿。而随着干旱程度加剧,油蒿的根冠比呈增大的趋势,这与王晓鹏[26]和井大炜[27]等人研究结果相一致。油蒿在干旱情况下,增加对根的投入[28-30],从而增加根长利用更深层土壤的资源,同时增加根系吸收表面积,使植物更有效地吸收土壤中的水分,以增强对水分的获取能力。
植物受到干旱胁迫时,会通过适当改变其生物量分配和比叶面积来提高其适合度[31-35]。3 个种源地油蒿,毛乌素沙地油蒿的比叶面积最大,草原荒漠过渡带次之,库布齐沙漠油蒿最小,其中毛乌素沙地油蒿比叶面积与库布齐沙漠油蒿差异显著。随着干旱程度加剧,油蒿的比叶面积呈减小趋势,这与蔡海霞[33]等人研究结果相一致。在干旱环境下,植物通过减小比叶面积,来降低植物的水分蒸发量,从而有利于植物的生长和发育。
综上所述,3 个种源地油蒿的相对生长率、根冠比和比叶面积对干旱胁迫的形态可塑性响应模式差异不大,表现为随干旱加剧,植株的相对生长率和比叶面积呈减小趋势,而根冠比呈增大趋势。不同种源油蒿间,油蒿相对生长率和根冠比相差不大,而毛乌素沙地油蒿比叶面积显著大于库布齐沙漠油蒿,草原荒漠过渡带油蒿比叶面积与其它两地油蒿无显著性差异。3 个种源地油蒿间的表型可塑性指数无显著差异,而库布齐沙漠油蒿的平均可塑性指数显著大于毛乌素沙地油蒿,这可能是毛乌素沙地油蒿比叶面积显著大于库布齐沙漠油蒿,且两者差值较大所引起的结果。
[1] Bradshaw A D.Evolutionary significance of phenotypic plasticity in plants[J].Advances in Genetics,1965,13(1):115-155.
[2] Sultan S E,Stearns S C.Environmentally contingent variation:phenotypic plasticity and norms of reaction[M]//Benedikt Hallgrimsson,Briank Hall.Variation:a central concept in biology.Amster dam:Elsevier Academic Press,2005.
[3] Sultan S E.Phenotypic plasticity for plant development,function and life history[J].Trends in Plant Science,2000,5(12):537-542.
[4] Pigliucci M.Phenotypic plasticity:beyond nature and nurture[M].Baltimore:JHU Press,2001.
[5] Bergamini A,Peintinger M.Effects of light and nitrogen on morphological plasticity of the moss Calliergonella cuspidate[J].Oikos,2002,96(2):355-363.
[6] De Kroon H,Huber H,Stuefer J F,et al.A modular concept of phenotypic plasticity in plants[J].New Phytologist,2005,166(1):73-82.
[7] Shibaike H,Ishiguri Y,Kawano S.Plastic responses to nutrient and light intensity gradients in populations of Oxalis corniculata L.(Oxalidaceae)[J].Plant Species Biology,1996,11(2/3):213-223.
[8] McConnaughay K D M,Coleman J S.Biomass allocation in plants:ontogeny or optimality?A test along three resource gradients[J].Ecology,1999,80(8):2581-2593.
[9] Platenkamp G A J.Phenotypic plasticity and genetic differentiation in the demography of the grass Anthoxanthum odoratum[J].The Journal of Ecology,1990,78(3):772-788.
[10] Sultan S E,Bazzaz F A.Phenotypic plasticity in Polygonum persicaria.II norms of reaction to soil moisture and the maintenance of genetic diversity[J].Evolution,1993,47(4):1032-1049.
[11] Oyama K.Ecological amplitude and differentiation among populations of Arabis serrata (Brassicaceae)[J].International Journal of Plant Sciences,1994,155(2):220-234.
[12] Donohue K,Pyle E H,Messiqua D,et al.Adaptive divergence in plasticity in natural populations of Ⅰmpatiens capensis and its consequences for performance in novel habitats[J].Evolution,2001,55(4):692-702.
[13] Galloway L F.Response to natural environmental heterogeneity:maternal effects and selection on life-history characters and plasticities in Mimulus guttatus[J].Evolution,1995,49(6):1095-1107.
[14] Ackerly D D,Dudley S A,Sultan S E,et al.The Evolution of plant Ecophysiological traits:recent advances and future directions new research addresses natural selection,genetic constraints,and the adaptive evolution of plant ecophysiological traits[J].Bioscience,2000,50(11):979-995.
[15] Weinig C.Plasticity versus canalization:population differences in the timing of shade-avoidance responses[J].Evolution,2000,54(2):441-451.
[16] Portsmuth A,Niinemets U.Structural and physiological plasticity in response to light and nutrients in five temperate deciduous woody species of contrasting shade tolerance[J].Functional Ecology,2007,21(1):61-77.
[17] Niinemets U.Photosynthesis and resource distribution through plant canopies[J].Plant,Cell & Environment,2007,30(9):1052-1071.
[18] 刘家琼,曾泗弟.我国沙漠中部地区主要不同生态类型植物脯氨酸的累积,光合,呼吸和叶绿素含量[J].植物学报:英文版,1988,30(1):85-93.
[19] Schwaegerle K E,Bazzaz F A.Differentiation among nine populations of Phlox:response to environmental gradients[J].Ecology,1987,68(1):54-64.
[20] Sultan S E.Phenotypic plasticity and plant adaptation[J].Acta Botanica Neerlandica,1995,44(4):363-383.
[21] Grotkopp E,Rejmánek M,Rost T L.Toward a causal explanation of plant invasiveness:seedling growth and life-history strategies of 29 pine (Pinus)species[J].The American Naturalist,2002,159(4):396-419.
[22] Maes W H,Achten W M J,Reubens B,et al.Plant-water relationships and growth strategies of Jatropha curcas L.seedlings under different levels of drought stress[J].Journal of Arid Environments,2009,73(10):877-884.
[23] 莫雅芳,吕曼芳,秦武明,等.水分胁迫下细子龙的生长及光合特征研究[J].西北林学院学报,2014,29(1):21-24.
[24] 武高林,杜国祯.植物形态生长对策研究进展[J].世界科技研究与发展,2007,29(4):47-51.
[25] Shipley B,Meziane D.The balanced-growth hypothesis and the allometry of leaf and root biomass allocation[J].Functional Ecology,2002,16(3):326-331.
[26] 王晓鹏,叶梅荣,王松华,等.梯度水分对鱼腥草生长和抗氧化酶活性的影响[J].东北林业大学学报,2011,39(11):50-52.
[27] 井大炜,邢尚军,马海林,等.I-107 欧美杨对不同强度干旱胁迫的形态与生理响应[J].东北林业大学学报,2014,42(1):10-13.
[28] Jaleel C A,Manivannan P,Lakshmanan G M A,et al.Alterations in morphological parameters and photosynthetic pigment responses of Catharanthus roseus under soil water deficits[J].Colloids and Surfaces B:Biointerfaces,2008,61(2):298-303.
[29] Jaleel C A,Gopi R,Sankar B,et al.Differential responses in water use efficiency in two varieties of Catharanthus roseus under drought stress[J].Comptes Rendus Biologies,2008,331(1):42-47.
[30] 安玉艳,梁宗锁,郝文芳.杠柳幼苗对不同强度干旱胁迫的生长与生理响应[J].生态学报,2011,31(3):716-725.
[31] Bazzaz F A,Grace J.Plant resource allocation[J].Trends in Ecology Evolution,1997,12(10):373-375.
[32] Weiner J.Allocation,plasticity and allometry in plants[J].Perspectives in Plant Ecology Evolution and Systematics,2004,6(4):207-215.
[33] 蔡海霞,吴福忠,杨万勤.干旱胁迫对高山柳和沙棘幼苗光合生理特征的影响[J].生态学报,2011,31(9):2430-2436.
