樟子松苗圃土壤真菌的类群1)
2015-03-07武术杰周秀华
武术杰 周秀华
(长春大学,长春,130022)
责任编辑:戴芳天。
栖息于土壤环境中的真菌种类繁多,土壤环境不同,真菌种类及数量有明显差异。真菌在土壤生态系统中发挥着多种多样的功能,如分解有机质、为植物提供养分等,是生态系统健康的指示物[1]。土壤中的许多真菌是植物病害的重要病原菌,它们寄生于各种植物的根部或根颈部,使之发生病变,如:在苗圃中普遍发生的苗木立枯病就是由腐霉菌、镰刀菌及丝核菌引起的。这3 类真菌均属于土壤习居菌,可长期存活于土壤中的病残体上,当条件适宜时侵染苗木[2]。在土壤中也同时存在着多种能够抑制病原菌生长的真菌,此类真菌可以为控制植物病害提供一条有效途径。
笔者对樟子松苗圃地的土壤真菌群落进行研究,旨在了解土壤中真菌的种类和数量,继而分析该土壤环境中的优势种群,找出使苗木感病的病原真菌和对病原菌有抑制作用的拮抗真菌,以便更好地利用樟子松苗圃的土壤真菌资源,为提高土壤肥力、科学防治病害提供理论依据。
1 材料与方法
土样的采集:采样地点为长春市第一苗圃,采集时间为2012年5月份。采用5 点采样法进行土样采集,采集两个垂直深度的土壤,分别为:0 <h(土层深度)≤10 cm 和10 cm <h≤20 cm。每个采集点取样量大体一致,去除植物根系、石砾和其它杂物,土样均匀混合后取500 g 左右装入无菌的封口聚乙烯袋内,编号后将土样带回实验室,于冰箱中4 ℃保存备用。
培养基:采用PDA 综合培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g、KH2PO43 g、MgSO41.5 g、蒸馏水1 000 mL,pH 值自然。
土样含水量测定:分析天平称取土样10 g,装入干燥铁盒内,置于干燥烘干箱,105 ℃烘干8 h。土样烘干后置于干燥器内,冷却后取出用分析天平称量,计算土样含水量。
土样含水量=((土样鲜质量-烘干后土样质量)/土样鲜质量)×100%。
土样真菌分离:分别采用3 种方法进行土样真菌分离[3-4]。
①稀释平板法:称取10 g 新鲜土样,加入到盛有90 mL 无菌水的三角瓶中,置于摇床上,以120~200 r/min 震荡10~20 min,使土样均匀分散于稀释液中,使之成为土壤悬浮液。用移液器吸取10 mL的土壤悬浮液,加入到盛有90 mL 无菌水的三角瓶中充分震荡,使土样稀释至100 倍。移取1 mL 稀释100 倍的土壤悬浮液滴于直径9 cm 的灭菌培养皿中,然后倒入15 mL 即将凝固的PDA 综合培养基,将培养基与土壤悬浮液混合均匀,待凝固后置于25℃恒温箱中培养,每种土样设5 个重复。
②土壤稀释平板法:称取0.001 5~0.015 0 g 新鲜土样置于培养皿中,分散、弄碎,用少量无菌水稀释,然后倒入即将凝固的PDA 综合培养基,将培养基与土样混合均匀,待凝固后置于25 ℃恒温箱中培养,每种土样设5 个重复。
③土壤平板法:称取0.001 5~0.015 0 g 新鲜土样均匀撒于已经凝固的PDA 综合培养基表面,置于25 ℃恒温箱中培养,每种土样设5 个重复。
真菌的鉴定:产生孢子的真菌依据资料进行形态学特征鉴定;将未产生孢子的真菌接入促孢培养基(配方:蔗糖1 g、琼脂5 g、酵母浸膏0.1 g、KH2PO40.1 g、水1 000 mL,pH 值自然)中,待孢子形成后再进行鉴定[5]。
数据统计:真菌出现频率,即检出率=(分离到该菌的菌落数量/出现菌落总数量)×100%。
2 结果与分析
2.1 土样含水量
0 <h≤10 cm 土层的含水量为16.9%,10 cm <h≤20 cm 土层的含水量为18.3%,差异不大。
2.2 樟子松苗圃土壤真菌类群
2.2.1 分离出土壤真菌种类
采用3 种分离方法对樟子松苗圃土壤真菌区系进行分离,共获得土壤真菌19 种(见表1)。在19种真菌中,接合菌1 种,子囊菌2 种,半知菌16 种。除Aspergillus niger 为寄生菌外,其余18 种真菌均为腐生或兼性寄生真菌,适宜长期在土壤中生存。
稀释平板法分离得到真菌种类最多,为17 种;其次为土壤平板法,分离到真菌12 种;土壤稀释平板法分离到真菌最少,为8 种。其中,Fusarium oxysporum、Mucor sp.、Penicillium sp.、Rhizopus sp.等4种真菌以3 种方法均可分离到。稀释平板法主要分离孢子态土壤真菌,土壤稀释平板法主要分离菌丝态真菌,而土壤平板法主要分离土壤中天然态的可生长的菌丝或孢子态的真菌,3 种方法相结合能够更全面地反映土壤中真菌的群落结构。
2.2.2 各土层真菌种类及分离率
在樟子松苗圃0 <h≤10 cm 土层中分离出真菌19 种,10 cm <h≤20 cm 土层中分离出真菌13 种,整体出现频率较不均匀。0 <h≤10 cm 土层中真菌的出现频率明显高于10 cm <h≤20 cm 土层(见表2)。0 <h≤10 cm 土层的透气性较10 cm <h≤20 cm 土层高;就湿度而言,10 cm <h≤20 cm 土层略高,但两个土层湿度相差不大,真菌大多好气、喜湿。综合两个因素,0 <h≤10 cm 土层更适宜真菌生长,因此该土层真菌种类较丰富,且出现频率较高。
0 <h≤10 cm 土层中优势种群为:Mucor sp.、Penicillium sp.、Rhizopus sp.、Fusarium oxysporum、Trichoderma citrinoviride、Verticillium sp.、Aspergillus niger、Cladosporium sp.、Trichoderma viride;10 cm <h≤20 cm 土层中优势种群为:Mucor sp.、Penicillium sp.、Trichoderma citrinoviride、Fusarium solani、Rhizoctonia solani。平均出现频率较高的种群为:Mucor sp.、Penicillium sp.、Trichoderma citrinoviride、Rhizopus sp.、Fusarium oxysporum。

表1 樟子松苗圃土壤真菌分类地位及3 种分离方法对真菌种类的影响
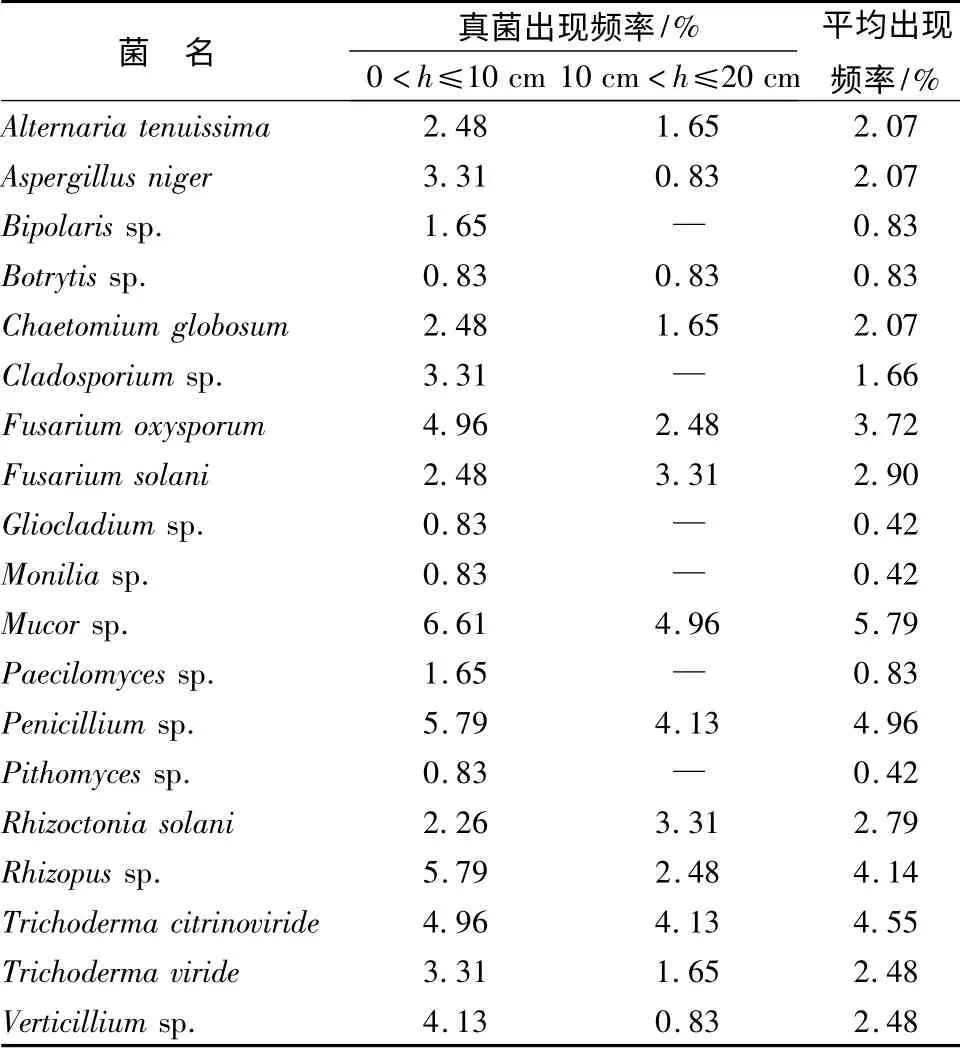
表2 各土层真菌出现频率
3 结论与讨论
在樟子松苗圃土壤中共分离得到19 种真菌,群落种类较为丰富,但出现频率不均匀。这些真菌多为腐生菌或兼性寄生菌,可长期生存于土壤环境中。群落组成上,Mucor sp.、Penicillium sp.、Trichoderma citrinoviride、Rhizopus sp.、Fusarium oxysporum 等5种真菌占明显优势。
在所分离的土壤真菌中,Fusarium oxysporum、Fusarium solani、Rhizoctonia solani 是典型的苗圃致病菌,能引起苗木立枯病,且在土壤中的分离率相对较高,环境条件适应的情况下此苗圃极易发生苗木立枯病。同时,樟子松苗圃土壤中也存在一些具有生物防治潜力的真菌,如:Trichoderma citrinoviride、Trichoderma viride,分离率也相对较高。在一些土传病害的防治中,木霉发挥着重要的作用,如竞争作用、溶菌作用、重寄生作用、诱导抗性作用、抗生作用等[6-7]。本试验分离得到的2 种木霉菌对苗木立枯病病原菌的作用关系有待进一步研究。
[1] 刘会梅,张天宇.土壤真菌研究进展[J].山东农业大学学报:自然科学版,2008,39(2):326-330.
[2] 杜飞,张胜奇,许志远,等.松苗立枯病的研究与防治[J].防护林科技,2006(4):119-120.
[3] 杨莉榕,任文智,贺冰.园林土壤真菌种类的初步研究[J].山西农业大学学报:自然科学版,2008,28(2):149-152,171.
[4] 梁晨,吕国忠.土壤真菌分离和计数方法的探讨[J].沈阳农业大学学报,2000,31(5):515-518.
[5] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[6] 尹大川,邓勋,Ⅰlan Chet.引进木霉菌株T43 对立枯病的抑制效果及对苗木的促生作用[J].中国森林病虫,2012,31(4):1-5.
[7] 邓勋,宋小双,尹大川,等.高效木霉菌株筛选及对针叶苗木立枯病的生防作用[J].吉林农业大学学报,2013,35(3):282-287,294.
