2种α-蒎烯衍生物对舞毒蛾体内酶活性的影响1)
2015-03-07张静马玲陈旭日马伟
张静 马玲 陈旭日 马伟
(黑龙江农业经济职业学院,牡丹江,157041) (东北林业大学) (黑龙江中医药大学)
责任编辑:程 红。
舞毒蛾(Lymantria dispar)隶属于鳞翅目(Lepidoptera)毒蛾科(Liparidae),别名“秋千毛虫”。幼虫可危害桦树、杨树、苹果和梨等500 多种植物,该虫食量大、食性杂,给林业生产和经济发展带来严重的损失。目前,化学防治仍然是控制舞毒蛾暴发成灾的有效措施之一,寻找高效、低毒、低残留的杀虫剂仍是林药研究者的工作重点。
α-蒎烯是一种存在于植物体内的精油类单体,是许多种植物精油活性成分的重要组成部分[1-2]。有学者已经证明α-蒎烯对杂拟谷盗(Tribolium confusum)成虫有较强的触杀、熏蒸作用[3],对斜纹夜蛾(Spodoptera litura)具有一定的控制作用[4]。但是α-蒎烯单体的杀虫效果并不很理想,所以对α-蒎烯的结构进行修饰进而合成具有良好杀虫效果的衍生物是非常必要的。因此,本试验筛选了α-蒎烯的2 种衍生物,测定了其对舞毒蛾3 龄幼虫的急性毒性,并就α-蒎烯2 种衍生物对舞毒蛾体内解毒酶中的羧酸酯酶(CarE)、保护酶中的过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和乙酰胆碱酯酶(AChE)活性的影响进行了探究。旨在探讨这2 种衍生物对昆虫的杀虫机制,为开发高效、安全、对环境友好的新型杀虫剂提供理论依据。
1 材料与方法
1.1 供试昆虫
2014年2月中旬,在东北林业大学示范林场采集舞毒蛾卵块,于冰箱中4 ℃保存,3月下旬取出孵化,在温度(25±1)℃,光照周期为14 h 光照、10 h 黑暗,相对湿度75%的光照培养箱中用饲料喂养。
1.2 主要试剂
牛血清白蛋白(BSA)、考马斯亮蓝G-250、碘化硫代乙酰胆碱(ATCh)、DTNB、5%十二烷基硫酸钠(SDS)、α-乙酸萘酯(α-NA)、毒扁豆碱、甲硫氨酸(Met)、核黄素(VB2)、硝基淡蓝四唑(NBT)、苯基硫脲、过氧化氢、乙二胺四乙酸(EDTA)均购自哈尔滨赛拓生物科技有限公司。
1.3 研究方法
1.3.1 饲料配比
饲料购自中国林业科学院,取22 g 饲料(干质量)和1.8 g 琼脂溶于100 mL 蒸馏水中,加热煮沸一定时间后分装到培养皿中,晾晒一段时间即可进行喂养,饲料即用即配。
1.3.2 舞毒蛾幼虫急性毒性测定
采用饲料混药法(药剂和饲料的干质量比为准)进行舞毒蛾幼虫的毒性测定。依据药物和饲料的干质量比设置衍生物剂量梯度,以不加衍生物的饲料为对照。将健壮、颜色、大小一致的30 头3 龄舞毒蛾幼虫放入盛有饲料的培养皿中,每个剂量为一个试验组,且每组设置3 个平行试验,并设置对照组。在温度(25±1)℃,光照周期为14 h 光照、10 h黑暗,相对湿度75%的光照培养箱中处理。试验进行中不更换饲料,观察舞毒蛾幼虫的死亡症状,及时挑出死亡虫体,分别于12、24、36、48 h 统计死亡数,以探针触动舞毒蛾幼虫尾部2 次,对机械刺激物无反应者视为死亡。
1.3.3 酶液制备
CarE 酶液:随机挑取4 头处理过的舞毒蛾幼虫加入5 mL 预冷的0.04 mol·L-1PBS 提取液(pH=7.0)于玻璃匀浆器内冰浴充分匀浆,4 ℃高速离心,离心力为12 000×g,离心15 min,上清液即是原酶液。
CAT 和SOD 酶液:随机挑取4 头处理过的舞毒蛾幼虫加入5 mL 预冷的0.05 mol·L-1PBS 提取液(含0.04%苯基硫脲(PTU)、1%聚乙烯吡咯烷酮(PVP)、10 mmol·L-1乙二胺四乙酸(EDTA)pH=7.0)于玻璃匀浆器内冰浴充分匀浆,4 ℃高速离心,离心力为12 000×g,离心15 min,上清液即是原酶液。
AChE 酶液:随机挑取4 头处理过的舞毒蛾幼虫加入5 mL 预冷的0.1 mol·L-1PBS 提取液(pH=7.5)于玻璃匀浆器内冰浴充分匀浆,4 ℃高速离心,离心力为12 000×g,离心15 min,上清液即是原酶液。
1.3.4 蛋白质质量浓度测定
蛋白质质量浓度的测定参照Bradford[5]的考马斯亮蓝G-250 法。取0.5 mL 稀释的适当倍数的酶蛋白溶液加入试管中(对照为0.5 mL 蒸馏水),再加入2.5 mL 考马斯亮蓝G-250,充分混匀,室温放置2~5 min 后,于595 nm 下测定吸光值A595,重复3 次,根据标准曲线求出蛋白质质量浓度。
1.3.5 酶活性测定
CarE 活性参照Ibrahim[6]方法:取0.1 mL 待测酶液与2 mL 30 mmol·L-1α-NA 混匀,于35 ℃水浴保温15 min,加入1 mL 显色剂(m(1%固蓝B 盐)∶m(5%十二烷基酸钠)= 2 ∶5)终止反应,于600 nm波长下测定光吸收值。酶活性以每毫克蛋白质每分钟分解底物的纳摩尔数表示。
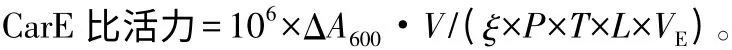
式中:ΔOD 为600 nm 波长光密度变化值;V 为反应总体积(mL);ξ 为摩尔消光系数(13.6 L·mmol-1·cm-1);P 为蛋白质量浓度(mg·L-1);T 为酶促反应时间(min);L 为比色皿光程(cm);VE为加入酶液体积(mL)。
SOD 酶活性测定参照Beauchamp[7]方法略有改进。3 mL 反应液(含50 mmol·L-1PBS pH=7.8,13 mmol·L-1Met,0.1 mmol·L-1EDTA,75 μmol·L-1NBT,加入25 μL 粗酶液,最后加入0.6 mL 的0.5 mmol·L-1核黄素,以不加酶液管作为最大光还原管,光照培养箱中25 ℃,三级光照下(4 000 lx)处理15 min 后,立即避光迅速测定OD560值,以未光照的相同反应管为对照管,反应重复测定3 次,计算SOD酶活性,以达到50%抑制率所需的酶量为一个酶活性单位(nmol·min-1·mg-1),酶活性大小以每毫克蛋白质中的酶活性单位(nmol·min-1·mg-1)来表示,计算公式如下:
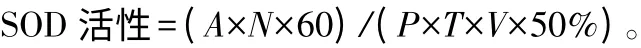
式中:A 为样品与对照的差值;N 为反应总体积(mL);P 为蛋白质量浓度(g·L-1);T 为反应时间(min);V 为反应中加入酶液体积(mL)。
CAT 活性测定参照Cohen[8]方法:取0.5~0.6 mL 30% H2O2,加水至50 mL,从中取出0.4 mL,加入2.6 mL 0.05 mol/L PBS(pH=7.0),测定240 nm 的OD 值,如果OD 值在0.50~0.55,即可作为过氧化氢酶的底物溶液,取3 mL 配制的底物溶液,在25 ℃条件下加入粗酶液0.02 mL,立即用紫外分光光度计在240 nm 下每隔30 s 读一次,共记录3 min。以A240减少0.1的酶量为1 个酶活性单位(nmol·min-1·mg-1)。
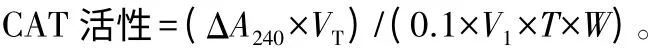
式中:ΔA240为240 nm 下的吸光值;VT为粗酶提取液总体积(mL);V1为测定用粗酶液体积(mL);W 为样品酶液蛋白质量浓度(g·L-1);T 为加过氧化氢到最后一次读数的时间(min)。
AChE 活性测定采用ATCh-DTNB 法[9]。试管中依次加入0.2 mL 稀释酶液,0.8 mL 0.01 mol·L-1ATCh。30 ℃温育10 min 后,加入1.8 mL DTNB 显色剂(含40%乙醇)终止并显色反应,于412 nm 测其吸光值。

式中:ΔA412为412 nm 波长光密度变化值;V 为反应总体积(mL);ξ 为摩尔消光系数(13.6 L·mmol-1·cm-1);L 为比色皿光程(cm);VE为加入酶液体积(mL);P 为蛋白质量浓度(mg·L-1)。
1.4 数据统计分析
采用POLO 软件计算致死中浓度LC50和95%置信区间,用Excel 绘图。运用SPSS19.0 中的Duncan’s 法进行同一时间不同剂量处理下的酶活性显著分析(α=0.05)。抑制率=((对照酶比活力-相应处理酶比活力)/相应对照酶比活力)×100%。
2 结果与分析
2.1 α-蒎烯的2 种衍生物对舞毒蛾3 龄幼虫的急性毒性
从表1中可知,随着处理时间的延长致死中浓度LC50逐渐减小,说明这2 种衍生物对舞毒蛾3 龄幼虫的毒性作用随时间增加逐渐加强。且3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙的LC50明显高于(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺的LC50,48 h 的LC50分别是119.537、62.758 mg·kg-1,表明(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺对舞毒蛾3 龄幼虫的毒性更优。
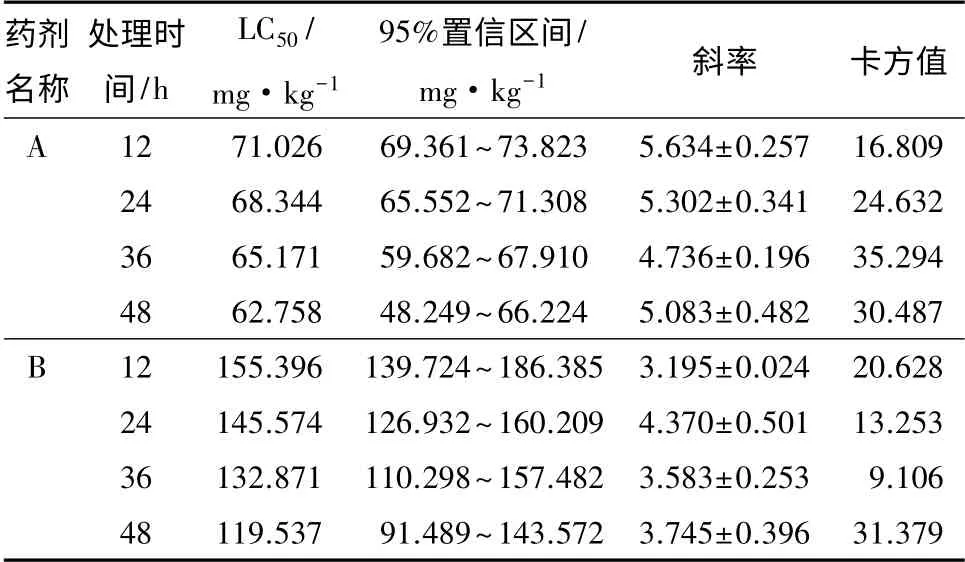
表1 α-蒎烯衍生物对舞毒蛾3 龄幼虫毒力的剂量效应
2.2 α-蒎烯的2 种衍生物对舞毒蛾3 龄幼虫的解毒酶活性的影响
以2 种衍生物对舞毒蛾3 龄幼虫48 h 时LC50为基准,用蒸馏水配置成0.5、5.0、50.0 mg·kg-1亚致死浓度,以蒸溜水做空白对照,来测定这2 种衍生物对舞毒蛾3 龄幼虫体内酶活性的影响。
2.2.1 对CarE 活性的影响
舞毒蛾3 龄幼虫经(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺处理12 h 时,CarE 活性明显低于对照,并且抑制效果随药剂剂量的增加而加强。0.5、5.0、50.0 mg·kg-1处理的抑制率分别为14.67%、26.39%和31.43%;处理24 h 时,只有50.0 mg·kg-1处理的CarE 活性受到明显的抑制,抑制率为16.09%,其他处理剂量的CarE 活性无明显变化;处理36 h 时,0.5、50.0 mg·kg-1处理时CarE 活性明显高于对照,分别为对照的1.25、1.11倍,而5 mg·kg-1时CarE 活性明显被抑制,抑制率为19.88%;处理48 h 时,CarE 活性明显低于对照并随药剂剂量的增加抑制效果加强,0.5、5.0、50.0 mg·kg-1的抑制率分别为9.5%、28.14%和28.95%(表2)。
舞毒蛾3 龄幼虫经3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙处理如表2所示,除24 h、5.0 mg·kg-1处理的CarE 活性显著高于对照外(P<0.05),其他剂量对CarE 活性都有明显的抑制作用并且随处理剂量的增加抑制作用加强:处理12 h 时,0.5、5.0、50.0 mg·kg-1的抑制率分别为19.13%、28.17%和34.21%;处理24 h 时,0.5、50.0 mg·kg-1的抑制率分别为12.83%和24.32%;处理36 h 时,0.5、5.0、50.0 mg·kg-1的抑制率分别为70.97%、28.43%和58.37%;处理48 h 时,0.5、5.0、50.0 mg·kg-1的抑制率分别为25.02%、24.24%和34.57%。
综上所述,2 种衍生物对舞毒蛾3 龄幼虫体内CarE 活性的作用均以抑制为主。
2.2.2 对CAT 活性的影响
舞毒蛾3 龄幼虫经(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺处理12、36、48 h,其体内的CAT 活性都明显的低于对照。处理24 h 时,0.5、50.0 mg·kg-1的CAT 活性表现增强,分别是对照的1.21、1.08 倍,而5.0 mg·kg-1处理时,CAT活性却表现出显著被抑制的现象,抑制率为67.4%;在5.0 mg·kg-1时CAT 活性均达到最大抑制,分别为45.79%、54.05%和63.82%;再随着时间的延长其诱导活性增加(表2)。
舞毒蛾3 龄幼虫经3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙处理12、24 h 时,CAT 活性均显著低于对照,最大抑制率分别为27.51%和46.72%;处理36 h 时,0.5、50.0 mg·kg-1均显著高于对照,分别是对照的1.11、1.31 倍;在5.0 mg·kg-1处理时出现CAT 活性被抑制的现象,抑制率为40.12%;处理36 h 时,CAT 活性均高于对照,分别是对照的1.24、1.62、1.19 倍(表2)。
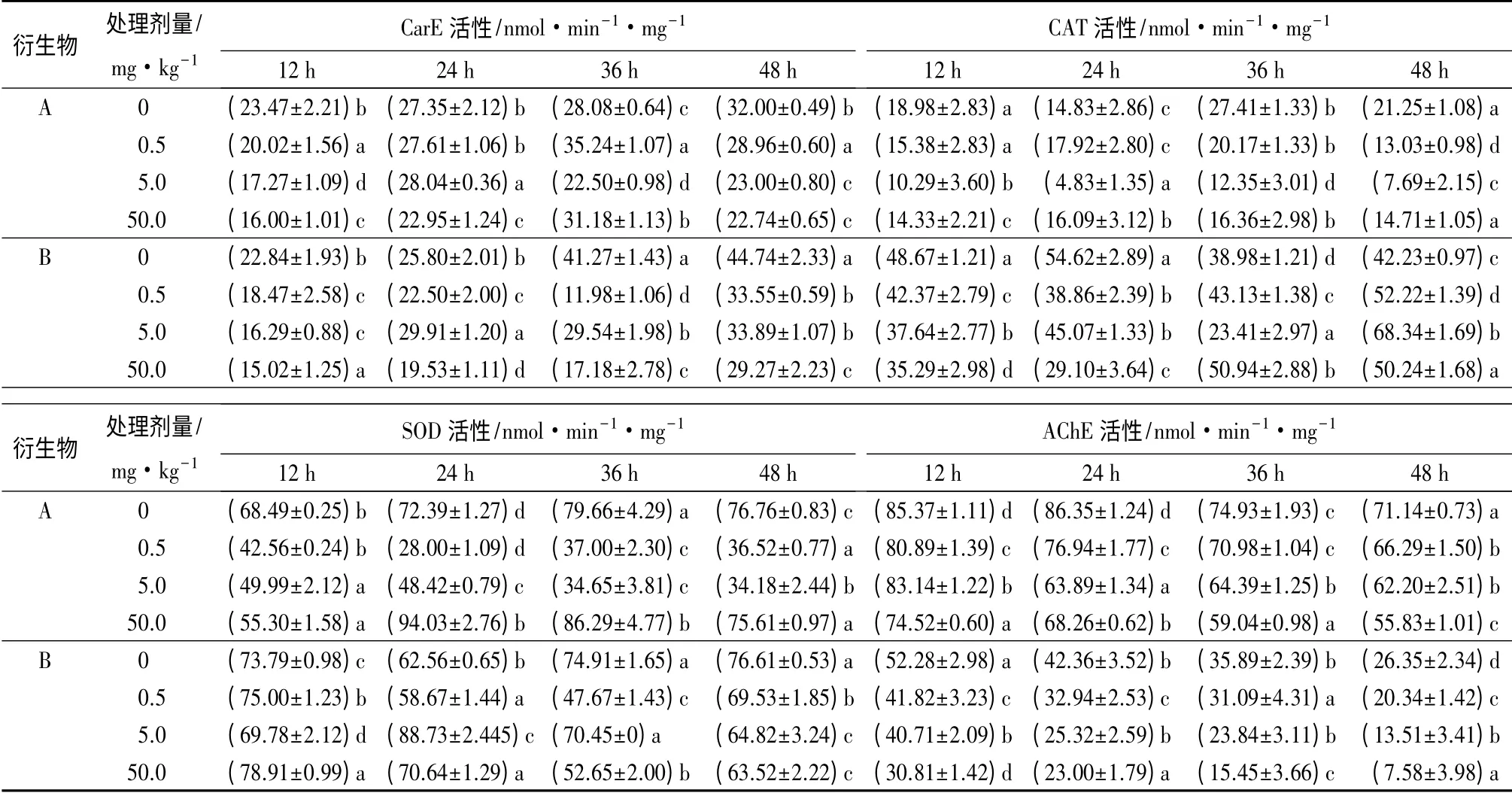
表2 α-蒎烯衍生物对舞毒蛾3 龄幼虫解毒酶活性的影响
2.2.3 对SOD 活性的影响
舞毒蛾3 龄幼虫经(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺处理12、48 h时,SOD 活性降低呈现被抑制状态,最大的抑制率分别为37.88%和52.42%;处理48 h 时,在浓度为0.5、5.0 mg·kg-1时SOD 活性被抑制,抑制率分别为66.31%和33.09%,50.0 mg·kg-1时SOD 活性是对照的1.299 倍;处理36 h 时,0.5、5.0 mg·kg-1的SOD 活性被抑制,抑制率分别为53.55%和56.51%,50.0 mg·kg-1处理的SOD 活性是对照的1.08 倍。各个时间处理过程中,0.5、5.0 mg·kg-1的SOD 活性均低于对照,说明中低剂量会抑制SOD 活性(表2)。
舞毒蛾3 龄幼虫经3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙处理12 h 时,SOD 活性无明显的变化;在处理24 h 时,0.5 mg·kg-1处理的SOD活性低于对照,抑制率为6.22%,在5.0、50.0 mg·kg-1时均高于对照,分别是对照的1.42、1.23 倍;在处理36 h 时,SOD 活性均低于对照,抑制率分别为36.37%、5.95%和29.71%;在处理48 h 时,SOD 活性均低于对照且随处理剂量的增大抑制率增大,分别为9.24%、15.38%和17.09%(表2)。
2.2.4 对AChE 活性的影响
舞毒蛾3 龄幼虫经(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺处理如表2所示,所有处理组的AChE 活性均低于对照组,表现出一定的抑制作用。处理12 h 时,对AChE 活性的抑制率分别为5.24%、2.61%和12.71%;处理24 h 时,AChE 活性先降低后升高,其抑制率分别为10.89%、26.04%和20.95%;处理36、48 h 时AChE 活性随处理剂量的增加而逐渐降低,并且在50 mg·kg-1时出现最大抑制效果,抑制率分别为21.21%和21.51%。
舞毒蛾3 龄幼虫经3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙处理,AChE 活性均低于对照,并且在同一处理时间随处理剂量的增大AChE活性逐渐降低,在同一剂量下,随着处理时间的增加AChE 活性显著降低。在处理时间为48 h 时,AChE活性均达到最大抑制作用,0.5、5.0、50.0 mg·kg-1的最大抑制率分别为22.79%、48.72%和71.23%(表2)。
3 结论与讨论
α-蒎烯是一种具有挥发性的有机化合物,其本身对松纵坑切梢小蠹(Tomicus piniperda)[10]和黑条木小蠹(Trypodendron lineatum)[11]具有一定引诱效果,但其杀虫作用并不理想。本研究发现α-蒎烯的2 种衍生物(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺和3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙对舞毒蛾3 龄幼虫具有较强的毒力作用,其毒力作用均随处理时间的延长增强,48 h 的LC50分别为62.758、119.537 mg·kg-1。综合比较可知,(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺对舞毒蛾3 龄幼虫的毒力作用更加明显。
CarE 是昆虫体内重要的水解酶之一,广泛的存在于各种昆虫体内,主要通过水解某些含有酯键的内源和外来有害物质,使其分解,排出体外,从而达到解毒的目的[12]。本研究表明,α-蒎烯的2 种衍生物对舞毒蛾3 龄幼虫的CarE 活性均以抑制为主。(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺随着处理剂量的增大抑制率加强,但是随着处理时间的增加抑制率却有下降趋势,在处理12 h 时抑制率达到最大值,说明该衍生物在短时间内就可以对CarE 活性达到最高的抑制效果;但是在处理36 h 时却表现出了促进作用,可能是供试昆虫对药物的抵抗作用达到了最大。3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙在处理36 h 时达到了最大抑制,因为该衍生物随处理时间的增加毒力作用达到最大值,在48 h 抑制作用降低,可能是因为舞毒蛾对药剂有了一定的适应性。综合分析发现,3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙对舞毒蛾3 龄幼虫的CarE 活性的影响更加明显。
CAT 可以除去H2O2,分解氢氧自由基,保护机体细胞稳定的内环境和细胞的正常生活。有研究表明[13-14],低浓度的酚类对CAT 有诱导作用。本研究表明,经过(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺处理24 h 时舞毒蛾幼虫体内CAT 活性处于激活状态,最高达对照的1.21 倍。经12、36、48 h 的处理CAT 活性均明显地受到抑制,在5.0 mg·kg-1时CAT 活性均达最低,分别为45.79%、54.05%、63.82%和67.4%,说明此剂量对CAT 活性具有极强的抑制作用;经3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙处理时CAT 活性具有一定的波动,处理24 h、50.0 mg·kg-1的最大抑制率为46.72%,处理36 h、5.0 mg·kg-1的CAT 活性达到最大值,为对照的1.62 倍。对比可知,(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺对舞毒蛾3 龄幼虫的CAT 活性抑制作用比较显著,而激活作用不明显。
SOD 是昆虫细胞内最重要的清除自由基的酶,与昆虫自身防御和对杀虫剂的耐药性、抗逆性有关,这些活性氧自由基若不能及时被清除,则会引起氧化应激等毒理效应。有研究发现[15],利用溴氰菊酯烟剂处理菜粉蝶(Pieris rapae)、褐刺蛾(Setora postornata)后,虫体中SOD 活力均高于正常虫体,表明机体能提高其保护酶活性,以适应外界毒害的影响。研究发现[16],以松油烯-4-醇处理粘虫5 龄幼虫后超氧化物歧化酶(SOD)被明显激活。本研究表明,舞毒蛾3 龄幼虫经(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺随处理剂量的增加SOD 活性均出现先降低后升高的现象,说明此药剂中低浓度可抑制Na+、K+,从而抑制SOD 活性,但随着中毒的加深,SOD 活力明显增加起到对昆虫的保护作用。3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙处理时SOD 活性变化不显著,只有在处理24 h、5.0、50.0 mg·kg-1的SOD 活性明显增大,分别是对照的1.42、1.23 倍。可见,(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺对舞毒蛾3 龄幼虫SOD 活性的影响更加显著。
AChE 是神经突出部位清除乙酰胆碱、维护神经正常传导的重要酶类,其活性是衡量昆虫神经生理活性的主要指标之一。药剂在昆虫体内主要作用于神经系统,抑制AChE 活性,导致神经传导的阻抑而引起昆虫中毒,许多杀虫剂都以此酶为作用靶标。研究表明[17]:高效氯氰菊酯和溴氰菊酯对豆蚜(Aphis craccivora)AChE 活性有抑制作用,还有研究表明[18]:高效氯氰菊酯对德国小蠊(Blattella germanica)AChE 具有明显的抑制。本研究表明,经过2 种衍生物处理的舞毒蛾3 龄幼虫的AChE 活性均低于对照,表现出抑制的作用。(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺对舞毒蛾3龄幼虫AChE 活性有一定的抑制作用但不明显,最大抑制率为26.04%。3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙对舞毒蛾3 龄幼虫AChE 活性表现出显著的抑制作用,并且在同一处理时间随处理剂量的增大AChE 活性逐渐降低,在同一剂量下随着时间的延长AChE 活性逐渐降低,最大抑制率达到71.23%,说明不同杀虫剂作用结果不同,AChE活性随作用时间、浓度的不同而变化[19-20]。
综上所述,2 种衍生物对舞毒蛾3 龄幼虫均有一定的毒力作用,在48 h 时LC50分别为68.344、119.537 mg·kg-1,其中(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]苯胺的毒性更加显著。3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙对舞毒蛾3 龄幼虫体内CarE 和AChE 活性有明显的抑制作用,最大抑制率为70.97%和71.23%,对CAT 和SOD 活性具有明显的激活作用,最大值分别为对照的1.62、1.42 倍;(10z)-N-[5.7.7-三甲基(4.1.0)庚-4-乙二胺-3-亚基]对舞毒蛾3 龄幼虫体内CAT、CarE 和AChE 活性有明显的抑制作用,最大抑制率为67.4%、31.43%、26.04%,对SOD 活性表现出先抑制后激活的现象。
总之,寻找杀虫活性优良的植物源农药来代替光谱的化学农药是现在林业研究者的工作难点,而探索杀虫剂对害虫毒理机制研究是害虫可持续治理中一项复杂而重要的课题,而关于这些酶和这2 种衍生物在分子水平上的关系还有待进一步的研究。
[1] 何益良,王黎明.α-蒎烯大气化学反应的研究进展[J].化学研究,2008,19(2):97-101.
[2] 谭建宁.不同产地生姜挥发油化学成分的GC-MS 研究[J].亚太传统医药,2011,7(4):23-25.
[3] 吕建华,林敏刚,屠亚伟.α-蒎烯对杂拟谷盗成虫的控制作用[J].中国粮油学报,2010,25(12):88-91.
[4] Sekine T,Sugano M,Majid A,et al.Antifungal effects of volatile compounds from black zira (Bunium persicum)and other spices and herbs[J].Journal of Chemical Ecology,2007,33(11):2123-2132.
[5] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry,1976,72(7):248-254.
[6] Ibrahim H,Kheir R,Helmi S,et al.Effects of organophosphorus,carbamate,pyrethroid and organochlorine pesticides,and a heavy metal on survival and cholinesterase activity of Chironomus raparius Meigen[J].Bulletin of Environmental Contamination and Toxicology,1998,60:448-455.
[7] Beauehamp C,Fridovich I.Superoxide dismutase:improved assays and an assay applicable to acrylamide gels[J].Analytical Biochemistry,1971,44(1):276-287.
[8] Cohen G,Dembieck D,Mareus J.Measurement of catalase activity in tissue extracts[J].Analytical Biochemistry,1970,34:30-38.
[9] 高希武.Gorun 等改进的Ellman 胆碱酯酶活性测定方法介绍[J].昆虫知识,1987,24(4):245-246.
[10] Schroeder L M.Attraction of the bark beetle Tomicus piniperda and some other bark-and wood-living beetles to the host volatiles α-pinene and ethanol[J].Entomologia Experimental et Applicata,1988,46(3):203-210.
[11] Czokajlo D,Teale S A.Synergistic effect of ethanol to α-pinene in primary attraction of the larger pine shoot beetle,Tomicus piniperda[J].Journal of Chemical Ecology,1999,25(5):1121-1130.
[12] Cao Chuanwang,Zhang Jing,Gao Xiwu,et al.Overexpression of carboxylesterase gene associated with organophosphorous insecticide resistance in cotton aphids,Aphis gossypii (Glover)[J].Pesticide Biochemistry and Physiology,2008,90:175-180.
[13] 瞿建宏,陈家长,胡庚东,等.苯酚胁迫下罗非鱼组织中过氧化氢酶与谷胱甘肽-S-转移酶的动态变化[J].生态环境,2006,15(4):687-692.
[14] 李响,刘征涛,沈萍萍,等.卤代酚类物质对抗氧化酶活性的影响研究及构效分析[J].环境科学学报,2004,24(5):900-904.
[15] 李周直,沈惠娟,蒋巧根,等.几种昆虫体内保护酶系统活力的研究[J].昆虫学报,1994,37(4):399-403.
[16] 马志卿,颜瑞莉,陈根强,等.松油烯-4-醇对粘虫体内保护酶活力的影响[J].西北农林科技大学学报:自然科学版,2004,32(10):85-88.
[17] 康敬涛,高希武.豆蚜对杀虫剂的敏感性及药剂对豆蚜接酸酯酶和乙酰胆碱酯酶抑制作用的研究[J].中国植保导刊,2009,29(9):5-7.
[18] 张丽,沈孝兵,刘晨星,等.高效氯氰菊酯对德国小蠊乙酰胆碱酯酶和非特异性酯酶活性的影响[J].中国媒介生物学及控制杂志,2002,13(6):416-418.
[19] Westlake G E,Hardy A R,Stevenson J H.Effects of storage and pesticide treatments on honey bee brain acetyl cholinesterase activities[J].Bulletin of Environmental Contamination and Toxicology,1985,34(5):668-675.
[20] Villar D,González M,Gualda M J,et al.Effects of organophosphorus insecticides on Dugesia tigrina:cholinesterase activity and head regeneration[J].Bulletin of Environmental Contamination and Toxicology,1994,52(2):319-324.
